芹菜素-环糊精包合物在溶液中的制备、表征及抗氧化性
李进霞,于肯明,张慧芝,闫燕艳,孙树茂
(山西大同大学医学院,山西大同037009)
芹菜素-环糊精包合物在溶液中的制备、表征及抗氧化性
李进霞,于肯明,张慧芝,闫燕艳,孙树茂
(山西大同大学医学院,山西大同037009)
目的研究芹菜素与β-环糊精及羟丙基-β-环糊精在溶液中形成包合物的过程,并对其包合过程进行表征及抗氧化活性的研究。方法采用荧光光谱法研究芹菜素与环糊精在溶液中的形成过程。采用荧光光谱法及相溶解度法研究所形成的包合物的包合常数及在溶液中的溶解度。通过测定抑制自由基DPPH•的氧化率,比较芹菜素及其包合物的抗氧化活性。结果芹菜素与环糊精形成了1∶1的包合物,其中芹菜素与羟丙基-β-环糊精的包合能力强于β-环糊精。形成的包合物抗氧化能力大大增强,其中芹菜素-羟丙基-β-环糊精包合物的抗氧化能力强于β-环糊精。结论芹菜素与环糊精形成的包合物可以增加芹菜素的溶解度及抗氧化活性,扩大了芹菜素的临床的应用范围。
芹菜素;环糊精;荧光光谱;DPPH•
芹菜素(Apigenin,AP,4’,5,7-三羟基黄酮,图1),存在于许多植物与水果中,作为许多疾病的重要饮食来源和潜在的治疗药物来源备受关注,比如在炎症,抗氧化作用,一些癌症,包括乳腺癌、结肠癌、皮肤癌、白血病、胰腺癌、卵巢癌等[1-3]的治疗中均起到了重要作用。此外,芹菜素还可以影响许多生物膜的活性[4-7]。然而,由于芹菜素溶解度差的物理化学性质及其不宜制成液体制剂注射给药等的生物制药特性限制了其在临床的应用。
环糊精(CDs)是由6~8个右旋单糖分子以α-1,4键相连结合形成的环状多糖超分子化合物,其外部亲水而内部疏水,疏水的空腔在水溶液中具有容纳其他形状和大小适合的疏水性物质的分子、离子或基团嵌入洞中形成包合物。环糊精的包合作用已经被广泛地应用于制药工业及分析领域。另外,由于环糊精与物质之间的作用与机体蛋白质、酶的作用非常相似,临床上将环糊精作为蛋白质、酶的模型来研究[8]。尤其,环糊精与药物分子包合以后可以改变药物分子的理化性质及生物学特性而被广泛应用于制药工业,例如增加母体药物的溶解度、化学稳定性、生物利用度,降低母体药物的毒副作用,还具有缓控释作用等等[9]。
芹菜素与生物分子的包合作用已经被研究[10],而其与环糊精的包合作用还没有相关报道。本文对芹菜素与环糊精及其衍生物的包合进行研究,将对芹菜素的临床药物制备及临床药物应用提供理论指导。

图1 芹菜素分子的化学结构
1 材料与方法
1.1 材料与试剂
芹菜素(色谱纯,HLPC≥98%,南京广润生物制品有限公司)用无水乙醇溶解并稀释成浓度为1.0×10-4mol∕L作为储备液;β-环糊精(β-CD),羟丙基-β-环糊精(HP-β-CD,上海源叶生物科技有限公司)用蒸馏水配成浓度为1.0×10-2mol∕L的溶液;DPPH•(上海源叶生物科技有限公司);无水乙醇 (分析纯)、Mg(Ac)2•2H2O(分析纯)及氨水均为市售产品。
1.2 仪器与设备
UV-7504 PC分光光度计(上海欣茂仪器有限公司);F-2500荧光分光光度计(HITACHI),1 cm石英池,狭缝宽度为5 nm,激发波长为270 nm,发射波长大约为330 nm。
1.3 方法
1.3.1 包合物的制备
分别移取1 mL的芹菜素储备液于10个10 mL的刻度管中,再分别加入0~9 mL的环糊精溶液,混合,用超纯水稀释至刻度,在室温下超声6 h,平衡过夜,溶液分别采用荧光法进行分析。
1.3.2 相溶解度的研究
相溶解度法用于测定包合物的溶解度和包合常数。将过量的芹菜素(8 mg)加入到一系列10 mL的比色管中,比色管内含有系列浓度的环糊精(1.0×10-2mol∕L,0~ 9 mL,包括β-CD和HP-β-CD)。混合物用蒸馏水稀释到刻度,室温条件下超声处理6 h,室温下放置7 d,用G4沙星漏斗抽滤,滤液被稀释后紫外分析。包合常数通过下列公式计算:
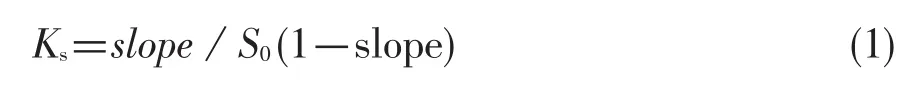
其中,S0是室温条件下不加环糊精时芹菜素的溶解度,slope是相溶解度曲线中相应的斜率。
1.3.3 自由基清除率的研究
通过对稳定自由基DPPH•的清除率来研究抗氧化活性的大小。
DPPH•分别用甲醇和乙醇配制成浓度为1.0×10-4mol∕L的储备液。储备液分别用铝箔纸包裹存放于暗处。
分别取1 mL DPPH•储备液置于10个10 mL比色管中,各加入3 mL浓度为1.0×10-2mol∕L的环糊精溶液(包括β-CD和HP-β-CD)和1~9 mL的芹菜素溶液,最终用甲醇或乙醇稀释至刻度,充分混匀后在室温下平衡30 min,用乙醇溶液或甲醇溶液做空白对照,分别在517 nm的吸收波长处测定其吸收度的值。结果用DPPH•的百分清除量计算,公式如下:
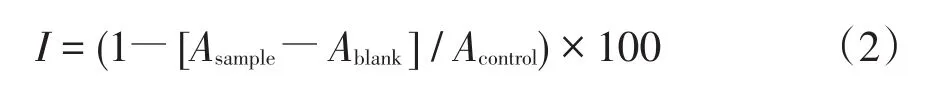
其中,I为自由基清除活性,Asample为样品的吸收度的值,Ablank为不加DPPH•的空白溶液的吸收度的值,Acontrol为DPPH•的吸收度的值。
2 结果与讨论
2.1 荧光光谱法
图2显示了游离芹菜素和芹菜素-环糊精包合物的荧光光谱。激发波长均为270 nm,芹菜素-HP-β-CD包合物的最大发射波长分别是326 nm和335 nm;芹菜素-β-CD包合物的最大发射波长分别是299 nm和324 nm。从图可以看出,随着CDs浓度的增加,其发射峰增强。所有数据显示,芹菜素和CDs之间形成了稳定的包合物。环糊精内腔为芹菜素分子提供了一个非极性的环境,使芹菜素的荧光量子产率增加。
芹菜素与环糊精形成包合物的包合常数(Ks)通过改良的Benesi-Hildebrand方程计算得到。
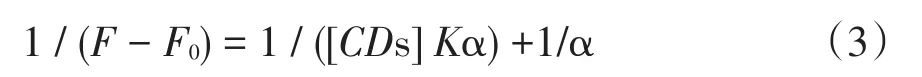
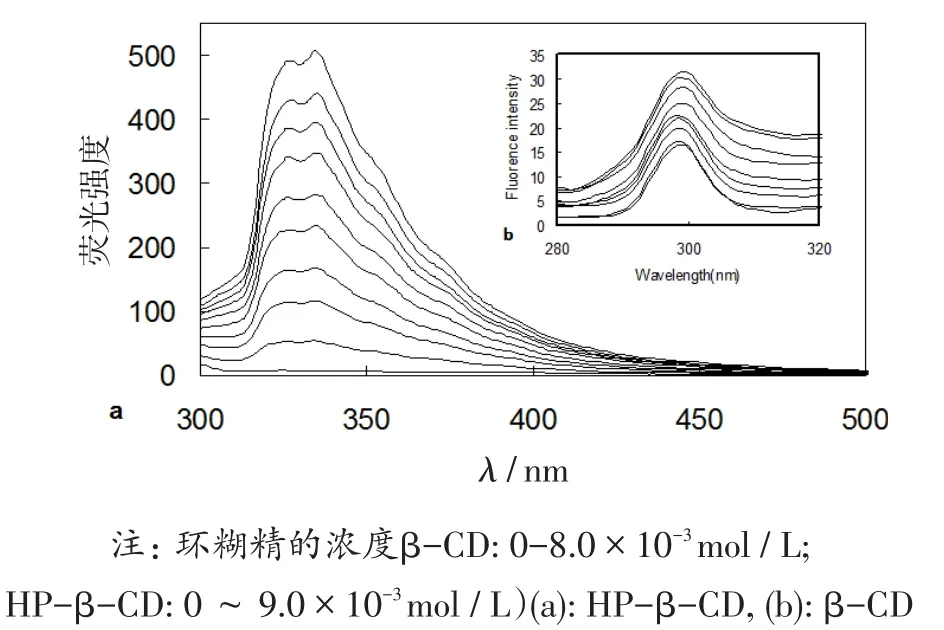
图2 芹菜素-环糊精包合物的荧光光谱
1 ∕(F-F0)与1∕(CD)形成的双倒数曲线如图3所示,其线性关系良好。从图中可以看出,芹菜素和环糊精形成了1∶1的包合物。包合常数(Ks)见表1。可以得到,芹菜素与HP-β-CD的包合常数大于与β-CD的包合常数,表明芹菜素更适合于HP-β-CD形成包合物。
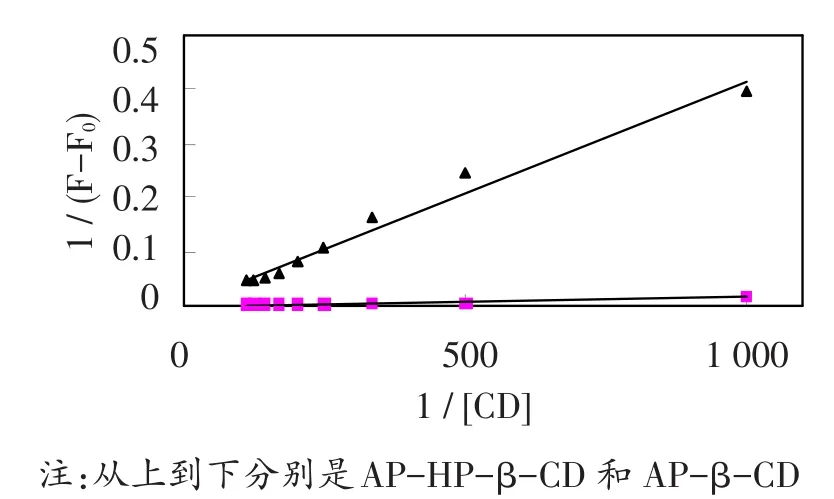
图3 1/(F-F0)与1/[CD]的双倒数曲线

表1 芹菜素与环糊精包合物的相对包合常数
2.2 相溶解度研究
图4为芹菜素与环糊精形成包合物的相溶解度图。可以看出,芹菜素同样和环糊精形成1∶1的包合物,其线性关系良好,包合常数见表2所示,包合能力HP-β-CD大于β-CD。环糊精可以增加芹菜素在水溶液中的溶解度。
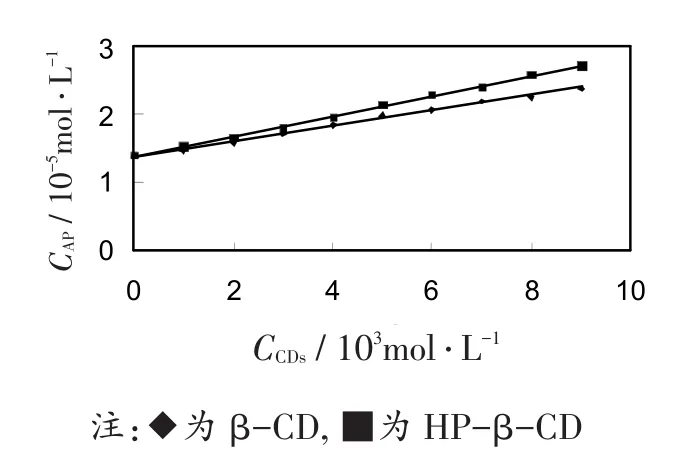
图4 芹菜素和环糊精包合物的相溶解度图。

表2 芹菜素与环糊精形成包合物的包合常数
2.3 自由基清除率研究
自由基清除率用药物抑制自由基DPPH•氧化能力的大小来表示。自由基DPPH•在甲醇和乙醇中的紫外吸收如图5所示。自由基DPPH•在甲醇溶液中的吸收度值高于在乙醇溶液中的吸收度值,说明DPPH•在甲醇溶液中对紫外吸收的敏感性更高。然而在乙醇溶液中线性关系(r2=0.999 0)优于在甲醇溶中的线性关系(r2=0.995 4),因此,实验选择乙醇作为自由基DPPH•的溶剂。实验检测浓度范围为20~60μmol∕L,吸收度值范围在0.221~0.735之间。
芹菜素及芹菜素-环糊精包合物抑制自由基氧化能力的实验如图6所示。在实验研究浓度范围内,芹菜素、芹菜素-β-CD包合物和芹菜素-HP-β-CD包合物对自由基的平均清除率分别为59.6%,75.4%和99.1%。抑制自由基DPPH•氧化的因素包括反应媒介的极性和pH,游离基清除剂的化学结构等,另外,酚类药物的抗氧化能力还与药物分子中羟基化程度,羟基所在的位置及多羟基群有关,药物的抗氧化能力可被另外的羟基群所增强。因而,芹菜素与环糊精形成包合物后,芹菜素分子中的羟基与环糊精分子中的羟基群相互作用可以使包合物的抗氧化能力大大增强。
芹菜素,芹菜素-环糊精包合物对自由基的氧化抑制时间曲线如图7所示。可以看出,药物对抗自由基的氧化作用是瞬间完成的,在实验测试时间范围内抗自由基氧化能力的大小顺序是:芹菜素-HP-β-CD>芹菜素-β-CD>芹菜素。
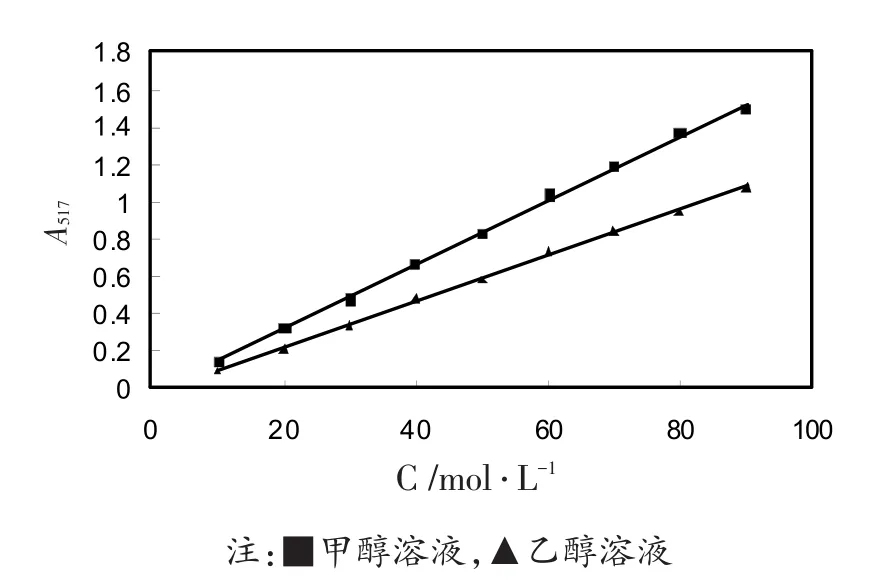
图5 自由基DPPH•在甲醇溶液和乙醇溶液中的紫外吸收图
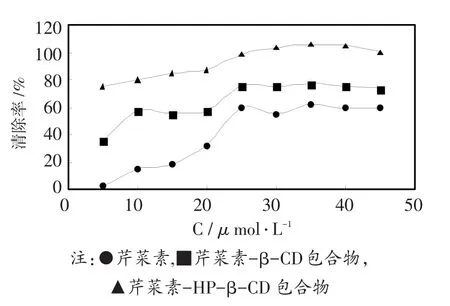
图6 3种物质的自由基清除率
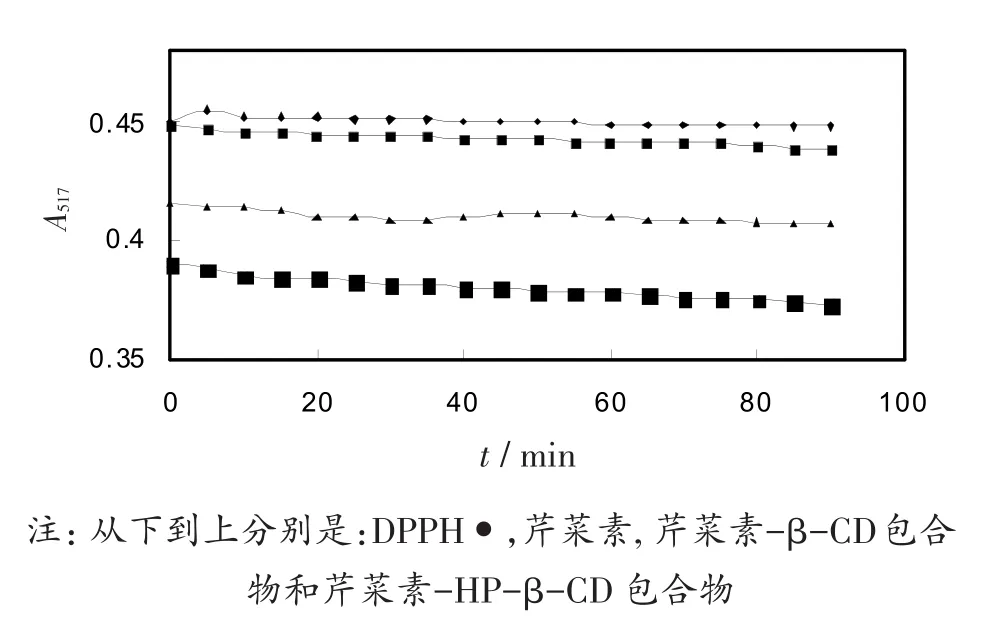
图7 抗自由基清除时间曲线图
3 结论
本研究表明,芹菜素和环糊精(包括-β-CD和HP-β-CD)在溶液中形成了1∶1的包合物,其中芹菜素与HP-β-CD的包合能力强于芹菜素与β-CD的包合能力。形成的包合物在溶液中的溶解度和抗氧化能力均增强,其中芹菜素与HP-β-CD形成的包合物其溶解度及抗氧化能力均比芹菜素与β-CD形成的包合物的溶解度及抗氧化能力强,扩大了临床芹菜素的应用范围和药物制剂范围。
[1]Funakoshi-Tago M,Nakamura K,Tago K,et al.Antiinflammatory activity of structurally related flavonoids,apigenin,luteolin and fisetin[J].Int Immunopharmacol,2011,11:1150-1159.
[2]Tong X,Van Dross R T,Abu-Yousif A,et al.Apigenin prevents UVB-induced cyclooxygenase 2 expression:coupled mRNA stabilization and translational inhibition[J].Mol Cel Biol,2007,27:283-296.
[3]Gates M A,Vitonis A F,Tworoger S S,et al.Flavonoid intake and ovarian cancer risk in a populationbased case-control study[J].Int J Cancer,2009,124:1918-1925.
[4]Duran Meras A,Espinosa-Mansilla D,Airado R.Complexation study of cinalukast and montelukast with cyclodextrines[J].J Pharmaceut Biomed,2007,43:1025-1032.
[5]Carmen L A,Isabel F,Jose M,et al.Cyclodextrins as resveratrol carrier system[J].Food Chemistry,2007,104:39-44.
[6]S Y H,Li H.Studies of the Interaction between Apigenin and Bovine Serum Albumin by Spectroscopic Methods[J].Russ J Gen Chem,2010,80(8):1710-1717.
[7]Wesołowska O,Hendrich A B,Lania-Pietrzak B,et al.Perturbation of the lipid phase of a membrane is not involved in the modulation of MRP1 transport activity by flavonoids[J].Cell Mol Biol Lett,2009,14:199-221.
[8]Hwang T C,Koeppe R,Andersen O.Genistein can modulate channel function by a phosphorylation-independent mechanism:importance of hydrophobic mismatch and bilayer mechanics[J].Biochemistry,2003,42:13646-13658.
[9]Liu I,Yang T,Simon S A.The protein tyrosine kinase nhibitor,genistein,decreases excitability of nociceptive neurons[J].Pain,2004,112:131-141.
[10]Pawlikowska-Pawlęga B,Misiak L E,Zarzyka B,et al.FTIR(1)H NMR and EPR spectroscopy studies onthe interaction of flavone apigenin with dipalmitoylphosphatidylcholine liposomes[J].Biochim Biophys Acta,2013,1828(2):518-527.
〔责任编辑 杨德兵〕
Preparation,Characterization and Antioxidant Activity of the Inclusion Complex of Apigenin with β-Cyclodextrin and HP-β-Cyclodextrin in Solution
LI Jin-xia,YU Ken-ming,ZHANG Hui-zhi,YAN Yan-yan,SUN Shu-mao
(Medical School,Shanxi Datong University,Datong Shanxi,037009)
Objective To determine the interaction of AP with β-cyclodextrin(β-CD)and 2-hydroxylpropyl(HP)- β-CD in detail based on fluorescence method and to determine the effect of the complex process on their antioxidant capacity.Methods The formation of the complexes of apigenin(AP)with ß-cyclodextrin(β-CD)and 2-hydroxylpropyl(HP)-ß-CD was studied by fluorescence spectra in solution.The formation constants(Ks)of complexes were determined by fluorescence method and phase-solubility measurements.Results The results showed that the inclusion ability of β-CD and its derivative were the order:HP-β-CD>β-CD.In addition,the experimental resulted confirmed the existence of 1:1 inclusion complex of AP with CDs.Kinetic studies of scavenging of 1,1-Diphenyl-2-picryl-hydrazyl free radical(DPPH•)with AP and CDs complexes were done.Conclusion The results obtained indicated that the AP∕HP-β-CD complex was the most reactive form,then was β-CD complex,and last was free AP.
apigenin;cyclodextrins;fluorescence;DPPH•
R914.1
A
1674-0874(2015)06-0040-04
2015-09-05
山西大同大学校级青年基金[2012Q4]
李进霞(1979-),女,山西应县人,硕士,讲师,研究方向:中药有效成分的包合。

