高脂高糖饲料联合STZ诱导2型糖尿病大鼠模型STZ最佳剂量探讨
肖艳红,谷佳琦,杨晔娟,牛硕莹,王月堂
(1.承德医学院生物化学教研室,河北 承德 067000;2.承德医学院2011级护理本科)
高脂高糖饲料联合STZ诱导2型糖尿病大鼠模型STZ最佳剂量探讨
肖艳红1,谷佳琦2,杨晔娟2,牛硕莹2,王月堂2
(1.承德医学院生物化学教研室,河北承德067000;2.承德医学院2011级护理本科)
目的:探讨高脂高糖饲料喂养联合链脲佐菌素(STZ)腹腔注射建立2型糖尿病大鼠模型时STZ的最佳用量。方法:32只Wistar大鼠随机分为4个造模组,给予高脂高糖饲料喂养后腹腔注射不同剂量的STZ(15mg/ kg、25mg/kg、35mg/kg、45mg/kg)。分别观察各组大鼠的成模率、死亡率、空腹血糖和体重。结果:造模组Ⅲ(STZ用量35mg/kg)成模率高且死亡率较低;STZ注射72h后,各造模组大鼠空腹血糖水平随STZ注射剂量的增加逐渐升高;造模结束4周后各组大鼠的血糖仍维持在较高水平,且体重明显降低。结论:高脂高糖饲料喂养联合STZ腹腔注射诱导2型糖尿病大鼠模型时STZ的最佳剂量为35mg/kg。
2型糖尿病;动物模型;STZ注射量
在数量急剧增长的糖尿病患者中2型糖尿病占90%。因此,如何准确的建立2型糖尿病动物模型对于糖尿病的研究意义重大。本研究采用Wistar大鼠,在高脂高糖饲料喂养4周的基础上,一次性腹腔注射不同剂量的链脲佐菌素(STZ),通过观察大鼠体重和血糖等指标的变化,探讨诱导2型糖尿病大鼠模型时STZ的最佳用量。
1 材料与方法
1.1实验材料
1.1.1实验动物:健康清洁级雄性Wistar大鼠32只,12周龄,体重180-200g,由北京华阜康科技股份有限公司提供,动物合格证号SCXK(京)2009-0008。大鼠饲养于承德医学院实验动物中心,自由摄食水,室温20-22℃,自然采光,通风良好。
1.1.2饲料:大鼠标准饲料和高脂高糖饲料由北京科澳协力饲料有限公司提供。高脂高糖饲料的配方为:猪油10%、蛋黄粉8%、胆固醇1.5%、蔗糖20%、胆酸钠0.1%、标准饲料60.4%。
1.1.3主要试剂:STZ,美国Sigma公司;血糖仪及配套试纸,三诺生物传感股份有限公司。
1.2大鼠分组 32只Wistar大鼠随机分为造模Ⅰ、Ⅱ、Ⅲ、Ⅳ组,每组8只大鼠。
1.3造模方法大鼠适应性喂养1周,然后给予高脂高糖饲料,为期4周。4周后,大鼠禁食12h,分别给予不同剂量STZ(15mg/kg、25mg/kg、35mg/kg、45mg/kg)一次性腹腔注射。以空腹血糖≥16.7mmol/L为大鼠糖尿病模型建立成功。造模完成后标准饲料继续喂养4周,以观察模型的稳定性。
1.4检测指标
1.4.1成功率与死亡率:以造模成功大鼠只数/每组大鼠总只数计算成功率;以死亡大鼠只数/每组大鼠总只数计算死亡率。
1.4.2空腹血糖:大鼠经内眦于眶后静脉丛采血,分别于造模前、高脂高糖饲料喂养4周后、STZ注射72h后、造模结束4周后,采用血糖仪检测空腹血糖。
1.4.3体重:分别于STZ注射72h后、造模结束4周后称量体重。
1.5统计分析采用SPSS 15.0软件进行统计处理,多组间计量资料的比较行方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1成功率与死亡率造模Ⅰ组大鼠未出现死亡,但只有少数大鼠符合2型糖尿病动物模型的成功标准;造模Ⅱ、Ⅲ、Ⅳ组在注射STZ 72h内先后有大鼠死亡,Ⅱ组、Ⅲ组死亡数量相同;Ⅳ组死亡率最高,Ⅲ组模型成功率最高。见表1:
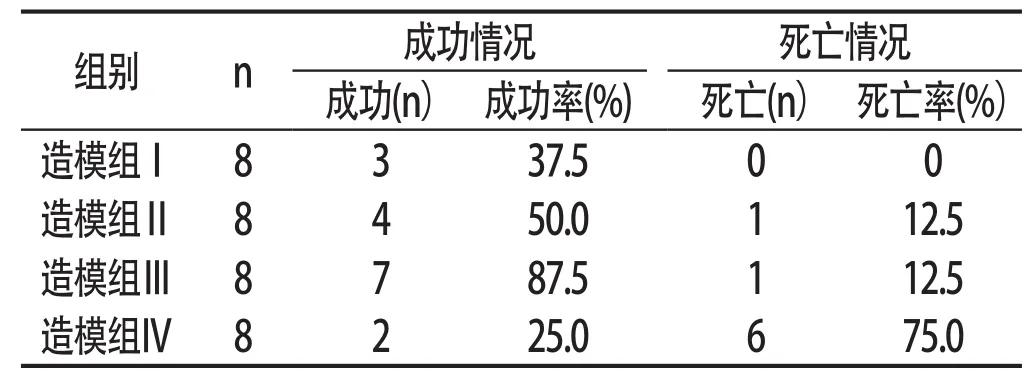
表1 各组大鼠造模成功率与死亡率
2.2空腹血糖与本组造模前比较,四个造模组大鼠高脂高糖饲料喂养后、STZ注射72h后、造模结束4周后的血糖均明显升高(P<0.05);且与造模前比较,造模结束4周后各造模组大鼠仍维持较高的血糖水平。STZ注射72h后不同造模组间比较,随着STZ剂量的加大,大鼠血糖水平逐渐升高。见表2:
表2 各组大鼠的空腹血糖(± s ,mmol/L)

表2 各组大鼠的空腹血糖(± s ,mmol/L)
与本组造模前比较:aP<0.05;与造模组Ⅰ比较:bP<0.05;与造模组Ⅱ比较:cP<0.05
造模结束4周后(nⅠ=8,nⅡ/Ⅲ=7,nⅣ=2)造模组Ⅰ5.54±1.20 5.98±1.06a13.80±3.62a14.56±4.27a造模组Ⅱ5.17±1.07 6.01±1.01a16.47±3.09a18.54±3.94a造模组Ⅲ4.95±0.90 5.96±0.84a20.92±4.37abc21.20±4.52a造模组Ⅳ4.92±1.11 6.14±0.95a26.79±3.54abc26.61±2.05a组别造模前(n=8)高脂高糖后(n=8)STZ注射72h后(nⅠ=8,nⅡ/Ⅲ=7,nⅣ=2)
2.3体重与STZ注射72h后比较,各造模组大鼠造模结束4周后的体重明显降低(P<0.05)。见表3:
表3 各组大鼠的体重(± s,g)

表3 各组大鼠的体重(± s,g)
与本组STZ注射72h后比较:aP<0.05
组别STZ注射72h后造模结束4周后造模组Ⅰ(n=8)305.42±8.57 199.59±8.64a造模组Ⅱ(n=7)316.25±9.31 190.48±8.87a造模组Ⅲ(n=7)324.68±9.22 188.69±9.53a造模组Ⅳ(n=2)328.27±8.76 194.40±8.49a
3 讨论
发生2型糖尿病的始动因素是胰岛素抵抗,因此本研究应用高脂高糖饲料喂养大鼠4周,再给予STZ注射,破坏大鼠胰岛β细胞的功能,从而导致2型糖尿病[1]。STZ与其他药物相比,杀伤胰岛β细胞的能力更强且具有特异性,对肝、肾等脏器的损害更小[2-4]。据报道,禁食是影响造模成功的重要因素,禁食的时间越长,STZ对胰岛β细胞的破坏力越大[5-6],即药效越强,故本研究大鼠造模前需禁食12小时,以减少STZ的用量。
据文献报道,目前常用的2型糖尿病诱导方法是小剂量(20-35mg/kg)的STZ反复应用,或者是短期高脂高糖饲料喂养结合大剂量(50mg/kg)STZ注射[7]。但由于这两种方法对肝肾损害较大,为此,本研究应用高脂高糖饲料长期喂养结合小剂量STZ注射的方法来诱导2型糖尿病大鼠模型。采用这种方法诱导2型糖尿病大鼠模型时,文献报道STZ的用量不同,本研究应用不同剂量的STZ处理大鼠,旨在探讨高脂高糖饲料长期喂养结合STZ注射诱导2型糖尿病大鼠模型时,STZ的最佳用量,以期最终能得到成模率高、成活率高且稳定的2型糖尿病大鼠模型。
结果发现,STZ的用量为35mg/kg时,造模成功率可达87.5%,而死亡率只有12.5%。在造模结束4周后大鼠血糖仍维持在较高水平,表明模型比较稳定;且大鼠体重明显下降,观察到大鼠有懒惰、不愿活动的表现,说明出现糖尿病的典型体征。由此可见,35mg/kg为造模最佳剂量,在保证成功率较高的同时,死亡率最低,模型稳定。
[1]RAKIETEN N, RAKIETEN ML, NADKARNI MR. Studies on the diabetogenic action of streptozotocin (NSC-37917)[J]. Cancer Chemother Rep, 1963, 29: 91-98.
[2]Bolzan AD, Bianchi MS. Genotoxicity of streptozotocin[J]. Mutat Res, 2002, 512(2-3): 121-134.
[3]Szkudelski T. The mechanism of alloxan and streptozotocin action in B cells of the rat pancreas[J]. Physiol Res, 2001, 50(6): 537-546.
[4]杨架林,李果,刘优萍,等.长期高脂饮食加小剂量链脲佐霉素建立人类普通2型糖尿病大鼠模型的研究[J].中国实验动物学报,2003,11(3):138-141.
[5]蒋升,谢自敬,张莉.链脲佐菌素诱导1型糖尿病大鼠模型稳定性观察[J].中国比较医学杂志,2006,16(1):16-19.
[6]于德民,吴锐,尹潍,等.实验性链脲佐菌素糖尿病动物模型的研究[J].中国糖尿病杂志,1995,3(2):105-109.
[7]杜丽坤,赵莹,杜立杰.实验性糖尿病动物模型的建立[J].现代中西医结合杂志,2004,13(5):581-582.
STUDY ON OPTIMAL DOSE OF STZ IN TYPE 2 DIABETES MELLITUS RATS’ MODEL INDUCED BY HIGH-FAT AND HIGH-SUGAR DIET COMBINED STZ
XIAO Yan-hong, GU Jia-qi, YANG Ye-juan, et al
(Department of Biochemistry, Chengde Medical College, Hebei Chengde 067000, China)
Objectives: To explore the optimal dose of streptozocin (STZ) in type 2 diabetes mellitus rats’ model induced by high-fat and high-sugar diet combined STZ. Methods: 32 Wistar rats were randomly divided into 4 model groups. The rats in each model group were fed with high-fat and high-sugar diet and then injected different dose of STZ into the peritoneal cavity respectively (dose of STZ: 15mg/kg, 25mg/kg, 35mg/kg, 45mg/kg). The successful rate, death rate,fasting blood glucose and body weight of rats in each group were observed. Results: The successful rate of model groupⅢ (35mg/kg) was fairly higher but death rate was fairly lower. 72h after injecting STZ, the fasting blood glucose of rats in each model group gradually increased with increasing of STZ dosage. 4 weeks after successfully established type 2 diabetes mellitus rats’ model, the blood glucose of rats in each model group also remained at a high level, but the body weight of rats decreased obviously. Conclusions: The optimal dose of STZ when induced type 2 diabetes mellitus rats’ model by using high-fat and high-sugar diet combined STZ is 35mg/kg.
Type 2 diabetes mellitus; Animal model; STZ injection dose
R945
A
1004-6879(2015)05-0376-03
2015-03-18)

