化浊行血颗粒对动脉粥样硬化模型大鼠血管内皮功能的影响※
周永红张皓胡怀强
(1山东省青岛大学医学院,青岛266021;2中国人民解放军济南军区总医院神经内科,济南250031)
化浊行血颗粒对动脉粥样硬化模型大鼠血管内皮功能的影响※
周永红1张皓1胡怀强2*
(1山东省青岛大学医学院,青岛266021;2中国人民解放军济南军区总医院神经内科,济南250031)
目的研究化浊行血颗粒对食饵性AS模型大鼠血脂、ET-1、NO的影响,探讨中药治疗AS作用机制。方法实验动物按质量随机分为正常对照组、模型组和药物组,每组12只,采用高脂饲料法建立大鼠食饵性AS模型。药物组给予化浊行血颗粒水溶液,正常对照组、模型组分别给予等容量的蒸馏水,连续干预8周后检测各组TC、TG、HDL-C、LDL-C、ET-1、NO。结果与正常对照组比较,模型组TC、TG、LDL-C明显增高(P<0.05),HDL-C基本一致;药物组与模型组比较,TC、TG、LDL-C明显降低(P<0.05),HDL-C明显增高(P<0.05);ET-1、NO三组间均有显著差异(P<0.05)。结论化浊行血颗粒可调控血脂,并保护血管内皮。
化浊行血颗粒;动脉粥样硬化;内皮素;一氧化氮
以动脉粥样硬化(atherosclerosis,AS)为主要病理基础的慢性疾病严重威胁人类健康,已经成为我国的重大公共卫生问题[1],防治AS具有重要的健康效应和经济效应[2]。内皮功能障碍是动脉粥样硬化发生与发展的重要始发因素[3],ET-1和NO是血管内皮细胞产生的关键因子,参与了动脉粥样硬化的过程。为此本文观察了化浊行血颗粒对食饵性AS大鼠血清血脂、ET-1、NO的影响,以期揭示中药复方治疗AS的可能机制。
1 材料和方法
1.1 材料
1.1.1 实验动物成年SPF级雄性Sprague-Dawley(SD)大鼠36只,体重250~300 g,由山东大学实验动物中心提供,实验动物生产许可号:SCXK(鲁)20090001(山东省科学技术厅发),实验动物质量合格证号:鲁动质号1205215(山东省实验动物管理委员会发),检疫后备用,自由摄食进水。实验过程中动物饲养及取材均遵守实验动物管理和保护的有关规定。
1.1.2 实验药物化浊行血颗粒,主要由荷叶、焦山楂、决明子、制水蛭、酒大黄、赤芍、路路通、虎杖、何首乌等组成,由山东鲁信药业有限公司生产(批号:2012031701),并按照成人剂量的20倍(12 g/ kg/d)将其制成水溶液,浓度为1.2 g/ml(即1 ml/ 100g),置于4℃冰箱中备用。
1.2 实验方法
1.2.1 分组方法实验动物购买后,在实验室内适应性饲养1 w,1 w后按体重随机分为正常对照组、模型组和药物组,每组大鼠各12只。因灌胃致吸入性肺炎模型组死亡2只、药物组死亡1只。
1.2.2 造模方法参照文献[4]建立大鼠食饵性AS模型,AS大鼠(包括药物组和模型组)喂食高脂饲料(配方:3%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、5%白糖、10%猪油、81.3%基础饲料),同时在喂食开始时一次性腹腔注射维生素D 60万IU/kg。对照组按照体重给予同等体积的生理盐水。连续喂12周。1.2.3 给药方法造模后,药物组灌胃给予化浊行血颗粒水溶液,剂量为12 g生药/kg/d(相当于70 kg成人每日10倍用量);正常对照组、模型组分别给予等容量的蒸馏水,连续8周。
1.2.4 动物处理与取材给药结束后禁食8 h,100 g/L水合氯醛腹腔注射(300 mg/kg)麻醉动物,于下腔静脉采取静脉血,并分离血清用于检测。
1.2.5 检测指标与方法TC、TG、HDL-C、LDL-C,用全自动生化仪检测;内皮素(endothelin-1,ET-1)检测试剂盒由上海酶联生物科技有限公司提供;硝酸还原酶法测定一氧化氮(nitrogen oxide,NO)水平,试剂盒由南京建成生物技术有限公司提供。
1.2.6 统计学方法所有资料数据用SAS8.1版统计软件进行分析。组间比较用单因素方差分析,所用计量资料均采用(x±s)(均数±标准差)表示。P为双侧检验,P<0.05为有显著性差异。
2 结果
2.1.1 化浊行血颗粒对各组大鼠血脂的影响见表1。
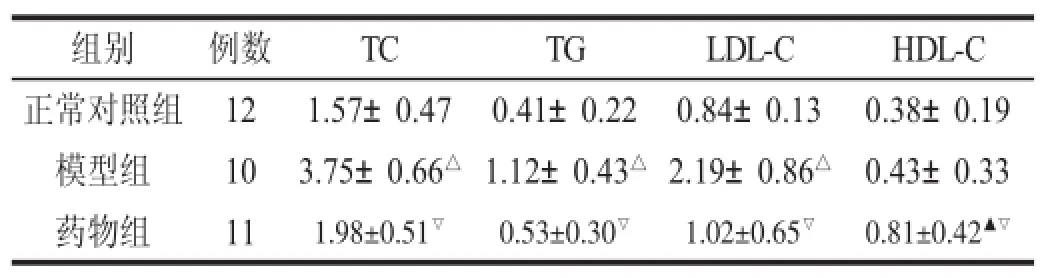
表1 化浊行血颗粒对各组大鼠血脂的影响(mmol/L,x±s)
2.2 化浊行血颗粒对各组大鼠血清ET-1、NO的影响见表2。
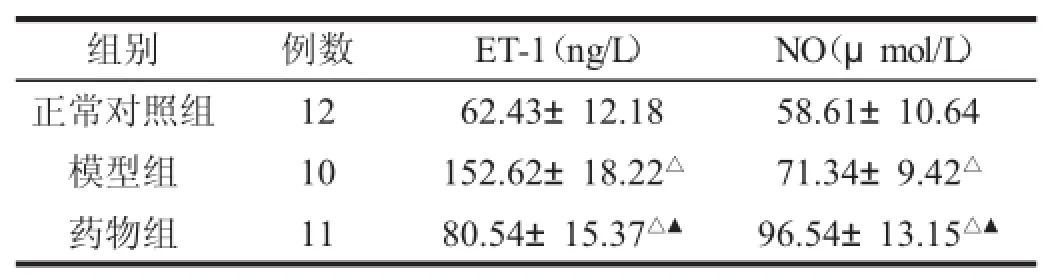
表2 化浊行血颗粒对AS模型大鼠内皮功能的影响(x±s)
3 讨论
随着社会发展、生活水平的提高,人们饮食结构、生活习惯、工作方式及环境等各方面的变化,疾病谱系也随之发生改变,动脉粥样硬化已成为引发心脑血管疾病的重要病因病机。王新陆教授基于当今时病特点,提出了血浊理论,认为血液受体内外各种致病因素影响,失却其清纯状态,或丧失其循行规律,影响其生理功能,因而扰乱脏腑气机的病理现象[5]。高血压、糖尿病、高脂血症、高尿酸、高同型半胱氨酸血症不仅是动脉粥样硬化的独立危险因素,也是均属血浊的范畴[6],血浊是基于中医基础理论提出的病理现象,不仅是各种现代疾病的重要病理基础,形成之后又能作为继发性致病因素,加重其病理变化,血浊的病理特点符合动脉粥样硬化形成与发展,可见血浊是AS的病理枢纽。清化血浊可调整脏腑功能状态,增强脏腑功能,使气旺血和,血脉畅通,瘀祛新生,气化复常,痰浊得消,经络得通,为AS的基本治法。化浊行血颗粒主要由荷叶、焦山楂、决明子、制水蛭、酒大黄、赤芍、路路通、虎杖、何首乌等药物组成,一可化浊,清化血中浊邪,恢复血液的清纯精专状态;二可行血,及时改善血浊带来的血行障碍以及脉道紊乱状态[7],充分体现了清化血浊的治疗方法。该方是本课题组使用多年的临床经验方,在治疗AS方面有较好的疗效[8]。
脂肪浸润学说是动脉粥样硬化形成的主要机制之一。血脂在AS形成和发展过程中扮演着重要的角色,是导致AS和心脑血管疾病的重要原因[9]。通过降低血中TC、TG、LDL-C的水平,减少脂质在血管内皮细胞表面沉积和侵袭,抑制血管平滑肌细胞的增殖和迁移,减缓AS的进展,并使粥样硬化斑块回缩。本文观察了化浊行血颗粒对AS模型大鼠血脂的影响。结果显示,模型组与正常对照组比较,血清TC、TG、LDL-C均明显增高,说明经过高脂饲料喂养可导致大鼠的高脂血症。药物组与正常对照组比较,血清TC、TG、LDL-C无显著性差异,而HDL-C明显增高;药物组与模型组比较,血清TC、TG、LDL-C明显降低、HDL-C增高,说明经过化浊行血颗粒治疗,可有效控制模型大鼠血脂水平,并能有效升高HDL-C水平,这可能是化浊行血颗粒控制血脂,干预动脉粥样硬化斑块形成的机制之一。
血管内皮在调节血管稳态中起关键作用,血管内皮功能障碍是动脉粥样硬化的早期病理表现。内皮素(ET-1)和一氧化氮(NO)是由血管内皮细胞释放的血管活性物质,在维持着正常的血管内皮功能中具有重要作用。ET-1是一种强效、效应持久的内皮源性血管收缩肽,具有十分广泛的生物活性,能促进血小板、炎细胞的积聚,引起巨噬细胞浸润,平滑肌细胞迁徙和增殖[10],是血栓形成、炎症发生的重要细胞因子,血浆ET-1水平与AS的严重程度呈明显的正相关关系[11]。研究结果显示,化浊行血颗粒干预的药物组中ET-1含量较模型组中明显降低,由此可见,化浊行血颗粒可以抑制ET-1的表达,这可能是其治疗AS的机制之一。
NO是血管内皮细胞产生的重要血管舒张因子,是以L精氨酸为底物在不同类型一氧化氮合酶(NOS)催化作用下合成,具有抑制血小板凝聚和黏附因子的表达阻断单核细胞与内皮细胞的黏附,抑制T等收缩血管物质的分泌调节血管张力,抑制低密度脂蛋白(LDL-C)的氧化,进而抑制AS的进展[12],NO参与AS形成、发展的各个环节[13]。实验研究结果显示,药物组NO含量较模型组明显增高,说明化浊行血颗粒可促进血管内皮细胞释放NO,从而抑制动脉动脉粥样硬化形成、发生发展,保护血管内皮。
[1]Heron M,Hoyert DL,MurphySL,et al.Deaths:final data for 2006[J].Natl Vital Stat Rep,2009,57(14):1-134.
[2]蒋立新,李希,李静,等.中国动脉粥样硬化性缺血性脑卒中患者他汀类药物应用现状调查[J].中华流行病学杂志,2010,(8):925-928.
[3]Ross R,Glomset JA.Atherosclerosis and the arterial smooth muscle cell:proliferation of smooth muscle is a key event in the genesis of the lesion of atherosclerosis[J].Science,1973,180(93):1332-1339.
[4]杨鹏远,芮耀诚,焦亚斌.动脉粥样硬化大鼠实验模型的建立[J].第二军医大学学报,2003,24(7):802-804.
[5]王新陆.论“血浊”与“治未病”[J].天津中医药,2008,25(3):177-180.
[6]王新陆.关于血浊理论在现代疾病谱系中作用与地位的探讨[J].天津中医药,2011,28(5):355-357.
[7]王新陆.脑血辨证[M].北京:中国医药科技出版社,2002,110.
[8]胡怀强,周永红,曹秉振,等.化浊行血丸治疗颈动脉粥样硬化症的临床研究[J].天津中医药大学学报,2010,29(2):66-68.
[9]Schafers M,Schober O,Hermann S.Matrix metalloproteinase as imaging targets for inflammatory activity in atherosclerotic plaques[J].J Nucl Med,2010,51(5):663.
[10]潘雪峰,董华进,宫泽辉.内皮素与心血管功能研究的最新进展[J].国外医学药学分册,2007,34,(1):12-16.
[11]张红珍,李丽.内皮素、一氧化氮与动脉粥样硬化及缺血性心脑血管疾病关系探讨[J].中西医结合心脑血管病杂志,2004,2(3):171-172.
[12]潘会君,唐宁,华晓东,等.中药调控一氧化氮合酶-一氧化氮系统的研究[J].中国实验方剂学杂志,2010,16(12):202-205.
[13]Blanco M,Castellanos M,Rodrí guez-Yá ez M,et al.High blood pressure and inflammation are associated with poor prognosis in lacunar infarctions[J]. Cerebrovasc Dis,2006,22(2-3):123-129.
Effect of Huazhuo Xingxue Granules on Vascular Endothelial Function in the Common Carotid Artery of Atherosclerosis Rats
ZHOU Yonghong1,ZHANG Hao1,HU Huaiqiang2
(1 Medical College of Qingdao University,Shangdong Province,Qingdao266021,China;2 Department of Neurology,the General Hospital of Jinan Military Command,Jinan 250031,China)
Objective To explore the effect of Huazhuo Xingxue granules on blood lipid,ET-1 and NO in the common carotid artery of atherosclerosis rats.Methods The rats were randomly divided into control group,model group,and medicine groups.Each group had 12 rats.Establishing AS model by adopting high lipid feed method.The medicine group was administrated with Huazhuo Xingxue granules. The control group and model group were taken orally equivolumetric distilled water.Blood lipid,ET-1 and NO were measured after treatment for a course of 8 weeks.Results Comparing with the control group,the TC,TG,LDL-C and ET-1 of the model group obviously increased,there were significantly difference(P<0.05),HDL-C of model group was in accord with the control group.Comparing with the model group,the TC,TG,LDL-C of the medicine group obviously decreased,there were significantly difference(P<0.05).HDL-C and NO of the medicine group was significantly higher than those of the model group(P<0.05).Conclusion Huazhuo Xingxue granules can regulate blood lipid,and protect vascular endothelial function.
Huazhuo Xingxue granules;atherosclerosis;ET-1;NO
10.3969/j.issn.1672-2779.2015.09.064
1672-2779(2015)-09-0127-03
:杨杰本文校对:范玉芹
2015-04-09)
山东省自然科学基金(No:ZR2010HM109);山东省优秀中青年科学家基金(No:2009BSB02208)
*通讯作者:huhuaiqiang@126.com

