阳极氧化条件对氧化钛纳米管阵列形貌及光催化性能的影响
李 桐,丁士文,柳 涛,张 桢
(河北大学 化学与环境科学学院,河北 保定 071002)
能源危机与环境污染是人类在21世纪面临的两大挑战,开发和利用可再生绿色能源已成为人类社会所面临的重大课题[1].风能和潮汐能等虽属可再生能源,但均受到地理环境等条件的限制.太阳能可以辐射到地球的每个角落,因而成为21世纪最具大规模开发潜力的新能源之一.目前太阳能的利用主要集中在热能和发电两个方面.作为太阳能电池,硅电池由于其较高的转换效率以及硅在地球上巨大的储备量,在太阳能电池产业中占有重要地位.但是硅电池的制作工艺较为复杂,生产成本一直居高不下,而且污染严重.而TiO2染料敏化太阳能电池(Dye-sensitized Solar Cells,简称DSCs)则摒弃了传统的硅电池工艺,它的最大优势是制作工艺简单,成本低[1].其中,一维的TiO2纳米管具有更大的比表面积和更强的吸附能力,表现出更高的光催化活性和光电转换效率[2].TiO2纳米管的常见制备方法有模板合成法[3]、水热合 成法[4]、阳极氧化法[5],其中阳极氧化法被认为是制备二氧化钛纳米管阵列的最便捷和有效的方法.2001年由美国宾夕法尼亚州立大学GRIMES等[6]首次在HF电解液中,运用阳极氧化法在钛片基体上制备出均匀有序的TiO2纳米管阵列,从此纳米管的研究吸引了许多科学工作者[7].采用阳极氧化法制备出的TiO2纳米管阵列,由于其具有高度定向性、较大的比表面积以及较低的制备成本,因而成为近年来太阳能电池,光电催化,传感器领域内的研究热点[8-9].研究发现,TiO2纳米管阵列的微观形貌可以直接影响其转换率,适当的TiO2纳米管径、长度以及纳米阵列的规整度可以直接提高电子的迁移速率,从而提高转换率,在此基础上再加以掺杂改性,会使TiO2纳米阵列进入实际应用.但是通过调控TiO2纳米管阵列的形貌来提高转换率的研究还不多,因此本文作者从改变制备条件出发,分别对电解时间、电压及电解液的改变对纳米管阵列形貌的影响进行了系统研究,从而确定了最佳形貌的制备条件.以酸性红3R染料作为标志物,对制得的TiO2纳米管阵列片进行光催化性能实验,得到了较好的结果.
1 实验部分
1.1 TiO2纳米管阵列的制备
选用纯度为99.9%的钛箔(0.025mm×40mm×50mm),用金相砂纸打磨至表面无划痕,依次放入丙酮、乙醇和蒸馏水中超声清洗10min,然后置于空气中干燥.电解时使用量程为0~30V的稳压直流电源,钛箔(2cm×3cm)作为阳极,铂金电极作为阴极,电解液为含0.5%NH4F(质量分数)的丙三醇与水的混合溶液(体积比=5∶1),电解电压为15 V,电解2h后取出钛箔,在pH=3的盐酸溶液中浸泡30min,然后用蒸馏水冲洗干净,并置于空气中干燥,最后在马弗炉中400℃煅烧1h.分别改变电解时间、电解电压和电解液组成,探索实验条件对TiO2纳米阵列形貌的影响.
1.2 光催化实验
配制20mg/L的酸性红3R染料溶液,用盐酸调节pH=3.分别量取50mL染料溶液加入各个烧杯中,并放入不同条件下制得的样品.将烧杯放在太阳光下进行光催化降解实验,2h后取烧杯中的溶液用紫外-可见分光光度计测量其吸光度,降解效果以脱色率D(%)表示.
D=[(A0-At)/A0]×100%
式中:A0为染料的初始吸光度;At为时刻t=2h时染料的吸光度.
1.3 TiO2纳米阵列的表征
采用扫描电子显微镜(JSM-7500F)对样品的形貌进行表征;采用紫外可见分光光度计(TU-1810)测定脱色率,波长为504nm.
2 结果及讨论
2.1 电解时间对TiO2纳米管阵列形貌的影响
图1是在不同电解时间下TiO2纳米管阵列的SEM.图1a是电解时间为0.5h的TiO2纳米阵列的SEM,从图中可以看出制备时间过短,只有部分产品形成了纳米管,其他部分只是刚刚形成了小孔,且管壁较厚.随着时间增加,成型的纳米管越来越多,管壁也越来越清晰.但是当时间达到3h(图1e),可以看出有的管向外延长,管壁开始变形,管与管之间的间隙增大,并且到达5h(图1f)时此现象更为明显.这是由于时间过短,电解反应停留在阳极氧化膜的初始形成阶段[10](反应式1,2),反应首先在Ti的表面形成了一层致密的TiO2薄膜,当这层膜形成之后才会继续第二个阶段的反应[11](反应式3),在这个阶段TiO2形成可溶性的[TiF6]2-是形成纳米管的必要条件.随着时间增加,在溶解反应的进行下产品会逐渐形成纳米管,管壁也开始变薄,管也会在纵向延伸下去,直到溶解反应达到平衡.当纳米管增长到一定长度时,继续延长氧化时间则无显著效果[12].

由电镜照片可以看出,时间控制在2h即可形成清晰的纳米管,时间的继续增加反而使表面出现了凹凸不平现象,因此将电解时间控制在2h为宜.
2.2 不同电解电压对TiO2纳米阵列形貌的影响
图2是在不同电解电压下TiO2纳米阵列的SEM.图2a是电解电压为10V时的TiO2纳米阵列形貌,可以看出纳米管已经形成,但管径较小,仅有30nm左右;随着电解电压增大,管径有明显的增大趋势;当电压增至30V,出现了管径为130nm的纳米管,但整体不是很均匀.电压的增大直接影响了离子迁移速率.在一定电流密度范围内,电流效率近似相等,第一阶段形成TiO2膜的生长速率正比于电流密度,但若电流密度过大,则阳极氧化的电流效率降低,同时焦耳效应等损耗易造成样品过热,进而导致氧化膜溶解,加快了膜层的击穿[13],因此可知击穿电流的大小是控制后期纳米管管径的关键.电压控制在15V(图3b)时所得的纳米管管径大小适中,且整体大小均匀,管壁清晰,管之间的接触紧密,形貌较好.

图1 不同电解时间TiO2纳米阵列的SEM的照片Fig.1 SEM images of TiO2 nanotube arrays in different reaction time

图2 不同电解电压下TiO2纳米阵列的SEM的照片Fig.2 SEM images of TiO2 nanotube arrays at different voltages
2.3 不同电解液对TiO2纳米阵列形貌的影响
图3是在两种不同电解液下电解形成的TiO2纳米管阵列的SEM照片.相对于丙三醇电解液(图3a),乙二醇电解液(图3b)形成的TiO2纳米阵列管之间的空隙明显增大,纳米管形状较为规则;而丙三醇条件下的纳米管由于彼此接触紧密,使得部分管形成了不规则形状.这是由于丙三醇电解液的黏度大,制备过程中抑制了离子(如H+和F-)的迁移速率,易使管顶部附近的离子浓度分布不均,所以制得的纳米管的形貌较不规则,但纳米管排列紧凑,管孔径相比于乙二醇体系制备的样品大[14].TiO2纳米阵列的均一性对其光电转化的稳定性有很大的影响.可以看出,在乙二醇做电解液形成的TiO2纳米阵列更为均匀、整齐,更适合作为光电转化材料.

图3 不同电解液下电解形成的TiO2纳米阵列的SEM的照片Fig.3 SEM images of TiO2 nanotube arrays in different electrolytes
2.4 TiO2纳米管阵列的光催化性能
2.4.1 不同形态TiO2的光催化性能
图4为酸性红3R溶液脱色率随时间变化的曲线图,其中图4a为无催化剂下20mg/L的酸性红3R溶液在太阳光下的脱色速率曲线,图4b为有TiO2纳米管阵列作为光催化剂下酸性红3R溶液的脱色速率曲线.可以看出在无催化剂作用下酸性红3R溶液会发生较小的脱色,而加入光催化剂后可以大大提高其脱色率.

图4 酸性红3R溶液的脱色率随时间的变化曲线Fig.4 The photocatalytic degradation rate of acid-red 3Ralong with time
图5为不同形态的TiO2对20mg/L的酸性红3R溶液光催化2h时的脱色率的比较图.其中1号是将本实验室制的钒掺杂纳米TiO2水溶胶喷涂在钛箔表面制成的TiO2膜,2号是上述用乙二醇作为电解液制备的TiO2纳米管阵列.本实验室制备的钒掺杂纳米TiO2水溶胶直接加入到染料溶液中脱色率可以达到95%以上[15],而制成膜后脱色率却只能达到9.2%.这主要是膜负载的TiO2量较少,并且单层膜状结构减小了TiO2与染料的接触面积.而TiO2纳米管阵列的脱色率要远远高于TiO2水溶胶膜,这是由于纳米阵列的纳米管状结构使其具有更高的比表面积,在光催化降解时能更好的接触降解染料,从而提高脱色率.

图5 不同形态的TiO2的光催化性能Fig.5 The photocatalytic actives of TiO2in different forms
2.4.2 不同电解时间的TiO2纳米管阵列的光催化性能
图6为乙二醇体系下不同电解时间得到的TiO2纳米管阵列的光催化性能图,电解时间分别为0.5、1、2、3、5、7、9、12、16、24h.由图可知,随着电解时间的增加,二氧化钛纳米管阵列光催化活性逐渐增加,最后趋于不变.最初电解时间增加时,脱色率提高的比较快,这是由于电解时间过短,还不能形成规则的纳米阵列结构;而纳米阵列成型后(5h)降解率依然在缓慢增加,这是由于此时纳米管处于纵向生长时期,不断变长,增加了TiO2的比表面积,有助于提高脱色率.当纳米管的溶解与生长达到平衡时,纳米管的长度不再增加,因此光催化降解率趋于一个稳定值.根据图6可知,电解时间为16h是光催化脱色率的拐点,脱色率达到70%以上.
2.4.3 不同煅烧温度的TiO2纳米管阵列的光催化性能
图7为在乙二醇体系中,不同煅烧温度下得到的TiO2纳米管阵列的光催化性能图,煅烧温度分别为400、450、500、550、600℃.由图可知,随着温度的增加,光催化效果先降低再升高,继而又降低,这主要是由于煅烧温度改变了TiO2的晶型导致的.对几份样品做XRD分析(图8)后可以看出,400℃时出现的衍射峰全部是锐钛矿的特征峰(最强峰2θ=25°),随着温度增加,出现了金红石的特征峰(2θ=27°),并且不断增强,当达到600℃时已经全部转变为金红石型TiO2.由于锐钛矿型的TiO2的光催化性能要优于金红石型的,因此400℃下煅烧的TiO2纳米阵列的光催化效率较高.随着金红石型TiO2所占比重增加,光催化性能有下降的趋势,但是到达一定比例后(550℃下)光催化性能又有所提高.这是由于金红石型为热力学、动力学的稳定态以及有较锐钛矿更低的能隙和在接近400nm的可见光区的强吸收性能[16],当两者达到一定比例时,两者相互作用下可以达到较好的光催化性能.金红石相的质量分数可以用下列公式计算[17]:

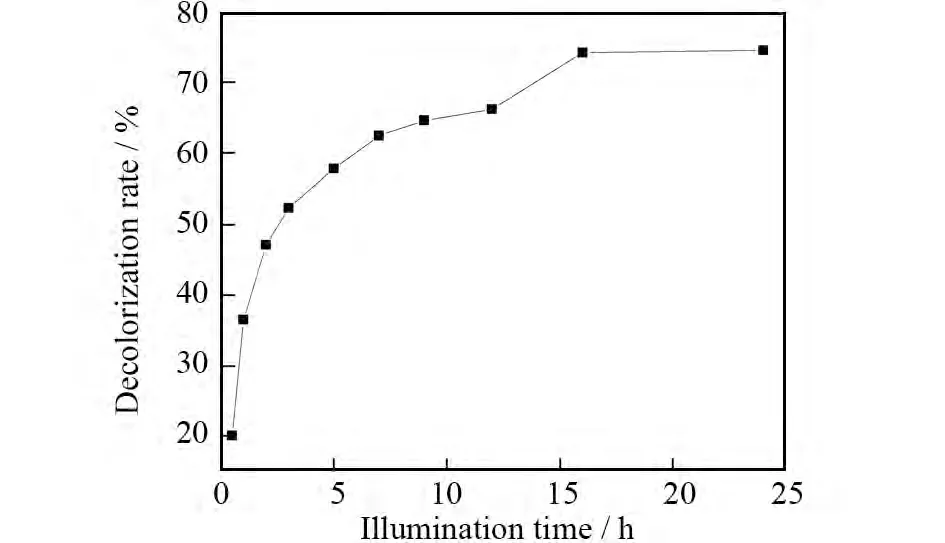
图6 不同电解时间得到TiO2纳米阵列的光催化脱色率Fig.6 The photocatalytic degradation rate of TiO2 nanotube arrays in different reaction time

图7 不同煅烧温度得到TiO2纳米管阵列的光催化性能Fig.7 The photocatalytic actives of TiO2 nanotube arrays in different calcination temperatures
式中:IR为金红石的最强峰强度;IA为锐钛矿的最强峰强度.经计算,在550℃下金红石型TiO2所占比例为50.5%.然而,全为金红石型的TiO2纳米阵列的光催化性能则较差.由于混晶条件下光催化性能较纯锐钛矿型光催化性能相当,出于节约能源角度考虑,选取400℃下煅烧即可.

图8 不同煅烧温度得到TiO2纳米管阵列的XRD图Fig.8 XRD patterns of the TiO2 nanotube arrays in different calcination temperatures
3 结论
TiO2纳米管阵列完全形成需要一定时间,但是形成后继续延长电解时间会使纳米管在纵向伸长.电解电压一定程度上影响纳米管的管径,管径随电压的增大而增大.乙二醇做电解液比丙三醇的TiO2纳米阵列分布均匀,纳米管之间间隙较大.实验结果表明,以含0.5%NH4F(质量分数)的乙二醇与水混合溶液(体积比=5∶1)作为电解液,电压为15V时,电解2h所制得的TiO2纳米阵列的纳米管微观形貌较好.
TiO2纳米管阵列片的光催化活性要远高于TiO2水溶胶膜的活性,并且TiO2纳米管阵列的形貌对其活性有一定影响.延长电解时间可以提高光催化性能,并且混晶态的TiO2纳米阵列(金红石的质量分数为50.5%)具有较高的光催化性能.
[1]冯蕾,程永清,秦华宇,等.染料敏化TiO2太阳能电池的研究进展[J].材料开发与应用,2009(6):81-85.
[2]李欢欢,陈润锋,马琮,等.阳极氧化法制备二氧化钛纳米管及其在太阳能电池中的应用[J].物理化学学报,2011,27(5):1017-1025.
[3]杨丽霞,罗胜联,蔡青云,等.二氧化钛纳米管阵列的制备、性能及传感应用研究[J].科学通报,2009,54(23):3605-3611.
[4]韩文涛,马建华,郝彦忠.二氧化钛纳米管的研究进展[J].河北科技大学学报,2005,12(3):200-201.
[5]刘非拉,肖鹏,周明,等.阳极氧化法制备TiO2纳米管阵列膜及其应用[J].化学进展,2010,22(6):1035-1036.
[6]GONG D,GRIMES C A,VZRGHESE O K,et al.Titanium oxide nanotube arrays prepared by anodic oxidation[J].J Mater Res,2001(16):3331-3334.
[7]田慧,吴玉程,李云,等.TiO2纳米管的制备及光催化性能研究[J].功能材料,2012,12(43):1618-1621.
[8]肖鹏,张云怀,张晓星,等.具有光透性的超长TiO2纳米管阵列/FTO的制备及表征[J].无机材料学,2010,25(1):33-36.
[9]吴建生,宿艳,陈硕,等.硅掺杂TiO2纳米管阵列的制备及光电催化活性的研究[J].功能材料,2009,9(40):1429-1431.
[10]左娟,张裕骏,苏炎国,等.TiO2纳米管在太阳能电池中的应用新进展[J].材料导报,2012,26(8):156-165.
[11]CAI Q Y,PAULOSE M,VARGHESE O K,et al.The effect of electrolyte composition on the fabrication of self-organized titanium oxide nanotube arrays by anodic oxidation[J].J Mater Res,2005,20(1):230-235.
[12]GHICOV A,TSUCHIYA H,MACAK J M,et al.Titanium oxide nanotubes prepared in phosphate electrolytes[J].Electrochem Commun,2005,7(5):505-509.
[13]张舒,陶杰,王玲,等.TiO2纳米管阵列生长进程及微观结构的研究[J].稀有金属材料与工程,2009,38(1):29-33.
[14]金路,高振威,怀静,等.TiO2纳米管阵列的制备工艺对其光催化性能的影响[J].功能材料,2012,20(43):2872-2875.
[15]丁士文,李玲,徐向伟,等.钒掺杂纳米二氧化钛光触媒乳液的制备及性能研究[J].华北电力大学学报,2006,36(6):88-91.
[16]丁士文,王利勇,丁宇,等.微波加热反应制备纳米TiO2混晶及其光催化性能[J].应用化学,2006,23(6):651-653.
[17]王振兴,丁士文,张美红.高分散纳米二氧化钛混合晶体的合成结构与光催化性能[J].无机化学学报,2005,3(3):437-440.

