5-甲基水杨醛缩对氨基水杨酸席夫碱的合成、表征及性质
周 敏,刁海鹏,刘 文,杨锐杰,兰 菲,王浩江,孙体健
(1.山西医科大学 医学化学教研室,山西 太原 030001;2.山西医科大学 药学院,山西 太原 030001)
5-甲基水杨醛是水杨醛的一种取代产物,含有活泼的羰基碳,是一类重要的有机合成中间体.对氨基水杨酸具有解热镇痛、杀菌消炎、抗结核等多种药理作用.它含有酚羟基、羧基、氨基三个非常活跃的官能团,其中氨基可以和醛基生成亚胺及烯胺等.席夫碱是指含有亚胺或甲亚胺基的较稳定亚胺类有机化合物,以含-C=N-结构为特点,使其具有良好的脂溶性和细胞穿透力,能够杀菌、抗肿瘤等,在医药领域具有广泛的应用前景[1-2].血清白蛋白是生命体血浆中含量最丰富的蛋白质,在药物的体内分布和吸收上扮演着重要的角色[3].因此,研究5-甲基水杨醛缩对氨基水杨酸席夫碱与血清白蛋白的相互作用,可以为高活性药物小分子的设计与开发提供很有价值的参考.
1 实验部分
1.1 试剂与仪器
X-4数字显示熔点测定仪(北京泰克仪器有限公司);VARIO EL元素分析仪(德国Elementar公司);Varian 640-FTIR红外光谱仪(美国瓦里安有限公司);AL-300MHz核磁共振仪(日本JEOL公司);Waters2690质谱仪(美国沃特斯公司);雷磁PHSJ-3F型酸度计(上海精密科学有限公司);Cary Eclipse荧光分光光谱仪(美国瓦里安有限公司);
对氨基水杨酸、5-甲基水杨醛、无水乙醇、二甲基亚砜均为市售分析纯试剂;牛血清白蛋白BSA(Mr=68 000,北京夏斯生物有限公司),用pH=7.4的Tris-HCl缓冲液配制成5.0×10-5mol/L的储备液.
1.2 实验方法
1.2.1 5-甲基水杨醛缩对氨基水杨酸席夫碱的合成
在圆底烧瓶中加入0.306g(0.002mol)对氨基水杨酸和0.272g(0.002mol)5-甲基水杨醛,用20 mL乙醇使其溶解,加热回流2h,冷却至室温,析出红色沉淀,抽滤,用无水乙醇和蒸馏水依次洗涤,用无水乙醇重结晶,得橘红色针状结晶,即5-甲基水杨醛缩对氨基水杨酸席夫碱(HL),熔点:223~225℃,产率83.4%.
1.2.2 HL的结构表征
1)元素分析结果为:C15H13NO4(%):C 66.40(66.42);H 4.95(4.83);N 5.15(5.16),括号内为理论值.根据元素分析结果,实验值与理论值相符.
2)红外特征吸收值:由表1数据可知,化合物在1 618cm-1处出现了C=N双键的伸缩振动特征吸收峰[4].在3 066cm-1出现缔合羟基的吸收峰,在2 800~3 100cm-1出现明显的分子内氢键的宽吸收峰.由于羧基的C=O与苯环共轭,使νC=O向低频方向移动,在1 670cm-1出现特征吸收峰,为一尖峰.羧基的不对称伸缩振动νasCOO-和对称伸缩振动νsCOO-分别出现在1 598和1 409cm-1.酚羟基的不对称伸缩振动νasC-O和对称伸缩振动νsC-O分别出现在1 218和1 153cm-1;酚羟基的δOH出现在1 290cm-1[5].

表1 HL的红外特征吸收Table 1 IR data for HL cm-1
3)核磁数据:1H NMR(DMSO-d6)δ:2.25(s,3H,CH3),5.97(m,1H,Ph-OH,4-Asa),6.88~7.86(m,6H,Ph-H),8.90(s,1H,CH=N),11.39(s,1H,Ph-OH),12.30(s,1H,-COOH),以上 数据也说明得到了所需目标产物.
4)质谱(m/z):272.24([M+H]+),目标产物的理论相对分子质量为271.
1.2.3 荧光光谱法
取3支25mL比色管,加入1mL 5.0×10-5mol/L的BSA溶液,然后加入Tris-HCl缓冲液定容至刻度;将HL配制成1.0×10-4mol/L二甲基亚砜溶液;将上述溶液置于恒温仪中(分别设定温度为15、25、35℃)放置一段时间.在荧光光谱实验之前移取一定量该混合溶液于石英比色皿中,固定激发波长为280nm,扫描300~500nm的发射光谱.
2 结果与讨论
2.1 HL对牛血清白蛋白的相互作用的研究
2.1.1 HL对BSA荧光的淬灭效应
蛋白质中由于含有色氨酸、酪氨酸而使其具有内源性荧光,其内源性荧光主要是由色氨酸残基的吲哚基团产生,由此可以根据其发射荧光强度的变化来判断色氨酸残基本身或其周围微环境的变化[6].由图1可知,固定BSA溶液的浓度,随着HL溶液浓度的逐渐增加,在340nm处BSA的发射荧光强度被有规律地淬灭,在380nm处HL的发射荧光强度在不断增强,同时,在370nm处形成等荧光发射点,但两个发射峰的位置基本不变,说明HL与BSA形成了不发荧光或荧光较弱的复合物,对BSA的荧光有淬灭作用.复合物可能是由于HL与BSA的色氨酸残基的吲哚集团发生了相互作用而改变了其微环境.
2.1.2 HL对BSA荧光的淬灭机制
导致BSA荧光淬灭的原因一般来讲有动态淬灭和静态淬灭.动态淬灭是由于分子间的相互碰撞导致蛋白质的荧光强度减弱,不会影响蛋白质的结构.随着温度的升高,通过增加分子的有效碰撞,促进电子的转移,使KSV值随着温度的升高而变大;静态淬灭是由于淬灭剂与蛋白质形成不发荧光的复合物导致荧光强度的减弱.随着温度的升高,复合物的稳定性降低,使KSV值随温度的升高而降低[7].
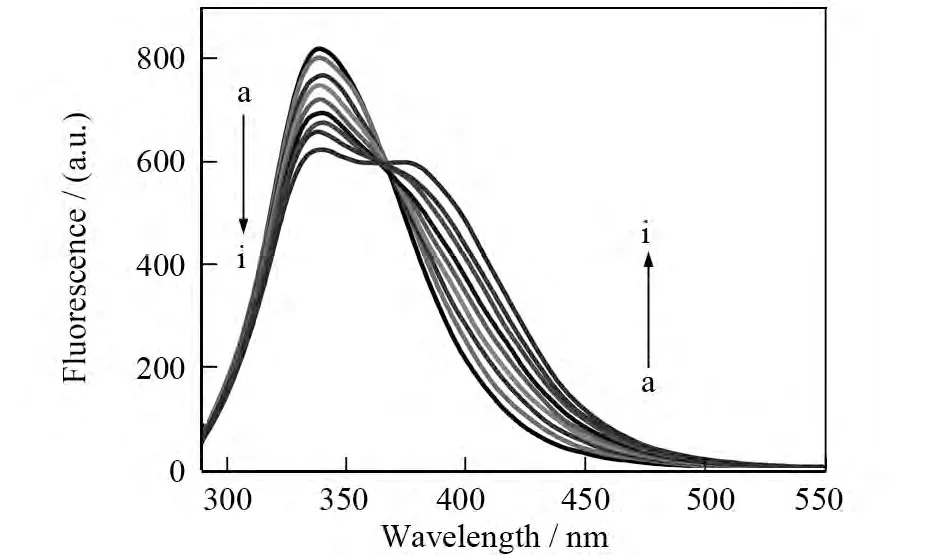
图1 HL-BSA的荧光淬灭光谱Fig.1 Fluorescence spectra of BSA by HL at different concentrations
假设HL对BSA荧光的淬灭为动态淬灭,则作用过程符合Stern-Volmer方程[8]:
F0/F=1+KSV[Q]=1+Kqτ0
式中F0和F分别表示BSA和HL作用前后的所测得的荧光强度值,Kq为双分子碰撞淬灭常数,Kqτ0=KSV,τ0为没有淬灭剂时生物大分子的平均荧光寿命,Ksv为动态淬灭常数,[Q]为淬灭剂的浓度.本文作者考查了15、25、35℃三种温度下HL对BSA作用的荧光光谱,绘制了F0/F与[Q]的关系图(图2).

图2 HL在不同温度下HL-BSA体系的Stern-Volmer曲线Fig.2 Stern-Volmer plots of HL-BSA systems at different temperatures
从图2和表2可以看出,随着温度的升高,曲线的斜率不断下降,即淬灭常数Kq值不断减小,可以推断出BSA荧光的淬灭机制为静态淬灭;另外,经线性拟合得到15、25、35℃3个温度下的相关系数分别为0.997 7、0.996 4、0.990 8,淬灭常数分别为1.18×1013、1.04×1013、8.12×1012L·mol-1·s-1,Kq值均远大于扩散碰撞淬灭常数(2.0×1010L·mol-1·s-1),进一步验证了其淬灭机制为静态淬灭.

表2 不同温度下HL对BSA的淬灭常数Table 2 The Stem-Volmer quenching constant at different temperatures
2.1.3 结合位点数和结合常数的计算
因为HL对BSA荧光的淬灭主要是静态淬灭,利用Scatchard模型,假设HL与BSA形成n个结合位点的复合物,则由荧光强度、结合常数、结合位点数、HL的浓度关系式即可求出结合常数和结合位点数.lg([F0-F)/F]=lgKa+nlg[Q][9],绘制lg[(F0-F)/F]与lg[Q]的关系图(图3).

图3 lg[(F0-F)/F]与lg[Q]的关系图Fig.3 The relationship plots between lg[(F0-F)/F]and lg[Q]
由图3经过线性拟合得到3个温度下的相关系数,分别为0.991 1、0.991 0、0.996 0,结合常数分别为1.43×106、7.45×105、5.83×105L·mol-1,结合位数分别为1.220 6、1.180 1、1.171 6.从以上数据可以看出在整个浓度范围内lg[(F0-F)/F]与lg[Q]呈现良好的线性关系,相关系数良好,结合位点数均接近于1,表明HL在BSA上有一个结合位点(表3).

表3 HL与BSA的结合常数K和结合位点数nTable 3 Kand n between HL and BSA
2.1.4 作用力类型的确定
本质上来说,小分子与蛋白质的结合存在4种主要的非共价类型,分别是氢键、范德华力、疏水作用和静电作用.不同的小分子与蛋白质的作用力类型也不相同.ROSS等[10]根据大量的实验数据得到了小分子与蛋白质作用力类型的判断规律,即根据反应前后热力学参数焓变(ΔH)和熵(ΔS)的相对大小,可以判断出小分子与蛋白质的主要作用力类型.当ΔH<0及ΔS<0时,体系主要为氢键或者范德华力;当ΔH>0及ΔS>0时,体系主要为疏水作用力;当ΔH≈0及ΔS>0时,体系主要为静电作用力.当温度相差不大时,可以把结合作用的焓变近似看作一个常数.根据热力学公式:
ln (K2/K1)=ΔH(1/T1-1/T2)/R
ΔG=ΔH-TΔS ΔG=-RTlnK
由lg[(F0-F)/F]=lgKa+nlg[Q]的双对数拟合方程可以求得不同温度下的Ka,代入热力学公式,即可求得不同温度下的热力学参数(见表4).
由表4数据可知,三种温度下的吉布斯自由能(ΔG)均小于0,表明结合反应不但能进行,而且能自发的进行.ΔH及ΔS均小于0,表明HL与BSA的相互作用主要是氢键和范德华力.

表4 HL与BSA结合过程的热力学参数Table 4 Thermodynamic parameters of HL-BSA binding process
2.2 HL对BSA的构象的影响
在恒波长同步荧光分析法中,固定激发波长与发射波长间距Δλ,同时扫描激发和发射两个单色器波长.通常情况下,固定Δλ=15nm和Δλ=60nm所得到的同步荧光光谱分别为蛋白质酪氨酸残基和色氨酸残基的光谱特征,而BSA中含有色氨酸和酪氨酸残基而发射较强的内源性荧光,其最大吸收波长与其所处环境的极性有关[11],因此可以根据同步荧光光谱来判断HL和BSA作用前后对BSA构象的影响.固定BSA溶液的浓度,逐渐滴加HL,得到BSA的同步荧光光谱,如图4所示.

图4 HL与BSA作用的同步荧光光谱Fig.4 Effect of HL on the synchronous fluorescence spectra of BSA
由图4可知,随着HL浓度的不断加大,Δλ=15nm处的酪氨酸和Δλ=60nm处的色氨酸的荧光强度都会降低.Δλ=15nm时同步荧光光谱显示荧光激发峰和位置均未发生明显变化,说明HL的加入对BSA中酪氨酸的构象无明显影响;Δλ=60 nm时同步荧光光谱显示最大发射峰略微发生了蓝移,表明HL与BSA的结合位点与色氨酸残基靠得更近.外部环境的稍微改变,导致其荧光强度下降的更显著[12].尽管荧光激发峰的位置略微发生移动但变化不是很明显,说明HL的加入对BSA中色氨酸的构象也无明显影响.由此可见HL的加入对BSA的构象无明显影响.
3 结论
实验结果表明,该席夫碱与BSA作用后淬灭了BSA的荧光,通过计算不同温度下的淬灭常数得出其作用机理为形成复合物的静态淬灭;通过在不同温度下的热力学参数计算得出其作用力类型为氢键和范德华力,且结合常数为1;通过同步荧光光谱法得出其对蛋白质的构象无明显影响.
[1]GHORAB M M,SHAABAN M A,REFAAT H M,et al.Anticancer and radiosensitizing evaluation of some new pyranothiazole-Schiff bases bearing the biologically active sulfonamide moiety[J].Eur J Med Chem,2012,53:403-407.
[2]冯辉霞,李汉峰,王利杰.席夫碱类金属配合物催化剂催化氧化烯烃研究进展[J].应用化工,2011,40(2):315-318.
[3]薛泽春,程新胜,杨丽文.尼古丁淬灭牛血清蛋白荧光机制的研究[J].上海交通大学学报:农业科学版.2006,24(1):44-47.
[4]孔德源,谢毓元.氨基酸类Schiff碱稀土配合物的合成及抗肿瘤活性[J].中国药物化学杂志,1999,9(3):9-13.
[5]高书燕,秀英,雷雪峰,等.水杨醛缩5-氨基水杨酸Schiff碱及其稀土配合物合成、表征和抑菌活性[J].应用化学,2006,23(1):74-78.
[6]HUA Y J,LIU Y,WANG J B,et al.Study of the interaction between monoammonium glycyrrhizinate and bovine serum albumin[J].J Pharm Biomed Anal,2004,36:915-919.
[7]杨冉,屈凌波,陈晓岚,等.柚皮素、柚皮苷与溶菌酶相互作用的荧光光谱法研究[J].分析化学,2006,64(13):1349-1354.
[8]李玉琴,贾宝秀,姚晓军,等.光谱法与分子模拟对左旋紫草素和人血白蛋白键合作用的研究[J].分析测试学报,2009,28(12):1396-1400.
[9]闻晓东,李萍,钱正明,等.三种抗氧化物质与牛血清白蛋白的相互作用[J].化学学报,2007,65(5):421-429.
[10]ROSS P D,SUBRAMANIAN S.Thermodynamics of protein association reactions:forces contributing to stability[J].Biochemistry,1981,20(11):3096-3102.
[11]HU Y Y,XU S Q,ZHU X S,et al.Study on the interaction between methyl violet and bovine serum albumin by spectral analyses[J].Spectrochim Acta A,2009,74(2):526-531.
[12]孙坤,张爱平,王锐利,等.荧光光谱法研究青蒿素类抗疟药与CYP2B6酶的相互作用[J].分析测试学报,2011,7(30):750-754.

