CAR-T细胞疗法新靶点开发专利技术发展状况分析
郭婷婷,田小藕
·调查与研究·
CAR-T细胞疗法新靶点开发专利技术发展状况分析
郭婷婷*,田小藕*
采用 CAR-T 细胞治疗,使一位当时年仅 6 岁险些被晚期白血病置于死地的患儿奇迹般地挣脱了死神的束缚,让更多的研发者看到了希望的曙光,CAR-T 细胞治疗研究日趋白热化。
CAR-T,即表达嵌合抗原受体(chimeric antigen receptor,CAR)修饰的 T 细胞。CAR 由胞外抗原结合域(scFv)、跨膜结构域和胞内信号传导结构域组成。CAR-T 细胞治疗技术,是指通过将上述 CAR 结构在体外进行基因重组得到重组质粒,再在体外将其导入到患者的 T 细胞内,使其表达上述嵌合抗原受体,然后经过纯化和体外大规模扩增后,再输回患者体内行使杀灭肿瘤细胞的功能[1]。CAR-T 疗法的优势在于其与肿瘤抗原的结合不需要依赖于 HLA 的呈递,有效避免了肿瘤细胞 HLA 表达下调这一免疫逃逸机制,并能够在短时间内产生大量具有肿瘤杀伤效力的 T 细胞,从而使其具备临床应用前景。
CAR-T 细胞治疗技术实质上是一种靶点依赖型治疗,CAR 结构中包括一个肿瘤相关胞外抗原结合域,目标抗原的选择对于 CAR 的特异性、有效性及安全性都是至关重要的。理想的目标抗原仅在肿瘤细胞表达,而在正常细胞中不表达,但技术发展至今,被视为靶点的一些肿瘤相关抗原仍可能在正常细胞中低水平表达,导致免疫治疗产生脱靶毒性,引发严重的副反应,因此,对于肿瘤免疫治疗新靶点的探索,一直备受关注。专利申请能够从一定程度上反映领域中的前沿技术,本文从专利申请角度对 CAR-T 靶点开发技术进行分析,揭示该领域的技术热点和竞争格局。
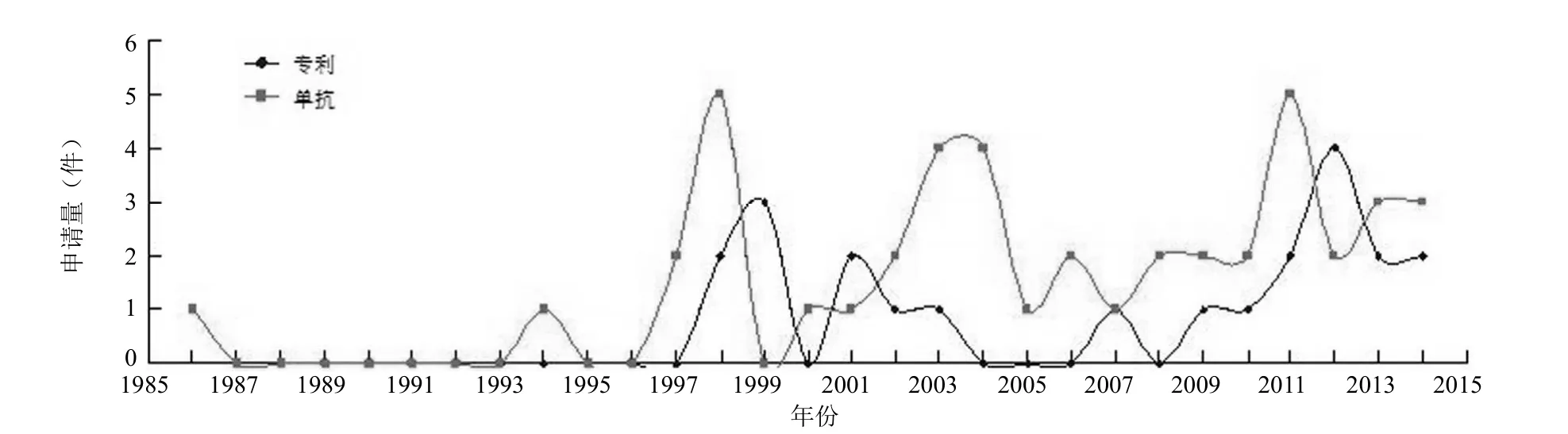
图1 CAR-T 靶点开发相关专利申请量和 FDA 批准单抗数量
1 CAR-T 靶点相关专利分析
以国家知识产权局自主开发的专利检索与服务系统中的德温特世界专利索引数据库(简称 DWPI)、世界专利文摘数据库(简称 SIPOABS)和中国专利文摘数据库(简称CNABS)为数据来源,以关键词和分类号作为主要检索手段,对涉及 CAR-T 靶点开发技术的相关专利申请进行检索,检索时间截止至 2015年6月30日,对检索结果进行逐一阅读和手工筛选,剔除发明点不在 CAR-T 靶点开发技术的专利申请。
1.1 申请量趋势分析
按同族专利的最早申请日计,同时将衍生专利和其基础专利以基础专利计,图1 反映了 CAR-T 靶点开发相关专利申请量发展趋势和 FDA 各年度批准的单抗的数量。
由于 CAR-T 属于靶点依赖性治疗,因此 CAR-T 靶点的开发状况与抗体的研究水平息息相关。由图1 可见,1994年后经 FDA 批准的相当数量的单抗开始涌现,与此同时,CAR-T 新靶点相关专利也开始出现。从 1998年起直至2014年,几乎每年都有申请,虽然数量不多,但整体显示发展平稳,与 FDA 批准单抗量的趋势大体相当。各年度专利申请量不多也说明了肿瘤抗原新靶点的开发并非易事。
1.2 申请区域分布
以技术原创国家为准,按照申请量由高到低对 CAR-T靶点开发技术相关专利申请的国家进行排序,结果如图2所示。可以看出,申请量最大的是美国,独占鳌头,究其原因,其强大的经济实力、完备的临床试验研究、充满诱惑力的资本市场都无不吸引着研发者的眼球。而中国还未涉足新靶点研发领域,技术实力显示出明显的差距,虽然也具备能够开展 CAR-T 临床试验的研发团队,但所申请的专利涉及的是已报道的靶点的后续研究。
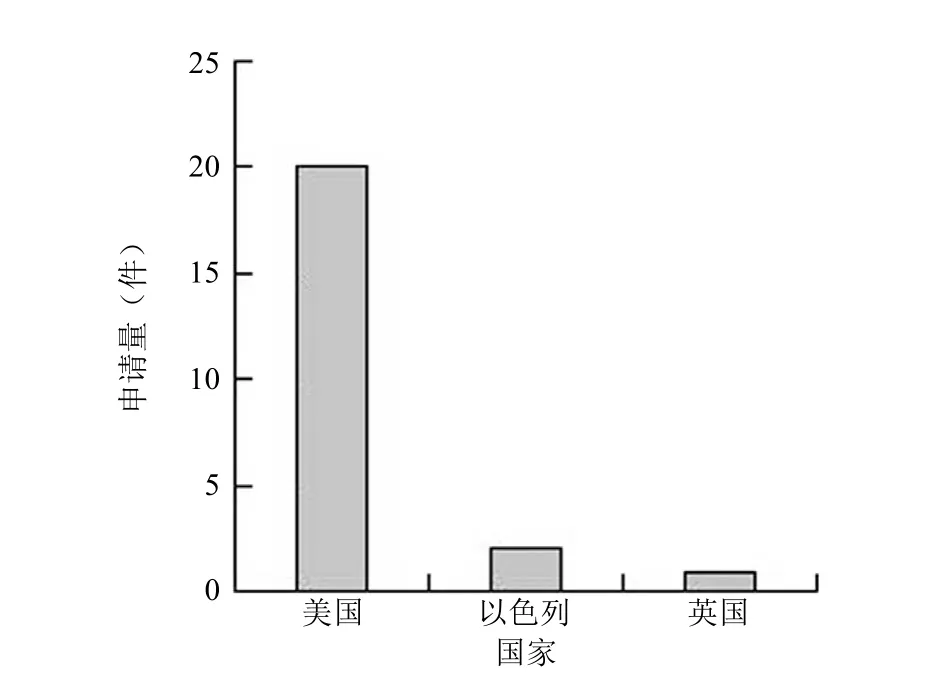
图2 CAR-T 靶点开发技术相关专利申请的国家分布
1.3 技术发展路线
综合考虑技术高度及临床应用情况,筛选出具有代表性的专利申请,根据时间阶段制得图3,得到技术发展路线,并在其中标注了中国相关专利申请的情况。
早在 1989年,Eshhar 研究组的专利申请 IL8627888A就报道了将 scFv 和 FcεRI 受体(γ 链)或 CD3 复合物(ζ 链)胞内结构域融合形成嵌合 T 细胞受体,表达 CAR的 T 细胞能够以抗原依赖、非 MHC 限制的方式结合肿瘤抗原,启动并活化特异性杀伤肿瘤细胞的反应。该专利申请正式宣告了 CAR-T 的诞生。而后的十几年间,研究者们陆续提出了采用结肠癌抗原癌胚抗原(CEA)[2]、结直肠癌抗原 A33[3]以及前列腺特异性膜抗原 PSMA[4]的相应抗体制备嵌合抗原受体(CAR),但还都停留在设想阶段,这些专利申请中并未给出采用相应的 CAR-T 细胞治疗癌症的确凿的实验证据。
1.3.1 针对血液肿瘤的 CAR-T 靶点 1999年,FDA 于1997年批准的针对非霍奇金淋巴瘤、慢性淋巴细胞白血病抗原 CD20 的利妥昔单抗(Rituximab)在应用于临床研究时取得了可喜的疗效,且当时的临床研究发现恶性 B 细胞下调 CD20 表达的能力有限,CAR-T 领域研究者们迅速捕捉到了这些关键成果,使得 CD20 成为了有吸引力的靶点。美国希望之城癌症研究医院(CITY OF HOPE)的专利申请WO1999US24484 首次报道了采用 CD20 作为 CAR-T 的靶抗原应用于治疗非霍奇金淋巴瘤及慢性淋巴细胞白血病,并在体外水平证实了其疗效。随后的专利申请 US20040797609、WO2011US64191等也都是基于 CD20 抗原作出的。中国人民解放军总医院的抗 CD20-4-1BB-CD3zeta 项目已发布I 期临床数据,在 7 例化疗难治性、晚期弥漫性大 B 细胞淋巴瘤(DLBCL)患者中,含有大块肿瘤的 2 个患者当中的 1 例经 CAR-CD20T 细胞治疗后在 14 个月内显示完全缓解,另一例 6 个月内表现部分缓解。4 个有较大块肿瘤负荷病例当中的 3 个治疗后取得 3~6 个月缓解,总应答率 75%[5]。
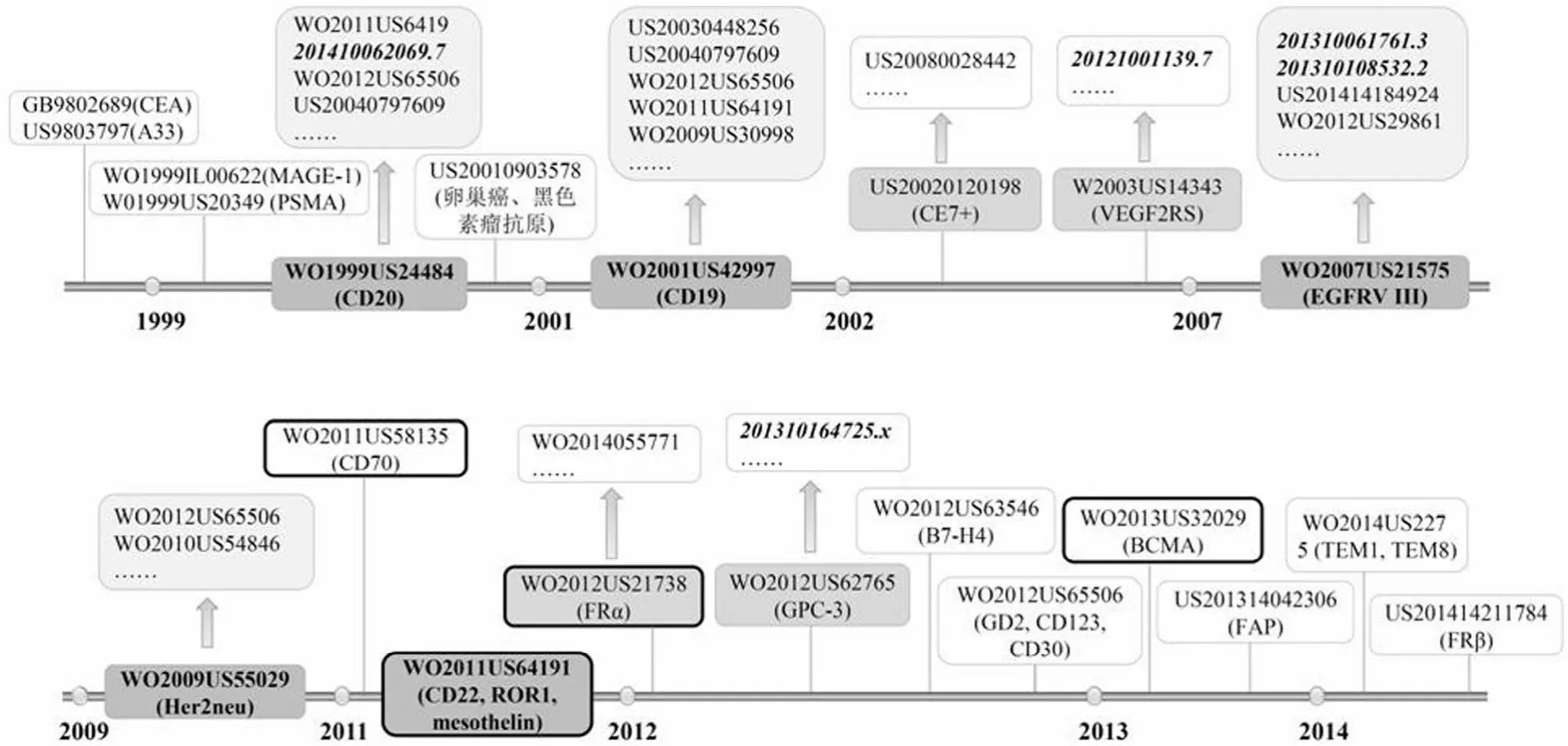
图3 CAR-T 靶点开发相关专利技术发展路线(斜体显示的是中国申请人的专利申请,粗线框内显示的是进入中国的 PCT专利申请)
两年后,美国希望之城癌症研究医院的另一篇专利申请WO2001US42997 也有着划时代的意义。基于当时的相关研究发现,CD19 抗原在所有人恶性 B 细胞中均有表达,采用 CD19 单抗和毒性试剂构成的连接物可特异性地将毒性试剂递送到恶性 B 细胞的胞内部分,且抗 CD19 的抗体也已进入了临床试验阶段,于是上述专利申请提出了采用CAR-CD19T 细胞治疗 B 细胞介导的免疫疾病。相关专利申请 US20030448256、US20040797609 等也都是以 CD19作为 CAR-T 疗法的靶抗原而作出的。截至目前,利用CAR-CD19T 治疗 B 细胞谱系的恶性肿瘤已经取得了广泛的进展,正在进行 I/II 期临床研究的 27 个项目中,有 19 个都是以 CD19 为靶抗原,制药巨头诺华公司的明星产品CTL019、Juno Therapeutics 的 JCAR015、JCAR017 也都是以 CD19 为靶抗原的抗急/慢性淋巴细胞白血病产品,均表现了前所未有的临床疗效,其中 CTL019、JCAR015 对急性淋巴细胞白血病的治愈率均达到 85% 以上,这两个产品也都于2014年获得了美国 FDA“突破性药物”资格。可见,CD19 靶抗原的提出,对于 CAR-T 靶点开发领域具有里程碑式的意义。
此外,2011年,伊利诺伊大学基金会及宾夕法尼亚大学为主要申请人的专利申请 WO2011US64191 中提到了除CD19、CD20 之外的其他血液肿瘤相关靶抗原,如 CD22、CD33 等,不过最终只有涉及血液肿瘤的 CD19 抗原的技术方案获得了授权。Juno Therapeutics 的 CD22 CAR 治疗B 细胞癌症项目已进入 I/II 期临床研究阶段。
1.3.2 针对实体瘤的 CAR-T 靶点 在血液肿瘤方面取得突破进展的同时,研究者们也从未停止过将 CAR-T 技术应用于实体瘤的努力。与血液肿瘤相比,实体瘤在其漫长的发生发展过程中,在肿瘤细胞周围进化出了一个免疫抑制的微环境,在这个微环境中,存在许多具有抑制功能的 Treg 细胞、肿瘤相关巨噬细胞、髓源性抑制细胞、肿瘤本身异常高表达的一些抑制分子(如 PD-L1)以及分泌的抑制性细胞因子等(如 TGF-β 和 IL-10),在这种情况下,CAR-T 细胞归巢到肿瘤组织部位的能力就被大大削弱。在实体瘤CAR-T 靶点开发方面,在结肠癌抗原癌胚抗原(CEA)、结直肠癌抗原 A33、前列腺特异性膜抗原 PSMA 相关专利申请之后,Eshhar 研究组又于 1999年在专利申请WO1999IL00622 中报道了针对黑色素瘤相关肿瘤蛋白MAGE-1 的嵌合 T 细胞受体,MAGE-1 在除睾丸外的其他正常组织中均无表达,而是仅在一些组织类型的肿瘤中表达;美国卫生和人力服务部的专利申请 US20010803578中也对针对黑色素瘤抗原的 CAR 进行了保护,此外还有卵巢癌抗原;美国希望之城癌症研究医院的专利申请US20020120198 及系列申请报道了采用针对 CE7+ 的CAR-T 治疗儿童神经母细胞瘤。但这些专利申请中涉及的靶点技术均未进入临床试验阶段。
直到 2007年,the General Hospital Corporation 和Children's Medical Center Corporation 为主要申请人的专利申请 WO2007US21575 报道了针对表皮生长因子受体EGFRvIII 抗原的 CAR-T 可有效抑制小鼠颅内肿瘤,并提出可采用表皮生长因子受体 EGFRvIII 抗原的 CAR-T 治疗神经胶质瘤、乳腺癌、肺癌及卵巢癌。由此衍生的专利申请 WO2012US29861、US201414184924 等也都锁定了EGFRvIII 抗原为CAR-T 的治疗靶点。诺华公司利用CAR-EGFRvIIIT 治疗胶质瘤的项目已进入了临床前试验阶段,并于 2015年初设计出了临床 I 期研究方案。
2009年,美国希望之城癌症研究医院的专利申请WO2009US55029 报道了针对实体瘤抗原 Her2neu 的CAR-T。在 2015年4月的 ASCO 快报上报道了CAR-Her2neuT 治疗实体瘤的临床结果,该临床试验由贝勒医学院主导,共招募了 17 位复发的 Her-2 阳性肉瘤患者,在所检测的 9 位患者中有 7 位患者血液中检测到 CAR-T细胞存活超过 6 周的证据,这些患者在接受 CAR-T 疗法时均未接受其他疗法,中位总存活期为 10 个月,其中一位患者观察到肿瘤超过 90% 坏死的临床表现。
2011年,伊利诺伊大学基金会及宾夕法尼亚大学为主要申请人的专利申请 WO2011US64191 中还提到了 ROR1,mesothelin 等实体瘤抗原,为后续研究奠定了坚实的基础。Juno Therapeutics 的研究项目 ROR-1 CAR 治疗实体瘤及慢性淋巴细胞白血病目前处于临床前试验阶段。诺华公司的CART-Meso 治疗胰腺间皮瘤项目已于 2015年4月发布了 I 期临床数据,在 5 名患者身上测试了 CART-Meso 疗法,其中 2 人患有卵巢癌、2 人患有上皮间质瘤(一种肺癌)、另有 1 人患有胰腺癌,这 5 名患者在此前接受过多种疗法均告无效,该临床 I 期研究中 5 位受试患者在接受治疗时出现了败血症、气短及白细胞水平升高等副作用,但无重大副作用,患者接受 T 细胞回输后的第 28 天仍可检测到 CAR-T 细胞的存在,同时有迹象显示出这些 T 细胞向肿瘤部位富集,影像学手段显示其中 1 名患者体内的实体瘤体积出现萎缩迹象,另 1 名肺癌患者肺部的恶性细胞出现减少的迹象。虽然还未达到在白血病等非实体瘤方面的治疗效果,但 CAR-T 疗法已在实体瘤治疗方面崭露头角,前景广阔。
此后,研究者们又陆续提出了在血液肿瘤、实体瘤和脑瘤均有表达 CD70 抗原[6]、卵巢癌抗原叶酸受体 α(FRα)[7]、肝细胞癌抗原 GPC-3[8]、B7-H4[9]、多发性骨髓瘤抗原BCMA[10]、成纤维细胞活化蛋白(FAP)[11]、肿瘤内皮标记TEM1(CD248)或 TEM8[12]、叶酸受体 β(FRβ)[13]等 CAR-T新靶点,相信不久的将来都会进入临床试验阶段,届时也会充实 CAR-T 在实体瘤领域的疗效数据。
1.3.3 国内申请人相关专利申请现状 中国申请人的相关专利申请均是基于已开发的靶点作出的抗体优化等,制备了应用于 CAR 的血管内皮生长因子受体、内皮生长因子受体、GPC-3 等的抗体,针对 CD20 靶点制备了优化的 CAR结构。前文所述的中国人民解放军总医院的已发布 I 期临床数据的抗 CD20-4-1BB-CD3zeta 项目便是基于专利申请201410062069.7 而作出的,显示了卓越的疗效。但目前中国还没有关于 CAR-T 领域肿瘤新靶点的专利申请问世。
1.4 小结
从 1997年利妥昔单抗被 FDA 成功获批开始,依赖于抗体的 CAR-T 靶向治疗技术重新进入了人们的视野,随之对于 CAR-T 新靶点的探索也成为了热点,随着 1998年第一件 CAR-T 靶点相关专利申请出现,十几年间关于新靶点的探索从未间断,专利申请如雨后春笋般涌出。在对于新靶点的探索研究中,有着雄厚资本的美国具有明显的优势,无论从申请量还是技术输出方面都遥遥领先。而在该领域中,目前公开的中国申请人的专利申请均是基于已开发的靶点而进行的研究,如抗体的优化、CAR 结构的优化,对于新靶点的开发,无论是申请量还是技术水平、技术输出都还是空白。但截至目前进入中国的相关国外申请也为数不多,仅有 4 篇涉及首次公开的新靶点,这对于中国研究者来说是个利好,仍然具有很大的研发与专利保护空间。
2 启示
据报道,我国每年新增肿瘤患者 350 万以上,入院人数超过了 600 多万,每年因癌症死亡的人数高达 250 万以上,肿瘤治疗领域潜在市场规模庞大。在 CAR-T 细胞治疗技术领域,中国研究人员面临着巨大的机遇和挑战。对CAR-T 疗法中的第一个重要环节——新靶点的开发技术发展和专利保护状况进行分析,为我国科研工作者提供一些启示。
第一,提升创新能力是根本。鉴于中国人民解放军总医院的相关专利申请涉及的方案已进入临床并取得了可喜的成效,表明我国在局部研发方面具有优势,可广泛建立合作机制,以局部带动整体,提高总体研究水平。可把主要研究目标锁定在更具潜力的实体瘤靶点研发方面,密切关注同行业国外大型制药公司的前沿技术动态、借鉴前人的研究经验,争取早日形成自己的核心技术。
第二,注重专利保护策略,提升专利保护和转化意识。不仅要提升专利申请的意识,更要提升运用专利策略的意识,在市场中实现双赢。通过密切关注主要申请人的相关专利技术,及时开展专利分析和预警工作,从而为科研方向的选择提供服务。规避现有专利技术的壁垒,寻找机会及时申请外围专利及后续衍生专利,尽快形成自己的专利布局。熟悉各国家和地区的专利审查标准,为占领国际市场做充分准备,使自身价值与利益实现最大化。此外,对于进入中国的外国申请,如果他们的核心专利在中国市场得到有效的专利保护,这无疑将给国内制药企业带来不小的压力。不过到目前为止,CAR-T 靶点领域的“进口”到我国的专利还处于未审或在审尚未结案的状态,因此,国内相关领域研究人员应当密切关注法律状态和审批过程,及时跟进,对于后续有可能授权的专利,必要时可采取无效诉讼等措施,延缓或阻碍其在中国取得专利权,以保护国内企业的利益。在转化方面,充分利用政府及各级机构的大力支持,积极建立合作机制,致力于将专利成果推向市场,实现产业转化。
[1] Ramos CA, Dotti G. Chimeric antigen receptor (CAR)-engineered lymphocytes for cancer therapy. Expert Opin Biol Ther, 2011, 11(7):855-873.
[2] Alvarez-vallina LUIS, Russell SJ, Hawkins R, et al. Improvements in or relating to regulation of T cell activation: Europe, EP1009442. 2003-04-16.
[3] Otten GR, Greenburg GB, Casentini-borocz D, et al. Targeted cytolysis of cancer cells: World Intellectual Property Organization,WO/1998/041613. 1998-09-24.
[4] Sadelai M, Bander NH, Gong M, et al. Fusion receptors specific for prostate-specific membrane antigen and uses thereof: Europe,EP1109921. 2001-06-27.
[5] Chen MY. New! PLA General Hospital released CART therapy phase I clinical data. Biodiscover.com, 2015-05-27 [2015-05-27]. http:// www.biodiscover.com/news/politics/119184.html.
陈莫伊. 最新! 解放军总医院发布CAR-T疗法 I期临床数据. 生物探索, 2015-05-27 [2015-05-27]. http://www.biodiscover.com/news/ politics/119184.html.
[6] Gottschalk SMG, Shaffer DR, Spencer DM. Chimeric CD27 receptors for redirecting T cells to CD70-positive malignancies: United States,WO2011US58135. 2013-05-12.
[7] Powell DJ, Coukos G. Compositions and methods for treating cancer:United States, WO2012US21738. 2014-02-20.
[8] Kaplan D. Glypican-3-specific antibody and uses thereof: United States, WO2012US62765. 2014-10-30.
[9] Scholler N, Dangaj D, Zhao A, et al. Isolated B7-H4 specific compositions and methods of use thereof: Europe, EP2773651. 2014-09-10.
[10] Kochenderfer JN. Chimeric antigen receptors targeting B-cell maturation antigen: Europe, EP2836239. 2015-02-18.
[11] June CH, Pure E, Wang LC, et al. Compositions and methods for targeting stromal cells for the treatment of cancer: United States,US201314042306. 2014-04-10.
[12] Gottschalk SMG, Williams LC, Byrd TT, et al. Vascular-targeted T-cell therapy: World Intellectual Property Organization, WO/2014/164544. 2014-10-09.
[13] Powell Jr, Daniel J. Chimeric antigen receptor specific for folate receptor beta: United States, US201414211784. 2014-09-25.
10.3969/j.issn.1673-713X.2015.06.019
100190 北京,国家知识产权局专利局专利审查协作北京中心
郭婷婷,Email:guotingting@sipo.gov.cn
2015-07-13
*同为第一作者

