基于山梨醇多次同步化处理的恶性疟原虫体外培养同步化方法
姚 瑶 张连惠 席珏敏 郭 莉 李 月 王 恒
(中国医学科学院基础医学研究所病原生物学系,北京 100005)
疟疾是由疟原虫引起的危害最严重的寄生虫病,据据2014年WHO 疟疾报告报道,全世界仍有99个国家和地区,约33亿人受到感染疟疾的威胁。2013年全球有1亿9千万疟疾报告病例,58.4万人死亡(Chan, 2014)。能引起人类患病的疟原虫种包括恶性疟原虫Plasmodiumfalciparum、间日疟原虫P.vivax、三日疟原虫P.malariae、卵形疟原虫P.ovale、诺氏原虫P.knowlesi五种( Cox-Singhetal., 2008; Barberetal., 2011; Kanteleetal., 2011)。其中恶性疟原虫的毒力最强,致死率也最高(Lutyetal., 2000),因此针对恶性疟原虫致病机制的研究具有重要的意义。
恶性疟原虫红内期是从疟原虫裂殖子在肝细胞破裂释放入外周血循环后侵入红细胞开始的,由于红内期是导致患者出现临床症状以致威胁生命的阶段,因此受到广泛的重视和研究(Maieretal., 2013)。恶性疟原虫在红内期发育和增殖的一个周期大约为48 h,包括裂殖子期(Merozoite)、环状体期(Ring Stage)、早期和晚期滋养体期(Trophozoite Stage)以及成熟裂殖体期(Schizont Stage)(Cox, 2010)。在这些发育过程中,恶性疟原虫的生长代谢非常活跃,并且与宿主之间在不同发育阶段表现出不同的分子间相互作用(Maieretal., 2013),全面揭示这些分子机制将有助于人类更有效地预防和控制疟疾。而完成上述研究工作的前提是获得疟原在红细胞各发展阶段较为精准的虫体材料,即实现对在人红细胞内生长的疟原虫进行有效的同步化(Trageretal., 1976)。能否达到此目标,将明显影响对恶性疟原虫生长周期调节机制以及对其精细组学特点的研究质量。
目前常用的疟原虫体外培养同步化处理方法包括浓度分离法(The density method)(Jensen, 1978)、渗透压分解法(The osmotic lysis method)(Lambrosetal., 1979)、Percoll梯度法(Percoll gradient method)(Rivadeneiraetal., 1983)、温度周期法(Temperature cycling method)(Haynesetal., 2002)、Plasmion富集法(Plasmion enrichment method)(Lelievreetal., 2005)、磁性分离法(Magnetic separation method)(Ahnetal., 2008; Spadaforaetal., 2011)以及温度处理法,即将培养瓶放在4 ℃环境一段时间可以同步化虫体(Yuanetal., 2014)。这些方法均难以达到精准的同步化程度,给实验结果的分析带来很大的困扰。其中“浓度分离法”基于被恶性疟原虫感染的红细胞沉降速度受原虫不同发育阶段的影响所显示的差异,此方法可以分离出各个时期的疟原虫,但同步化程度相对较低(郝明明等, 2012)。Percoll是一种经聚乙烯吡喀烷酮(PVP)处理的硅胶颗粒,利用Percoll液经高速离心后形成一个连续密度梯度的原理,可将密度不等的细胞分离纯化。基于被恶性疟原虫感染红细胞在不同发育阶段细胞密度的差别,可将Percoll配置成不同的浓度梯度来分离各期疟原虫,该法是分离纯化各期疟原虫较好的一种方法,不足之处在于操作流程较长,步骤较多,尤其对处于滋养体晚期和成熟裂殖体期的疟原虫区分度低。“温度梯度法”通过在某个时期升高和降低培养温度,来抑制疟原虫的进一步发育,然后将培养温度恢复到37 ℃,此时疟原虫会很快发育到裂殖体,使裂殖子同时释放并侵染红细胞,但该方法的同步化程度并不尽如人意。
“磁性柱分离法”利用磁性吸附柱(Magnetic bead column)吸附疟原虫产生的代谢产物疟色素,可对疟色素含量各异的各期疟原虫进行有效的分离,由于方法需要使用特殊的仪器,加大了试验成本。其他化学方法,例如肝素,可抑制裂殖子表面与侵袭红细胞有关的重要蛋白(MSP-1)的结合(Boyleetal., 2010a),从而使大部分破裂的裂殖子无法侵袭感染新的红细胞而死亡,从而获得较少的同步化的裂殖体,但是,该方法对于疟原虫的生长发育过程中的生物代谢与调节过程可能有较大影响,不适宜进行后期的组学或者其他功能方法学研究。
本研究旨在通过改进渗透压分解技术,探索在体外培养过程中获得在生长各阶段同步化程度高的恶性疟原虫实验方法。
1 材料方法
1.1 实验材料
D-山梨醇购自上海生工,葡萄糖购自北京化工厂,庆大霉素购自天津药业焦作有限公司,L-谷氨酰胺和次黄嘌呤购自Sigma公司,RPMI 1640培养基购自Gibco公司,胎牛血清(FBS)和Albumax II购自Invitrogen公司,HEPES buffer购自Andybio公司,Giemsa′s染液购自万类生物有限公司。
1.2 恶性疟原虫体外培养
本研究用疟原虫虫株为P.falciparum3D7虫株(Gardneretal., 2002),由美国ATCC下属MR4惠赠。
采用标准的体外连续培养法培养P.falciparum3D7虫株。培养条件:红细胞容积为5%(5% CO2浓度,5% O2浓度,37 ℃)。
1.3 感染血涂片Giemsa′s染色
将感染血滴于载玻片的一端(约5 μL),推片形成厚薄适中的均匀血膜;快速吹干血膜,然后用甲醇固定。然后在载玻片上以7∶1的比例滴加PBS 溶液和Giemsa′s染液,室温静置10 ~ 15 min。用蒸馏水洗去染液,吹干,油镜观察。
1.4 体外培养恶性疟原虫同步化处理
体外培养的恶性疟原虫进行同步化处理之前,先密切观察其生长周期(48 h)。在不同时间点,采用5%山梨醇连续2~3次处理P.falciparum3D7虫株,来获得处于不同时期(环期、早期滋养体期(T1期)、晚期滋养体期(T2期)、成熟裂殖体期和裂殖子期)的同步化虫株。
第1次同步化处理 选择环状比例较高(约80%)的P.falciparum3D7虫株,收集到15 mL 无菌离心管里,1 600 r/min离心5 min,弃上清,沉淀用37 ℃ 预热5% 山梨醇溶液重悬,二者的体积比例为 1∶12,混匀后37℃放置15 min。取出后,用1 600 r/min 离心5 min 弃去上清,用10 mL 不完全培养基洗两次,加入合适体积的完全培养基37 ℃ 继续培养。
第2次同步化处理 继续培养虫株,并在44 h之后密切观察疟原虫生长发育情况,当有疟原虫进入第2个新的生长周期后,继续培养虫株数小时(4 ~ 6 h,培养时间根据想要获得的疟原虫的同步化的窗口以及虫血率不同而不同),用5%的山梨醇进行第2次同步化处理。第2次同步化处理后,可以直接收集同步化程度高的环状体期,或者继续培养12、24和36 h后收集早期滋养体、晚期滋养体和成熟裂殖体。如果生长到相应生长周期的虫株同步化程度达不到80%,可以再进行一次同步化处理。
体外培养恶性疟原虫经两次连续同步化处理后,培养至裂殖体期(40 ~ 44 h),观察到有已经成熟的裂殖子在红细胞内已经形成后,将培养皿置于室温条件下继续培养(17~ 20 ℃),每隔1 h观察裂殖体破裂情况。当有大量裂殖子游离在培养基中时(超过50%),用孔径1.2 μm的无菌滤膜过滤,收集裂殖子。
1.5 统计学方法
虫血率(%)= 感染疟原虫红细胞数/总红细胞数,红细胞计数1 000个以上。
同步化程度(%)=处于特定时期恶性疟原虫感染红细胞数/感染红细胞总数,感染红细胞计数200以上。
2 结果
2.1 恶性疟原虫体外培养形态学特征
油镜下观察,恶性疟原虫有如下特征:(1)位于红细胞内;(2)紫红色的细胞核和淡蓝色的胞浆;(3)细胞内可见棕褐色的折光颗粒(疟色素颗粒)。不同时期的恶性疟原虫见图1。
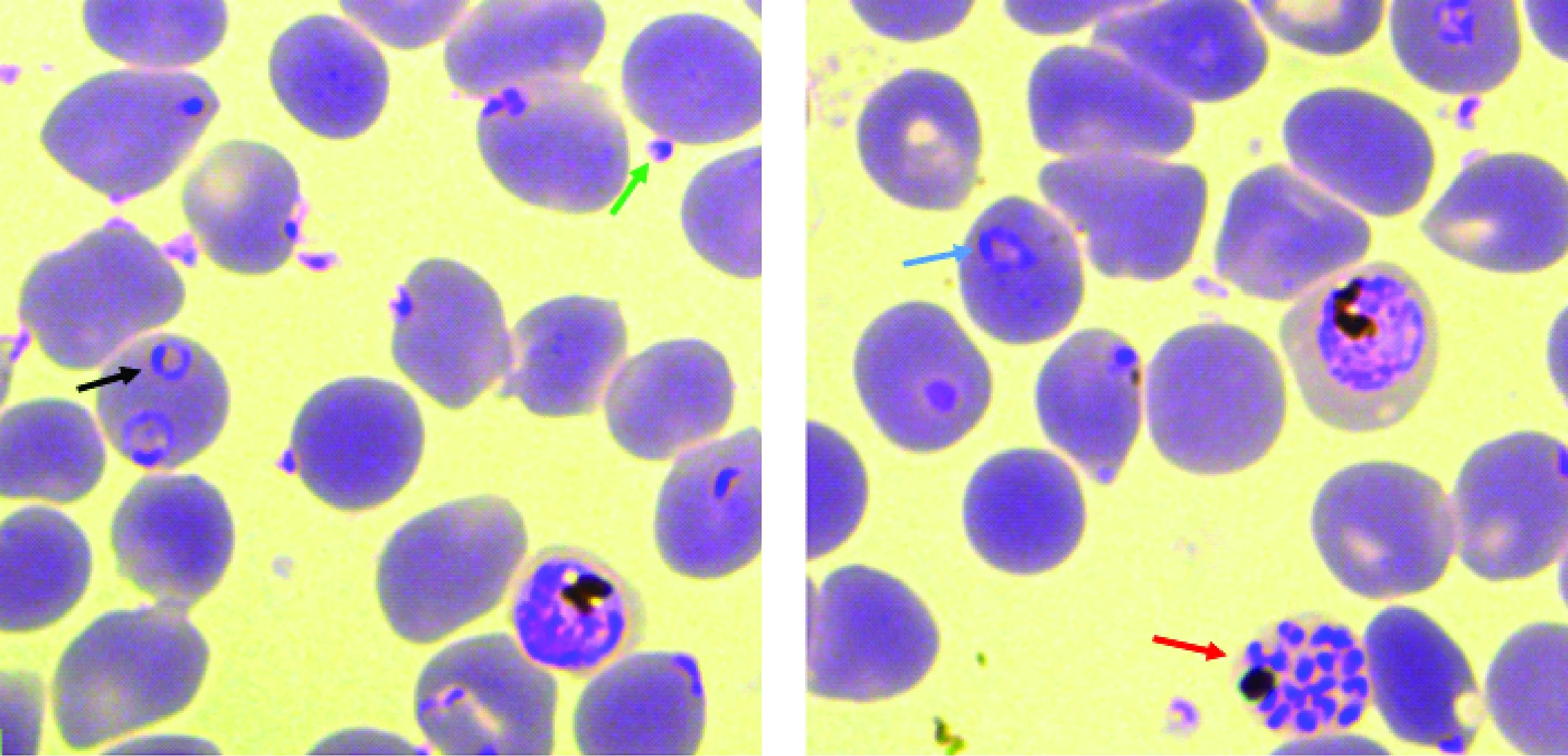
图1 体外培养恶性疟原虫未同步化虫株Fig.1 Unsynchronized P. falciparum 3D7 parasites cultured in vitro绿色、黑色、蓝色和红色分别指示裂殖子、环期、滋养体期和成熟裂殖体期。Green, black, blue and red arrows indicated merozoites, ring stage, trophozoite and mature schizont stage P. falciparum 3D7 parasites.
2.2 恶性疟原虫体外培养同步化结果
经同步化处理之后,恶性疟原虫在环期、早期滋养体期、晚期滋养体期和成熟裂殖体期的同步化程度分别在90%、85%、85%和80%以上。环状体期窗口为4~8 h,早期滋养体期窗口为16~20 h,晚期滋养体期窗口为24~28 h,成熟裂殖体期窗口为40 ~44 h;各期恶性疟原虫同步化后的虫血率可达10%~20%。图2A-D为同步化后处于不同时期的恶性疟原虫的示意图。
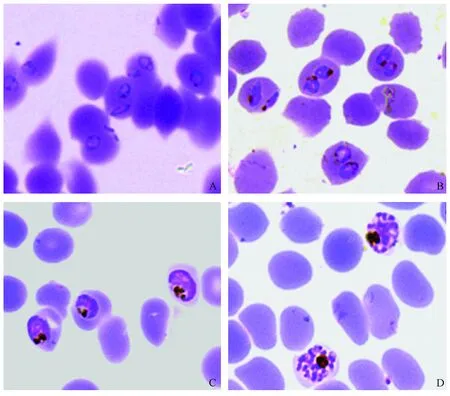
图2 体外培养恶性疟原虫同步化Fig.2 Synchronized P. falciparum 3D7 parasites cultured in vitroA~D分别表示处于环期、早期滋养体期、晚期滋养体期和成熟裂殖体期的恶性疟原虫同步化示意图。A-D represented synchronized P. falciparum 3D7 parasites in ring stage, early and late trophozoite, as well as mature schizont stage, respectively.
经同步化处理,同样能收集同步化程度较高的裂殖子。图3-A和B分别为用孔径1.2 μm的无菌滤膜过滤收集前、后的裂殖子示意图。
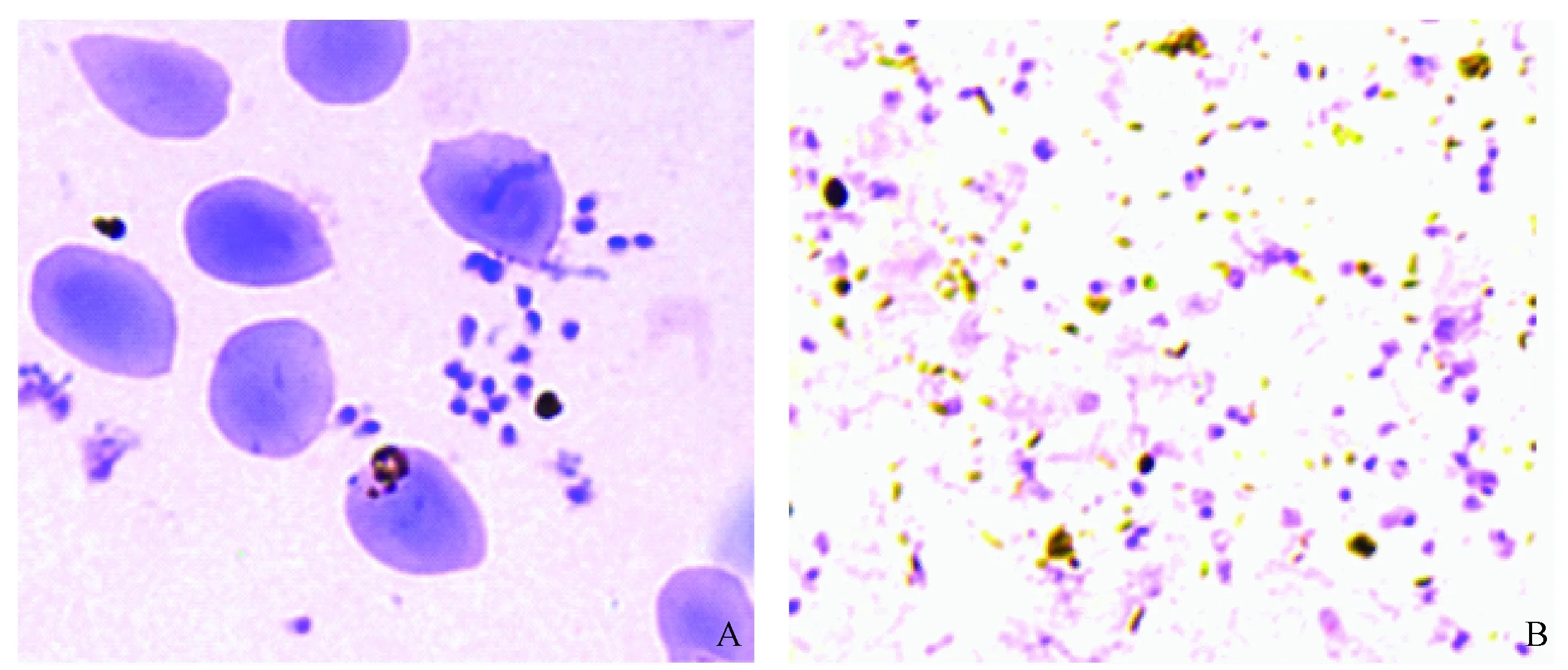
图3 过滤收集前(A)、后(B)裂殖子Fig.3 Merozoites harvested before(A) and after(B) filtration
3 讨论
在本研究中,通过多次使用山梨醇对红内期的疟原虫进行同步化处理,证实获得在各个时期的同步化率达到80%以上的恶性疟原虫,并能获得较高的虫血率。山梨醇方法是目前实验室使用的最为经典的同步化方法,其作用原理为山梨醇溶液对较成熟的疟原虫的红细胞有选择性的溶解作用,因此通过山梨醇处理可使体外培养的恶性疟原虫的生长维持在环状体期。本研究利用多次连续使用山梨醇同步化处理初始环状体比例较高的疟原虫,在未对疟原虫的生长发育过程产生不良影响的前提下,除可获得同步化程度较高的虫株,由于通过控制后续同步化的时间点,可缩短同步化虫株的周期窗口至4 h以内。
此外,在收集有活性的裂殖子时,目前一般采用E64蛋白酶抑制剂(N-(反式-环氧丁二酰基)-L-亮氨酸-4-胍基丁基酰胺)来抑制裂殖体的破裂(Boyleetal., 2010b),从而达到收集裂殖子的目的。但该方法试剂价格昂贵,操作较为繁琐复杂。本实验利用室温法培养晚期裂殖体,减慢裂殖子侵袭感染新鲜红细胞的速度,再利用直径小于红细胞小,大于裂殖子的滤膜来收集裂殖子,能快速便捷获得有活性的裂殖子。
在使用本文建立的方法进行操作时,仍需考虑以下影响因素:如山梨醇多次连续处理感染红细胞对细胞有的一定毒性(Songetal., 2012),因此,连续同步化的次数不要超过3次,或者在2次同步化后继续培养两个以上周期之后再进行同步化处理,对于红细胞和疟原虫的生长恢复较为有利;再者,室温法培养疟原虫是否会一定程度影响裂殖体的生长代谢过程尚不能定论。
综上所述,通过连续多次使用山梨醇对红细胞内期的疟原虫进行同步化处理,即可将各期疟原虫发育阶段的周期窗口缩小,也可获得同步化程度高达80%、虫血率在10%~20%的不同阶段疟原虫,供进一步的实验研究使用。由于本方法操作步骤简便易行,无需复杂昂贵的试剂仪器等实验条件,对恶性疟原虫红内期感染的基础性研究的实验室更为实用。

