木霉Tr-92菌株厚垣孢子发酵条件的优化
张晶晶, 黄亚丽, 马 宏, 贾振华, 史延茂, 宋水山
(1. 河北省科学院生物研究所, 河北省主要农作物病害微生物控制工程技术研究中心, 石家庄 050081;2. 河北工业大学化工学院, 天津 300130)
木霉Tr-92菌株厚垣孢子发酵条件的优化
张晶晶1,2, 黄亚丽1*, 马 宏1, 贾振华1, 史延茂1, 宋水山1*
(1. 河北省科学院生物研究所, 河北省主要农作物病害微生物控制工程技术研究中心, 石家庄 050081;2. 河北工业大学化工学院, 天津 300130)
利用单因素试验、正交试验方法对木霉Tr-92厚垣孢子发酵培养基及培养条件进行优化,筛选获得了适合此菌株厚垣孢子产生的最佳培养基组成为:草炭2.5%,玉米浆4.5%,葡萄糖2%,酵母膏0.5%;最佳培养条件为:接种量3%,装液量75 mL/250 mL,转速为180 r/min,初始pH 5.0,温度28 ℃,培养时间7 d。在此培养条件下,木霉Tr-92菌株厚垣孢子产量达到3.01×108个/mL。与优化前相比,厚垣孢子产量增长130.80%。通过培养条件优化确定了适合木霉Tr-92菌株产生厚垣孢子的条件,为高效木霉厚垣孢子生防菌剂的研制奠定了基础。
木霉; 厚垣孢子; 液体发酵; 培养基; 发酵条件
木霉(Trichoderma)是一种具有重要经济价值的生防真菌,自1932年Weindling首次发现木素木霉(Trichodermalignorum)可以寄生于多种植物病原真菌后[1],经多年研究发现木霉菌对18个属的29种病原菌具有拮抗作用[2],其生防机制包括竞争作用[3]、抗生作用[4]、重寄生作用[5]和诱导抗性[6]等,成功研制出了50多种木霉制剂[7],其中以美国的Topshield(哈茨木霉T22)[8]和以色列的Trichodex(哈茨木霉T39)[9]应用最为广泛。
商品化的木霉制剂大多为分生孢子制剂或分生孢子和菌丝的混合制剂,由于分生孢子自身的特点造成木霉分生孢子制剂保质期短、田间防效稳定性差。厚垣孢子是木霉在逆境情况下产生的一种繁殖体,该类孢子在储存、萌发及在逆境情况下的存活能力均远远优于分生孢子[10],因此,为了提高木霉制剂的田间施用效果,进行木霉厚垣孢子制剂的研制非常必要。然而,与分生孢子相比,木霉厚垣孢子的培养条件较为苛刻,培养时间长且厚垣孢子产生量少,这增加了木霉厚垣孢子制剂的成本、限制了厚垣孢子制剂的开发,所以,亟须进行高产厚垣孢子的发酵条件研究。
木霉Tr-92是由本课题组自植物根际土壤中分离和鉴定的一株拮抗木霉,初步研究发现该菌对灰霉病菌、立枯丝核菌、镰刀菌等十余种病原菌均具有较强的拮抗作用[6,11],对灰霉菌生长的抑制作用达75.2%;显微镜观察拮抗平板发现,木霉Tr-92的菌丝通过缠绕、穿透、紧贴等方式寄生在病原菌的菌丝之上。研究还发现,将该菌株的分生孢子悬液施用于黄瓜根部,可以诱导黄瓜叶部对灰霉病菌的系统抗性,防病效果达到56%[6,11];这些研究表明该菌株能够通过土壤施用来防治土传和叶面病害,是一株具有良好生防潜力的菌株。本研究对木霉Tr-92液体发酵产厚垣孢子的培养条件进行筛选和优化,以期提高该菌株的厚垣孢子产量,降低成本,为厚垣孢子制剂的开发奠定基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株
木霉Tr-92菌株,为本实验室筛选、保存并鉴定。
1.1.2 培养基
(1)燕麦粉培养基:燕麦粉(30目)50 g,加水至1 L;(2)玉米粉培养基[12]:玉米粉(30目)50 g,加水至1 L;(3)草炭+玉米浆培养基:草炭5%,玉米浆3%,葡萄糖2%,酵母膏0.5%,加水至1 L;(4)玉米+大豆培养基:大豆粉(30目)20 g,玉米粉(30目)10 g,加水至1 L;(5) 大豆培养基:大豆粉(30目)20 g,加水至1 L;(6)Gorodkowa培养基[13]:氯化钠5 g,蛋白胨10 g,葡萄糖2.5 g,牛肉膏10 g,加水至1 L,pH6.0。
1.2 方法
1.2.1 木霉Tr-92的培养及分生孢子悬液的制备
将试管保存的木霉Tr-92菌种接种到PDA平板上,30 ℃恒温培养5 d,用无菌水冲洗木霉Tr-92平板得到木霉孢子液,充分混匀后用血球计数板计数,并调整其浓度为1×106cfu/mL。
1.2.2 不同培养基对厚垣孢子产量的影响
按照1.1.2中培养基配方进行6种培养基的配制,250 mL三角瓶装液量为50 mL,121 ℃灭菌20 min。按1%的接种量将木霉孢子悬液接种到相应的培养基中,28 ℃、200 r/min恒温摇床培养,每24 h用显微镜观察不同培养基中木霉的生长状况。待厚垣孢子基本脱落后,吸取1 mL孢子液稀释合适倍数后用血球计数板计数并计算各处理的厚垣孢子浓度。每个处理重复3次。以下各项试验除了已筛出的最佳条件和所测项目外,均与此相同。
1.2.3 草炭+玉米浆培养基成分的正交优化
以产厚垣孢子最好的(3)草炭+玉米浆培养基为基础培养基,通过正交试验进一步优化培养基的配方。选用3因素3水平的L9(33)正交表进行试验,正交试验因素及水平见表1,共安排9个试验组,每个试验组3个重复。
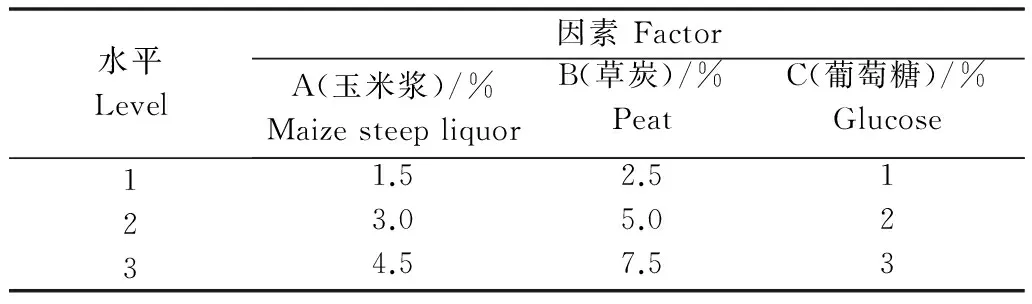
表1 正交试验因素水平表
1.2.4 木霉Tr-92产厚垣孢子培养条件的优化
(1)初始pH对木霉厚垣孢子产生的影响:以优化培养基为基础培养基,用HCl和NaOH溶液调节培养基的初始pH分别为2、3、4、5、6、7、8、9、10进行木霉培养,测定不同处理中厚垣孢子的数量,每处理3次重复。
(2)温度对木霉厚垣孢子产生的影响:以优化培养基为基础培养基,分别在20、24、28、32 ℃和36 ℃等温度下进行振荡培养,测定不同温度处理下厚垣孢子的数量,每处理3次重复。
(3)接种量对木霉厚垣孢子产生的影响:用250 mL三角瓶,每瓶装50 mL优化培养基,分别按1%、3%、5%、7%、9%的接种量进行振荡培养8 d,测定不同接种量处理中厚垣孢子的数量,每处理3次重复。
(4)装液量对木霉厚垣孢子产生的影响:用250 mL三角瓶,按装液量25、50、75、100、125 mL装入优化培养基,恒温摇床振荡培养8 d,测定不同装液量处理中厚垣孢子的数量,每处理3次重复。
(5)培养时间对木霉厚垣孢子产生的影响:用250 mL三角瓶,按最优发酵条件进行恒温摇床振荡培养,每天用显微镜观察厚垣孢子的分化情况,测定不同培养时间处理中厚垣孢子的数量,每处理3次重复。
2 结果与分析
2.1 木霉Tr-92在不同培养基中产生厚垣孢子的情况
试验结果(图1)表明,供试的6种培养基,除Gorodkowa培养基外,其他5种培养基培养Tr-92均能产生厚垣孢子,其中以草炭+玉米浆培养基中厚垣孢子产量最多,且基本上不产生分生孢子,在玉米培养基和燕麦培养基中则同时产生大量厚垣孢子和分生孢子,玉米+大豆粉培养基和大豆粉培养基产生的厚垣孢子相对较少。因此,初步确定草炭+玉米浆培养基为适合木霉Tr-92产厚垣孢子的基础培养基。
2.2 草炭+玉米浆培养基成分的正交优化
以Ki值最优的水平为试验的最佳条件,由表2可知,Tr-92最适发酵组合为A3(4.5%)B1(2.5%)C2(2%),即该菌的最佳培养基配方为草炭2.5%、玉米浆4.5%、葡萄糖2%。其中,以草炭的含量对厚垣孢子产生数量的影响最大,其次是葡萄糖,玉米浆的影响最小。

图1 不同培养基对木霉Tr-92产厚垣孢子的影响Fig.1 Effects of different media on production of Trichoderma Tr-92 chlamydospores

试验号No.A(玉米浆含量)/%MaizesteepliquorB(草炭含量)/%PeatC(葡萄糖含量)/%Glucose厚垣孢子数/×108个·mL-1No.ofchlamydospores1A1(1.5)B1(2.5)C1(1)0.022A1(1.5)B2(5.0)C2(2)0.233A1(1.5)B3(7.5)C3(3)0.044A2(3.0)B1(2.5)C2(2)1.245A2(3.0)B2(5.0)C3(3)0.396A2(3.0)B3(7.5)C1(1)0.017A3(4.5)B1(2.5)C3(3)1.268A3(4.5)B2(5.0)C1(1)0.119A3(4.5)B3(7.5)C2(2)0.48K10.292.520.14K21.640.731.95K31.850.531.69k10.100.840.05k20.550.240.65k30.620.180.56R1.561.991.81
2.3 木霉Tr-92厚垣孢子发酵条件的优化
2.3.1 初始pH对木霉Tr-92厚垣孢子产量的影响
培养8 d后测定木霉Tr-92菌株在不同初始pH的培养基中产生厚垣孢子的情况,结果表明(图2),初始pH为5时的厚垣孢子产量最大,达到1.89×108个/mL;初始pH为4、5、6、7时厚垣孢子产生量差异不大;而从pH 7开始,随着pH增加,Tr-92产生的厚垣孢子数量急剧下降,pH为10时厚垣孢子产量最低,仅为0.18×108个/mL,说明偏酸的环境适合木霉厚垣孢子产生。
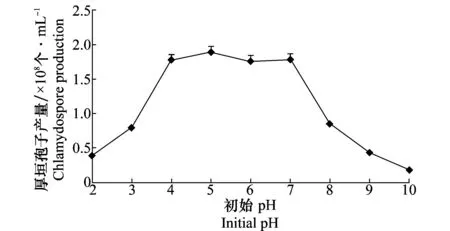
图2 不同初始pH对木霉Tr-92产厚垣孢子的影响Fig.2 Effects of initial pH on production of Trichoderma Tr-92 chlamydospores
试验过程中也检测了分生孢子的产生情况,结果显示在不同的pH下,分生孢子的产生情况也不同。在pH 3~10处理中均发现分生孢子的产生,并在pH 10时达到最大值,在pH 3~7的培养基中分生孢子量很少。因此可以通过初始pH的调控,有目的地调控厚垣孢子或分生孢子的产生。
2.3.2 培养温度对木霉Tr-92厚垣孢子产量的影响
温度也是影响木霉厚垣孢子产生的重要因素(图3),木霉Tr-92在5个试验温度下均能产生厚垣孢子,其中以28 ℃产生厚垣孢子的数量最大,为2.03×108个/mL;在高于32 ℃培养时木霉菌株生长缓慢,菌丝细弱,培养液内菌丝结团,产厚垣孢子量相对较少,36 ℃时则仅有少量厚垣孢子产生。
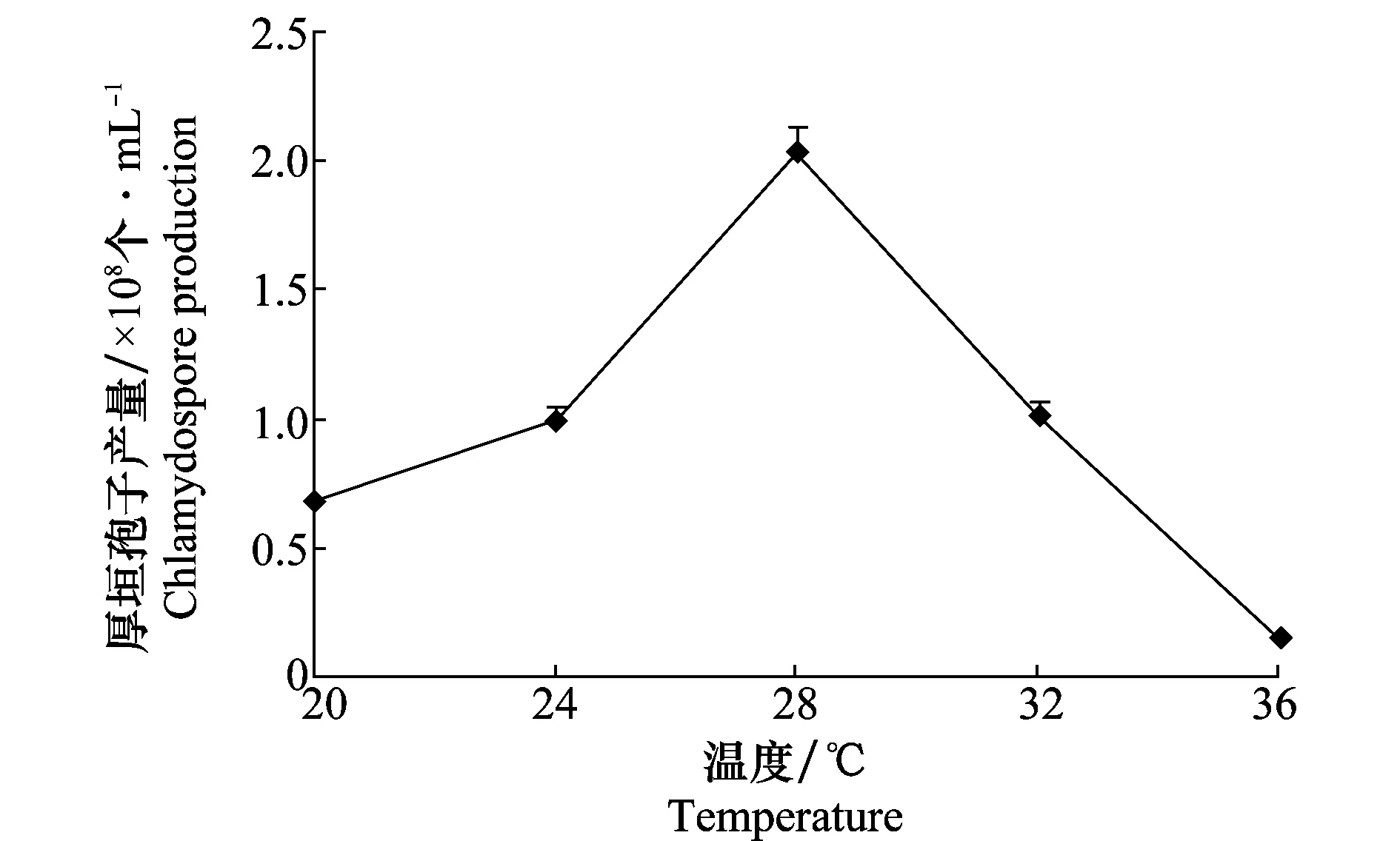
图3 不同温度对木霉Tr-92产厚垣孢子的影响Fig.3 Effects of temperature on production of Trichoderma Tr-92 chlamydospores
2.3.3 接种量对木霉Tr-92厚垣孢子产量的影响
不同接种量对木霉厚垣孢子产量的影响相对较小,在接种量为3%时厚垣孢子产量最多,接种量大于3%时各处理的厚垣孢子数量差异不大。接种量大时,厚垣孢子产量略有下降。

图4 不同接种量对木霉Tr-92产厚垣孢子的影响Fig.4 Effects of inoculum size on production of Trichoderma Tr-92 chlamydospores
2.3.4 装液量对木霉Tr-92厚垣孢子产量的影响
不同的装液量影响微生物培养过程中氧的供应量,在250 mL三角瓶中装入25、50、75、100、125 mL培养基进行摇床培养,在装液量为75 mL时厚垣孢子产量达到最大,厚垣孢子数量为2.78×108个/mL,其次是装液量为50 mL时厚垣孢子产量为2.09×108个/mL,在装液量为125 mL时,厚垣孢子产量最低仅为0.98×108个/mL。说明装液量过多时,由于溶解氧降低造成厚垣孢子产生能力的下降。

图5 不同装液量对木霉Tr-92产厚垣孢子的影响Fig.5 Effects of medium volume on production of Trichoderma Tr-92 chlamydospores
2.3.5 最适发酵条件下木霉Tr-92厚垣孢子的产生情况
选取初始pH、温度、接种量、装液量4个因素的最优值,进行木霉Tr-92的培养。镜检结果发现,培养时间在1~3 d时,木霉主要进行菌丝的生长,培养基逐渐变稠;培养时间在3~6 d时,厚垣孢子开始产生,数量缓慢增加;培养时间在6~7 d时,厚垣孢子大量形成并脱落;血球计数板计数发现,培养7 d时厚垣孢子产生数量达到最大值3.01×108个/mL。与优化前相比,厚垣孢子产量增长130.80%;7 d之后,厚垣孢子数量逐渐减少(见图6)。

图6 最优发酵条件下木霉Tr-92产厚垣孢子的情况Fig.6 The Production of Trichoderma Tr-92 chlamydospores under optimal fermentation conditions
3 讨论
随着对化学农药危害的认识,生物防治将成为控制植物病害的重要措施。木霉作为一种重要的生防真菌在农作物病害生物防治过程中起着重要的作用,但木霉分生孢子制剂在田间稳定性和保质期方面还存在着一些问题,因此亟须开发具有良好生防效果的厚垣孢子制剂,以提高木霉的生防价值。
本研究以具有良好生防效果的木霉Tr-92菌株为试验材料,进行该菌株厚垣孢子液体发酵条件的研究,发现在不同的培养基中该菌株产生厚垣孢子的能力不同,其中以在草炭+玉米浆培养基中的厚垣孢子产量最大,其次为燕麦粉培养基。邹勇[14]的研究表明,黄绿木霉T-33在燕麦培养基中也能产生大量的厚垣孢子。秦芸等[13]采用Gorodkowa培养基培养哈瑞木霉产生大量厚垣孢子,但用该培养基培养哈茨木霉Tr-92时则完全不产生厚垣孢子,说明木霉菌的种或菌株不同产厚垣孢子的最适培养基也存在差异,有必要针对不同的菌株进行厚垣孢子产孢条件的优化。
初步筛选出适宜木霉Tr-92产生厚垣孢子的培养基后,本研究采用正交试验方法对培养基组分进行了进一步优化,试验发现,培养基3个组分对厚垣孢子产生量影响大小依次为:草炭、葡萄糖和玉米浆,确定最优的发酵培养基为草炭2.5%、葡萄糖2%、玉米浆4.5%、酵母膏0.5%。
在培养条件优化过程中发现培养温度、初始pH和装液量对木霉Tr-92产厚垣孢子量的影响较大,当温度为28 ℃、初始pH为5、装液量为75 mL/250 mL时厚垣孢子产量最高;在250 mL三角瓶内,相同的接种量下,装液量过多,则养分过量、溶解氧较少,造成木霉菌丝大量产生,从而使厚垣孢子分化较慢、产量较低;装液量过少,则木霉菌丝生长不够丰富,产生厚垣孢子的时间提前,但产生量相对较少,李峰[15]的研究也取得了相似的结果。真菌喜好偏酸的生长环境,本研究发现木霉Tr-92产厚垣孢子的最适初始pH为5,其中pH 4~7之间厚垣孢子产量相差不多,说明该菌株产厚垣孢子的最适条件也为中性偏酸的环境,与庄敬华[16],顾金刚[17]等的研究结果相似,而武为平等[18]的研究表明,棘孢木霉的最适产厚垣孢子的pH仅为3,表明不同菌株的最适产孢条件存在差异。微生物的生长繁殖对温度有着严格的要求,本试验结果显示,木霉Tr-92产生厚垣孢子的温度范围在24~32 ℃,培养温度过低或过高都会抑制厚垣孢子的分化。通过显微镜观察发现,厚垣孢子产生量高时则分生孢子产生量较低,反之依然,这说明木霉厚垣孢子和分生孢子产生有不同的调控途径。通过优化,木霉Tr-92在发酵时间为7 d时厚垣孢子产量达到3.01×108个/mL,有效地提高了木霉厚垣孢子产生效率。该研究结果为木霉厚垣孢子制剂的开发奠定了基础,对木霉制剂的进一步推广应用具有重要的意义。
[1] Weindling R.Studies on lethal principle effective in the parasitic action ofTrichodermahamatumonRhizotoniasolaniand other soil fungi [J].Phytopathology,1932,22:837-845.
[2] 徐同, 钟静萍, 李德葆. 木霉对土传病原真菌的拮抗作用[J].植物病理学报, 1993, 23(1):63-67.
[3] 薛宝娣,李娟,陈永萱.木霉菌(TR-5)对病原真菌的拮抗机制和防病效果研究[J].南京农业大学学报,1995,18(1):31-36.
[4] Analia E P, Maria V M, Cristina C, et al. Biological control ofSeptoriatriticiblotch on wheat byTrichodermaspp. under field conditions in Argentina [J].BioControl, 2009, 54(1):113-122.
[5] 田连生, 张根伟, 黄亚丽. 木霉对蔬菜立枯丝核菌病害的生防效果研究[J].河北省科学院学报,2002, 19(4):254-256.
[6] 王淑霞,张丽萍,黄亚丽,等.哈茨木霉Tr-92诱导黄瓜对灰霉病系统抗性的研究[J].中国生物防治学报,2013,29(2):242-246.
[7] 陈捷,朱洁伟,张婷,等.木霉菌生物防治作用机理与应用研究进展[J].中国生物防治,2011,27(2):145-151.
[8] Harman G E.Myths and dogmas of biocontrol changes interceptions derived from research onTrichodermaharzianumT-22 [J].Plant Disease,2000, 84(4):377-393.
[9] Zirnand G, Elad Y, Chet I.Effect ofTrichodermaharzianumonBotrytiscinereapathogenicity [J].Phytopathology,1996, 86(11):1255-1260.
[10]潘玮, 穆常青, 蒋细良, 等. 木霉的孢子与土壤抑菌作用[J].中国生物防治, 2006, 22(2):87-91.
[11]黄亚丽, 王淑霞, 杜晓哲, 等. 一株具有诱导抗性木霉菌株的筛选及其对黄瓜灰霉病诱导抗性的初步研究[J].植物保护, 2013, 39(1):38-43.
[12]张婷. 木霉菌生物种衣剂的创制与应用[D].上海: 上海交通大学,2012.
[13]秦芸, 叶华智, 黄云. 影响木霉菌厚垣孢子产生因素初探[J].云南农业大学学报,2002, 17(4):416-417.
[14]邹勇. 木霉厚垣孢子的产生、萌发和保存条件的研究[D].雅安: 四川农业大学,2006.
[15]李锋. 木霉厚垣孢子的液体发酵及可湿性粉剂研制[D].雅安: 四川农业大学,2010.
[16]庄敬华, 高增贵, 刘限, 等. 不同发酵条件对木霉产孢类型的影响[J].中国生物防治, 2005, 21(1):37-40.
[17]顾金刚, 律雪燕, 胡丹丹, 等. 长柄木霉ACCC30150与哈茨木霉ACCC30371产厚垣孢子的液体培养条件[J].中国生物防治, 2008, 24(3):253-256.
[18]武为平, 陈捷, 李雅乾, 等. 棘孢木霉产厚垣孢子的液体发酵条件研究[J].上海交通大学学报,2013, 31(6):19-23.
(责任编辑:田 喆)
Optimization of liquid fermentation conditions for production ofTrichodermaTr-92 chlamydospores
Zhang Jingjing1,2, Huang Yali1, Ma Hong1, Jia Zhenhua1, Shi Yanmao1, Song Shuishan1
(1.Institute of Biology, Hebei Academy of Sciences, Hebei Engineering and Technology Center of Microbiological Control on Main Crop Diseases, Shijiazhuang 050081, China; 2. School of Chemical Engineering and Technology, Hebei University of Technology, Tianjin 300130, China)
The optimal liquid fermentation conditions for production ofTrichodermaTr-92 chlamydospores were investigated by single factor test and orthogonal test. The results indicated that the optimal conditions for production ofTrichodermaTr-92 chlamydospores were as followed: 2.5% peat, 4.5% maize steep liquor, 2% glucose, 0.5% yeast extract, 3% inoculum, 180 r/min, 28 ℃, initial pH 5.0, and 75 mL liquid medium per 250 mL flask. The actual yield of chlamydospores was 3.01×108spores/mL after 7 days. The chlamydospore production increased by 130.80% compared with the control.
Trichoderma; chlamydospores; fermentation in liquid; culture medium; fermentation condition
2014-04-18
2014-08-14
河北省自然科学基金(C2010001565);河北省省级科技计划专项工作类项目(13256504D)
Q 949.2, S 476
A
10.3969/j.issn.0529-1542.2015.03.005
* 通信作者 E-mail:huangyali2291@163.com;shuishans@hotmail.com

