长链非编码RNA MALAT1影响口腔鳞状细胞癌侵袭的实验研究*
刘速周旋王晓非岳恺段远胜何清华王佳鑫司海山王旭东
·基础研究·
长链非编码RNA MALAT1影响口腔鳞状细胞癌侵袭的实验研究*
刘速①周旋①王晓非②岳恺①段远胜①何清华①王佳鑫①司海山①王旭东①
目的:探讨肺腺癌转移相关转录因子1(metastasis-associated lungadenocarcinoma transcript 1,MALAT1)对口腔鳞状细胞癌侵袭能力的影响。方法:应用RT-PCR方法检测MALAT1在口腔鳞状细胞癌组织标本、正常口腔黏膜组织标本以及口腔鳞癌细胞系中的表达;利用小干扰RNA(siRNA)敲低MALAT1在人舌鳞状细胞癌细胞Tscca中的表达;MTT法检测细胞的增殖能力变化;划痕实验、Transwell实验检测肿瘤细胞迁移、侵袭能力的变化;蛋白质印迹法检测肿瘤细胞迁移、侵袭及上皮间质转化(epithelial-mesenchymal transition,EMT)等相关蛋白的表达变化;免疫荧光法检测细胞EMT相关蛋白表达变化;建立Tscca裸鼠皮下荷瘤模型,免疫组织化学染色法检测细胞增殖、侵袭相关蛋白表达。结果:MALAT1在口腔鳞癌组织中的表达明显高于正常组织。抑制MALAT1表达后细胞增殖率下降,细胞系划痕闭合减慢,通过Transwell小室聚碳酸酯膜的细胞数减少,与对照组比较,差异有统计学意义(P<0.05);基质金属蛋白酶-2、-9(MMP-2、MMP-9)、神经钙黏素(N-cadherin)蛋白表达水平明显下调,钙黏着蛋白(E-cadherin)表达水平上调。免疫荧光显示,细胞神经钙黏素荧光强度明显减弱,钙黏着蛋白荧光强度显著增强。体内实验结果显示,MALAT1 siRNA治疗组裸鼠皮下荷瘤体积小于空白对照组及无义序列组(F=18.664,P<0.001);免疫组织化学染色结果示,MALAT1 siRNA治疗组中增殖核抗原(PCNA)、MMP-2、MMP-9表达减少。结论:MALAT1在口腔鳞癌组织中过表达,敲低人舌鳞癌细胞中MALAT1的表达可抑制舌鳞癌细胞的迁移、侵袭能力,MALAT1可能通过调控EMT促进口腔鳞癌的增殖和侵袭过程。
肺腺癌转移相关转录因子1 口腔鳞状细胞癌 肿瘤侵袭 EMT
头颈部鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)是最常见的恶性肿瘤之一,每年有逾50万例新发病例。口腔鳞癌(oral squamous cell carcinoma,OSCC)是头颈鳞癌最常见的类型,恶性程度高、易发生局部侵袭及颈部淋巴结转移,且严重影响患者预后[1-2]。尽管近年来采用根治性手术联合放疗、新辅助化疗以及靶向治疗的综合治疗方式,但口腔鳞癌的5年生存率仍低于50%[3]。上皮间质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞获得侵袭转移能力的有效方式之一,包括口腔鳞癌在内的上皮来源的恶性肿瘤浸润及转移过程中重要的生物学过程[4]。肺腺癌转移相关转录因子1(metastasisassociatedlungadenocarcinomatranscript1,MALAT1)为最早发现的长链非编码RNA之一。研究表明
MALAT1在结肠癌、非小细胞肺癌、胶质瘤、骨髓瘤等多种恶性肿瘤细胞的增殖、侵袭和迁移中发挥重要作用[5-6],但MALAT1在调控口腔鳞癌侵袭转移过程中的作用尚不明确。本研究通过抑制MALAT1在口腔鳞癌细胞系中的表达,探讨MALAT1影响人舌鳞状细胞癌侵袭能力的作用效果。
1 材料与方法
1.1材料
1.1.1组织标本收集天津医科大学肿瘤医院自2012年4月至2013年10月间外科手术切除的口腔鳞癌标本48例。其中男性34例,女性14例;年龄34~79岁,中位年龄55岁。病例包括舌癌15例,牙龈癌14例,口底癌11例,颊癌8例。收集天津医科大学口腔医院正常口腔黏膜组织标本9例作为对照。所有组织标本去除出血、坏死及电灼组织,用生理盐水洗去血污,置于冻存管于-80℃条件下保存。所有程序均由天津医科大学医学伦理委员会审查批准。
1.1.2细胞培养和分组人口腔鳞状细胞癌细胞株Tscca、Hep-2(中国医学科学院基础医学研究所)培养于含10%胎牛血清(美国Hyclone公司)的MEM/ EBSS(美国Hyclone公司)完全培养基内,平衡盐溶液含2.00 mM-谷氨酰胺基本培养基。人口腔鳞状细胞癌细胞株Tca8113、Tca8113P160(中国医学科学院基础医学研究所)、Tb3.1(上海交通大学第九人民医院)培养于含10%胎牛血清的RPMI 1640(美国Hyclone公司)完全培养基内,细胞均置于37℃、5%CO2细胞培养箱内培养,0.25%胰酶-EDTA消化传代。
1.2方法
1.2.1反转录RT-PCR方法检测MALAT1在组织及细胞中的表达用Trizol(美国Invitrogen公司)提取总RNA;用M-MLT反转录酶反转录,反应体系为20 μL,参照反转录试剂盒说明书加样并进行反应,产物cDNA置于-20℃保存。引物序列(美国Invitrogen公司):内参照GAPDH上游:5'-GGTGAAGGTCGGA GTCAACGG-3';GAPDH下游:5'-GAGGTCAATGAAG GGGTCATTG-3'。MALAT1上游:5'-GACGGAGGTTG AGATGAAGC-3';下游:5'-ATTCGGGGCTCTGTAGT CCT-3'。PCR条件:MALAT1:95℃5 min,95℃10 s,60℃45 s,共进行40个循环,Opticon 3软件计算ΔC(t)值(2-ΔΔCT表示目的基因表达)。
1.2.2MALAT1 siRNA转染将处于对数生长期的Tscca细胞常规消化后接种于6孔细胞培养板中,12~24 h后(融合度60%~80%),弃完全培养基,无血清MEM清洗2次,放培养箱中饥饿培养。用无RNase去离子水溶解MALAT1 siRNA(上海吉玛公司)至最终浓度20 μmol/L。实验共分为3组:1)空白对照组;2)无义序列组:7.5 μL脂质体+7.5 μL无意义对照序列RNA(正义序列:5'-UUCUUCGAACGUG UCACGUTT-3';反义序列:5'-ACGUGACACGUUCGG AGAATT-3')+250 μL无血清MEM;3)MALAT1 siRNA组:7.5 μL脂质体+7.5 μL MALAT1-siRNA(正义序列:5'-GAGGUGUAAAGGGAUUUAUTT-3';反义序列:5'-AUAAAUCCCUUUACACCUCTTT-3')+250 μL无血清MEM。将转染液加入上述6孔板中,混匀,继续培养4~6 h后,更换为含10%FBS的完全培养基。
1.2.3MTT法检测细胞增殖活性取对数生长期Tscca细胞以3 000个细胞/孔接种于96孔板,待细胞贴壁后,常规转染,每组设4个复孔,分别于接种后0、1、2、3、4、5天进行MTT检测,每孔中加入浓度为5 mg/mL MTT溶液20 μL,37℃条件下培养4 h,弃上清,每孔加入200 μL二甲基亚砜(DMSO)200 μL,
振荡10 min,酶标仪检测570 nm波长测各孔吸光度值,取每组4孔的均值。按照公式计算各组细胞生存率=(处理组细胞吸光度÷空白对照组细胞吸光度)× 100%,并绘制生长曲线。
1.2.4划痕实验3组细胞接种于6孔板,常规转染MALAT1 siRNA后,用200 μL枪头在6孔板中间划一竖线,PBS洗涤细胞3次,加无血清培养基,0、48 h分别用倒置显微镜观察照相并用Image pro plus图像分析软件测量划痕相对宽度。
1.2.5Transwell实验检测细胞侵袭能力将Matrigel(美国BD公司)与MEM按1∶2稀释后,取50 μL加入Transwell上室(美国BD公司),37℃30 min使其聚合成凝胶。在下室中加入含血清培养液500 μL。待检细胞用无血清培养基200 μL制成单细胞悬液,上室中加入3×104个细胞,48 h后弃上室液体,多聚甲醛固定3 min,结晶紫染色5 min,倒置显微镜下观察。随机取3个视野,计数每个视野内的穿膜的细胞数。
1.2.6蛋白质印迹法检测相关蛋白的表达转染48 h后提取总蛋白,测定蛋白浓度,SDS-聚丙烯酰胺凝胶(SDS-PAGE)电泳,冰浴下80 V转膜60 min。37℃封闭1 h,剪膜分别加入MMP-2/9,GADPH(美国Santa Cruz公司),E-cadherin、N-cadherin(美国Abcam公司)一抗(1∶1 000)4℃孵育过夜,复温1 h,相应加入辣根酶标记山羊抗小鼠二抗或抗兔二抗(1∶1 000)室温孵育1 h。加发光液后用成像系统检测蛋白条带的表达。
1.2.7免疫荧光检测相关蛋白表达变化将无菌载玻片放入6孔板,接种细胞并常规转染,48 h后4%多聚甲醛固定,1%BSA封闭30 min,加入1∶200稀释E/N-cadherin一抗(美国Santa Cruz公司),置湿盒中4℃过夜;次日弃一抗,避光滴加1∶100稀释的FITC标记二抗(美国Santa Cruz公司),孵育30 min,DAPI染色孵育5 min,避光。抗荧光淬灭剂封片,共聚焦显微镜下观察。
1.2.8动物实验动物实验过程由中国协和医科大学血液研究所实验动物保护和管理委员会审查批准。实验所用动物为4~6周龄雌性BALB/c-nu(SPF)裸鼠,平均体质量15~18 g(购自中国医学科学院实验动物研究所)。饲养于中国协和医科大学血液学研究所实验动物中心。用1 mL无菌注射器抽取细胞浓度为5×107/mL的Tscca单细胞悬液200 μL分别接种于18只裸鼠左侧腹股沟皮下。瘤细胞接种3周后,全部裸鼠皮下成瘤,将其按照随机对照表分组,每组6只,分为3组。空白对照组:在观察期内不给与任何治疗措施;PBS组:使用微量注射器将25 μL PBS缓慢多点瘤内注射;MALAT1-siRNA组:将总量30 ng的MALAT1-siRNA用微量注射器缓慢多点瘤内注射。从第1次给予治疗措施开始,每3天进行1次治疗并用游标卡尺测量一次肿瘤的长径(a)及宽径(b),连续观察3周,绘制肿瘤生长曲线。最后一次肿瘤测量结束后,断颈处死动物,手术取出裸鼠皮下荷瘤标本,福尔马林固定,石蜡包埋,制备厚度8 μm的石蜡切片。肿瘤体积计算公式:V=(ab2)/2。
1.2.9免疫组织化学检测方法及结果判定石蜡切片常规脱蜡水化,抗原修复,3%H2O2孵育,胎牛血清封闭,分别滴加PCNA、MMP-2、MMP-9一抗(北京中杉金桥公司)(1∶100稀释)4℃孵育过夜;PBS充分洗涤,加入生物素标记的二抗(北京中杉金桥公司)(1∶100稀释)37℃孵育1 h;洗去二抗,加入辣根过氧化物酶标记的三抗(1∶100稀释)37℃孵育1 h;DAB显色,苏木素复染,梯度脱水,封片;倒置显微镜采集图像。
蛋白表达水平根据Fromowitz评级法[7]对染色水平进行分级。选择5个视野,每个视野中计数100个细胞,以5个视野的平均阳性细胞数计算阳性细胞率。0分:阳性细胞率≤5%;1分:阳性细胞率为6%~25%;2分:阳性细胞率为26%~50%;3分:阳性细胞率为51%~75%;4分:阳性细胞率为>75%;根据染色强度(阴性、浅黄色、褐色、棕褐色)分为(0、1、2、3分)。两项之和<4分为阴性至弱阳性表达,≥4分为中强阳性表达。
1.3统计学方法
所有实验数据均经SPSS 18.0统计软件分析。计量资料以x±s表示,比较采用ANOVA单因素方差分析,进一步两两比较采用LSD-t检验。所有统计结果均以双侧P<0.05为差异具有统计学意义。
2 结果
2.1RT-PCR法检测MALAT1在组织标本及口腔鳞癌细胞系中的表达
RT-PCR结果显示,MALAT1在口腔鳞癌组织中的表达9.043±0.936明显高于正常口腔黏膜组织3.432±0.747,差异有统计学意义(P=0.013 6,图1A)。Tscca、Tb3.1、Tca8113细胞系在口腔鳞癌细胞系中MALAT1的表达相对较高,在Tscca细胞中表达最高(图1B)。选取Tscca细胞系转染MALAT1 siRNA后24 h,MALAT1表达开始明显受到抑制,72 h抑制程度达到最大(图1C)。
2.2MTT法检测细胞增殖活性
Tscca细胞敲低MALAT1的表达后,细胞增殖活性明显受到抑制。转染MALAT1 siRNA 24 h后,细胞生长开始出现明显抑制,相对存活率呈逐渐下降趋势,与对照组和无义序列组比较差异有统计学意义(P<0.05,图2)。
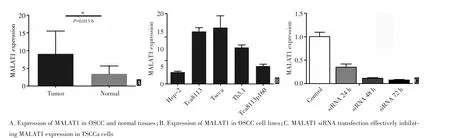
图1 RT-PCR法检测MALAT1在组织标本及口腔鳞癌细胞系中的表达Figure 1Expression of MALAT1 in sample tissues and OSCC cell lines by real-time polymerase chain reaction assay
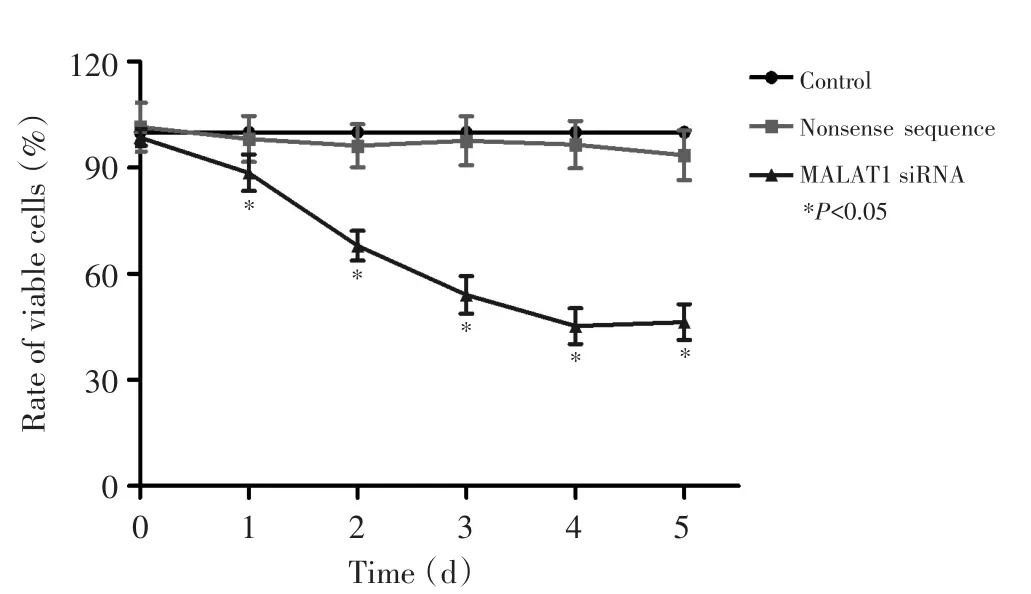
图2 MTT法检测转染MALAT1 siRNA后Tscca细胞增殖活性变化Figure 2Methyl-thiazolyl-tetrazolium reduction assay indicating that cell proliferation is inhibited after down-regulation of MALAT1 expression in TSCCa cells
2.3划痕实验检测细胞迁移能力
计算Tscca细胞系0、48 h划痕间隙融合率,间隙融合率=(0 h间隙宽度-48 h间隙宽度)/0 h间隙宽度;与空白对照组和无义序列组比较,MALAT1 siRNA组划痕间隙融合率明显降低,差异有统计学意义(P<0.05,图3,表1)。
2.4Transwell实验检测细胞侵袭能力
Transwell实验结果显示,Tscca细胞系转染MALAT1 siRNA 48 h后各随机计数3个视野,与空白对照组和无义序列组比较,MALAT1 siRNA组穿膜细胞数均明显减少,差异均有统计学意义(P<0.05,图4,表2)。
2.5蛋白质印迹法检测细胞侵袭及EMT相关蛋白表达
细胞转染MALAT1 siRNA后,总蛋白中MMP-2、MMP-9、N-cadherin蛋白表达水平均明显受到抑制;E-cadherin蛋白表达水平明显上调,与空白对照组及无义序列组比较,差异有统计学意义(P<0.05,图5)。
2.6免疫荧光法检测细胞相关蛋白水平变化
E-cadherin荧光信号表达于细胞膜上,N-cadherin荧光信号在细胞膜和细胞质中均有表达,Tscca细胞转染MALAT1 siRNA后,细胞膜上的E-cadherin荧光强度明显增加,高于空白对照组和无义序列组;而细胞膜和细胞质上N-cadherin和荧光强度与对照组相比明显减弱(图6)。
2.7裸鼠皮下荷瘤模型生长抑制曲线
截止观察期结束,MALAT1 siRNA治疗组裸鼠皮下荷瘤体积(833.08±374.54)mm3小于空白对照组(1 855.53±277.98)mm3及无义序列组(1 738.42± 290.53)mm3(F=18.664,P<0.001,图7)。
2.8免疫组织化学染色检测治疗后肿瘤相关蛋白的变化
PCNA阳性信号定位于细胞核,MMP-2、MMP-9阳性信号定位于细胞质,转染MALAT1 siRNA后,细胞中PCNA、MMP-2、MMP-9蛋白均呈中弱阳性表达,较空白对照组和PBS组表达明显减弱(图8)。

图3 划痕实验检测转染MALAT1 siRNA后Tscca细胞迁移能力(×100)Figure 3Scratch test showing that MALAT1 siRNA significantly inhibited TSCCa cell migration(×100)
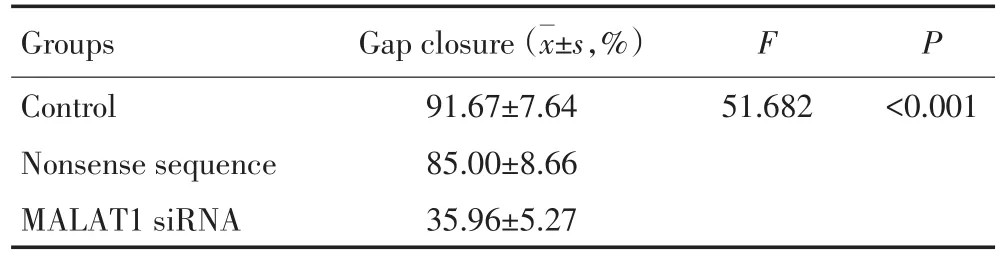
表1 Tscca细胞转染MALAT1 siRNA后细胞迁移能力的变化Table 1MALAT1 siRNA significantly inhibiting Tscca cell migration
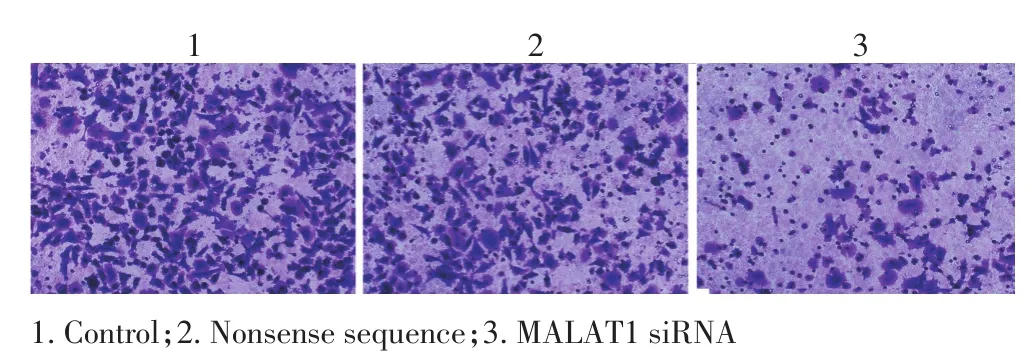
图4 Transwell实验检测不同处理组Tscca细胞侵袭能力(×100)Figure 4A and B.Transwell assay with matrigel indicating that MALAT1 siRNAsignificantlyinhibitedTSCCacellinvasionability(×100)

表2 Tscca细胞转染MALAT1 siRNA后细胞侵袭能力的变化Table 2MALAT1 siRNA significantly inhibiting Tscca cell invasion

图5 MALAT1 siRNA处理后Tscca细胞相关蛋白表达变化Figure 5Western blot analyses showing that MALAT1 siRNA could significantly inhibit N-cadherin and MMP2/9 expression and increase E-cadherin expression in TSCCa cells
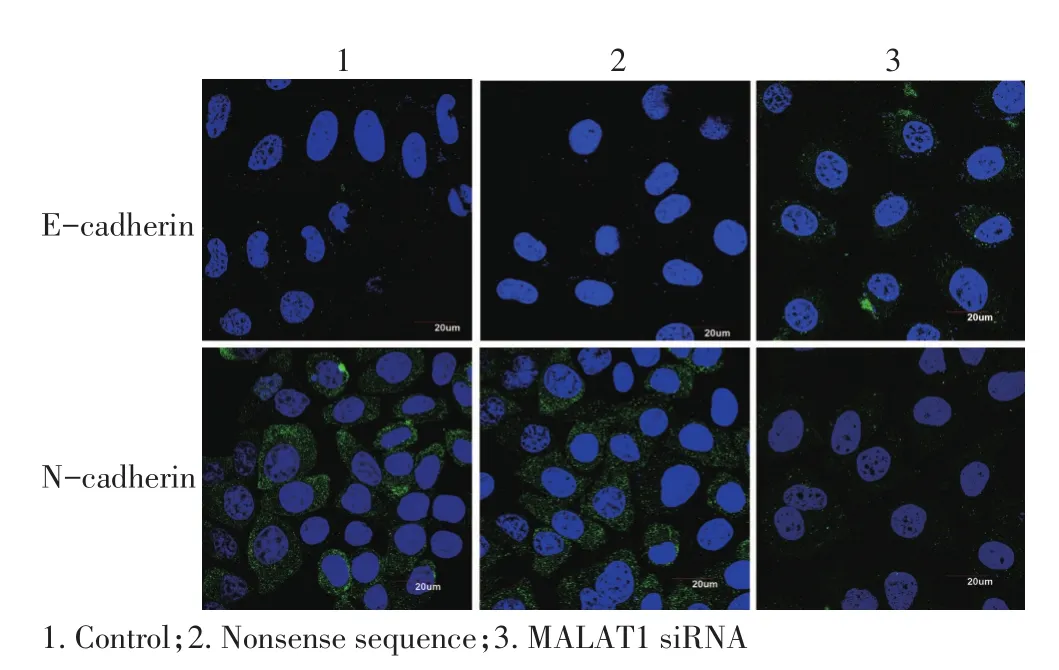
图6 免疫荧光检测不同处理组Tscca细胞相关指标表达强度变化(×1 000)Figure 6Immunofluorescence staining indicating that MALAT1 siRNA significantly increased E-cadherin expression and inhibited N-cadherin expression in TSCCa cells(×1 000)
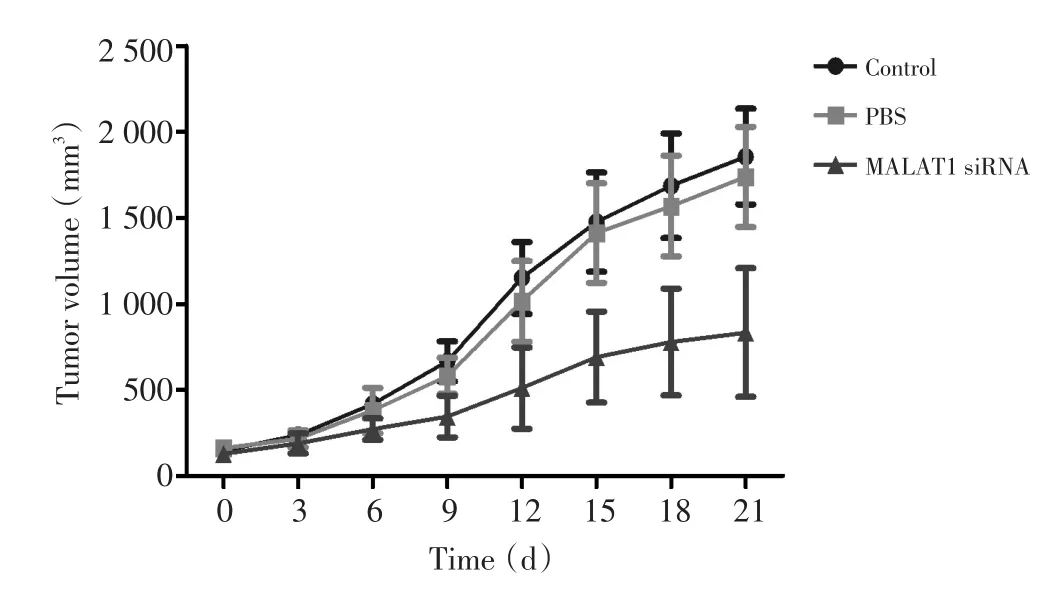
图7 不同处理组裸鼠皮下荷瘤的生长抑制曲线Figure 7Tumor volume curves indicating that MALAT1 siRNA injection treatment could significantly inhibit TSCCa-xenograft tumor growth
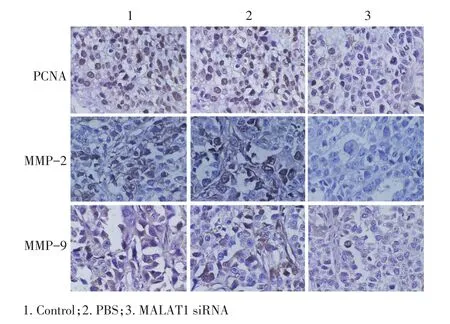
图8 不同处理组裸鼠皮下荷瘤生长相关蛋白的表达(SP法×200)Figure 8IHC staining showing that PCNA,MMP-2,and MMP-9 expression was inhibited in the MALAT1 siRNA-treated TSCCa-xenograft tumors(SP×200)
3 讨论
口腔鳞癌是头颈鳞癌中最常见的类型,全世界每年有约300 000例新发病例,且发病率逐年上升。口腔鳞癌常呈浸润性生长,局部侵袭能力强,易发生颈部淋巴结转移,预后较差[3]。
长链非编码RNA因其近年来越来越多的被发现在肿瘤形成、侵袭和转移过程中发挥重要作用而备受关注[8]。MALAT1是最早发现的长链非编码RNA之一,由最初发现于人类非小细胞肺癌而得名[9]。研究发现,在很多人类恶性肿瘤中均可发现MALAT1过表达,如食管癌、胶质瘤、乳腺癌、前列腺癌等,且MALAT1通过影响基因的表达在恶性肿瘤的侵袭和转移过程中发挥重要作用[10-12]。本研究通过对口腔鳞癌及正常口腔黏膜组织进行RT-PCR检测发现,MALAT1在口腔鳞癌组织中的表达明显高于正常组织。
EMT是指细胞上皮表型在特定的生理及病理情况下向间质转化的现象,大量研究表明,EMT在促进
肿瘤的侵袭、浸润和转移过程中起到重要作用[13-14]。
本课题组前期研究发现,EMT参与调控口腔鳞癌原发浸润和继发转移的生理过程[15]。EMT以上皮细胞极性的丧失及间质特性的获得为重要特征,上皮细胞标志物E-cadherin的表达下调,间叶表型标记物N-cadherin的表达上调,使肿瘤细胞更加富于侵袭性[16],同时MMPs作为内源性蛋白水解酶可降解细胞外基质中的各种蛋白成分,便于细胞从原发肿瘤分离脱落发生侵袭转移[17]。PCNA是一种与细胞的增殖周期相关的多肽,是反映细胞增殖活性的一项重要的生物学指标[18]。
本研究敲低MALAT1在口腔鳞癌细胞中的表达后,细胞增殖活性受到抑制,穿过Transwell小室的细胞数明显减少,划痕愈合减慢,证明了敲低MALAT1可以抑制肿瘤细胞的增殖、迁移、侵袭能力。蛋白质印迹实验表明,随着MALAT1表达的抑制,侵袭及EMT相关蛋白E-cadherin表达上调,N-cadherin、MMP-2、MMP-9表达明显下调。免疫荧光法检测细胞中E-cadherin、N-cadherin表达强度发现,敲低MALAT1后,细胞中E-cadherin荧光强度增大,N-cadherin荧光强度明显减弱,表明MALAT1可能通过诱导EMT过程促进口腔鳞癌细胞的侵袭转移。进一步通过体内实验研究发现,抑制MALAT1的表达后,肿瘤增长速度和体积明显低于对照组,免疫组织化学结果表明,肿瘤增殖、侵袭相关指标PCNA和MMP-2、MMP-9蛋白表达显著降低,与体外实验结果一致。
综上所述,MALAT1可能通过调控EMT促进口腔鳞癌的增殖和侵袭过程,临床上可能作为一种新型肿瘤标志物并为口腔鳞癌的治疗提供新的靶点,对于其调控口腔鳞癌生物学行为的分子机制及在临床中的应用有待进一步研究和探索。
[1]Warnakulasuriya S.Global epidemiology of oral and oropharyngeal cancer[J].Oral Oncol,2009,45(4-5):309-316.
[2]Pulte D,Brenner H.Changes in survival in head and neck cancers in the late 20th and early 21st century:a period analysis[J]. Oncologist,2010,15(9):994-1001.
[3]Leemans CR,Braakhuis BJ,Brakenhoff RH.The molecular biology of head and neck cancer[J].Nat Rev Cancer,2011,11(1):9-22.
[4]Smith A,Teknos TN,Pan Q.Epithelial to mesenchymal transition in head and neck squamous cell carcinoma[J].Oral Oncol,2013,49(4):287-292.
[5]Schmidt LH,Spieker T,Koschmieder S,et al.The long noncoding MALAT-1 RNA indicates a poor prognosis in non-small cell lung cancer and induces migration and tumor growth[J].J Thorac Oncol,2011,6(12):1984-1992.
[6]Eissmann M,Gutschner T,Hammerle M,et al.Loss of the abundant nuclear non-coding RNA MALAT1 is compatible with life and development[J].RNA Biol,2012,9(8):1076-1087.
[7]Fromowitz FB,Viola MV,Chao S,et al.ras p21 expression in the progression of breast cancer[J].Hum Pathol,1987,18(12):1268-1275.
[8]Bhan A,Mandal SS.Long noncoding RNAs:emerging stars in gene regulation,epigenetics and human disease[J].Chem Med Chem,2014,9(9):1932-1956.
[9]Xu C,Yang M,Tian J,et al.MALAT-1:a long non-coding RNA and its important 3'end functional motif in colorectal cancer metastasis[J].Int J Oncol,2011,39(1):169-175.
[10]Hu L,Wu Y,Tan D,et al.Up-regulation of long noncoding RNA MALAT1 contributes to proliferation and metastasis in esophageal squamous cell carcinoma[J].J Exp Clin Cancer Res,2015,34(1):7.
[11]Park JY,Lee JE,Park JB,et al.Roles of long non-coding RNAs on tumorigenesis and glioma development[J].Brain Tumor Res Treat,2014,2(1):1-6.
[12]Zhao Z,Chen C,Liu Y,et al.17beta-Estradiol treatment inhibits breast cell proliferation,migration and invasion by decreasing MALAT-1 RNA level[J].Biochem Biophys Res Commun,2014,445(2):388-393.
[13]Zhang S,Zhou X,Wang B,et al.Loss of VHL expression contributes to epithelial-mesenchymal transition in oral squamous cell carcinoma[J].Oral Oncol,2014,50(9):809-817.
[14]Yasui K,Shimamura M,Mitsutake N,et al.SNAIL induces epithelial-to-mesenchymal transition and cancer stem cell-like properties in aldehyde dehydroghenase-negative thyroid cancer cells[J].Thyroid,2013,23(8):989-996.
[15]Wang B,Zhang CP,Zhang S,et al.Epithelial-Mesenchymal Transformation-Mediated Lymph Node Metastasis of Oral Squamous Cell Carcinoma and Its Mechanism[J].Chinese Journal of Clinical Oncology,2012,39(23):1877-1880.[王博,张传平,张舒,等.EMT介导口腔鳞癌淋巴结转移及其机制研究[J].中国肿瘤临床,2012,39(23):1877-1880.]
[16]Micalizzi DS,Farabaugh SM,Ford HL.Epithelial-mesenchymal transition in cancer:parallels between normal development and tumor progression[J].J Mammary Gland Biol Neoplasia,2010,15(2):117-134.
[17]Lee MY,Shen MR.Epithelial-mesenchymal transition in cervical carcinoma[J].Am J Transl Res,2012,4(1):1-13.
[18]Kelman Z.PCNA:structure,functions and interactions[J].Oncogene,1997,14(6):629-640.
(2015-03-18收稿)
(2015-04-03修回)
(编辑:邢颖)
Metastasis-associated lung adenocarcinoma transcript 1 modulates oral squamous cell carcinoma invasion in vitro and in vivo
SuLIU1,XuanZHOU1,XiaofeiWANG2,KaiYUE1,YuanshengDUAN1,QinghuaHE1,JiaxinWANG1,HaishanSI1,XudongWANG1
Xudong WANG;E-mail:wxd.1133@163.com
Objective:To investigate the effect of metastasis-associated lung adenocarcinoma transcript 1(MALAT1)in modulating the effects of oral squamous cell carcinoma(OSCC)invasion.Methods:Real-time polymerase chain reaction was employed to detect the expression of MALAT1 in samples of OSCC post-radical resection,normal oral mucosa samples,and oral squamous cell lines. MALAT1-siRNA was transfected into TSCCa human tongue squamous cell carcinoma cell lines.Cell proliferation was determined by methyl-thiazolyl-tetrazolium reduction assay.Cell migration and invasive ability were evaluated by scratch test and transwell assay.The expression of proteins that regulated invasion and apoptosis were examined using Western blot assay.Immunofluorescence assay was used to detect changes in epithelial-mesenchymal transition(EMT)-associated proteins in the cells.Tumor-bearing nude mouse models were established by subcutaneous implantation of TSCCa cells.Immunohistochemistry was used to detect up-regulation of proliferating cell nuclear antigen(PCNA)and matrix metalloproteinase-2/9(MMP-2/9).Results:MALAT1 expression was significantly higher in OSCC than in normal tissues(P<0.05).MALAT1 expression was inhibited by transfecting MALAT1-siRNA.After MALAT1 expres-
MALAT1,oral squamous cell carcinoma,neoplasm invasiveness,epithelial-mesenchymal transition(EMT)

10.3969/j.issn.1000-8179.20150313
①天津医科大学肿瘤医院颌面耳鼻喉科,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室(天津市300060);②天津市第一中心医院耳鼻喉科
*本文课题受国家自然科学基金(编号:81172573)和天津市应用基础与前沿技术研究计划(编号:12JCYBJC33800)资助
王旭东wxd.1133@163.com
1Department of Otorhinolaryngology and Maxillofacial Oncology,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer,Key Laboratory of Cancer Prevention and Therapy,Tianjin 300060,China;2Department of Otorhinolaryngology,Tianjin First Central Hospital,Tianjin 300060,China.
This work was supported by the National Natural Science Foundation of China(No.81172573)and the Tianjin Application Research of Basic andAdvanced Technology(No.12JCYBJC33800).
sion was down-regulated in TSCCa cells,proliferation was inhibited and invasion was attenuated,showing significant differences compared with the cells transfected with scrambled siRNA and control cells(P<0.05).Expression of N-cadherin and MMP-2/9 were downregulated in the cells after MALAT1 was knocked down.Tumor growth was significantly slower in the MALAT1-siRNA group than in the control groups.IHC indicated that PCNA and MMP-2/9 expression of tumor tissues were significantly inhibited in MALAT1-siRNA group.Conclusion:MALAT1 is over-expressed in human OSCC.MALAT1 reduction can inhibit the proliferation and invasion of OSCC cells.Furthermore,MALAT1 may promote OSCC invasion and metastasis by modulating EMT.
刘速专业方向为头颈部鳞癌外科治疗。
E-mail:suzan6689@163.com

