前列腺素E1上调血管性痴呆大鼠海马组织VEGF、BDNF的表达☆
刘博会 张素平 凌莉 熊喜峰 王慕真 何锐 邓婉青
血管性痴呆(vascular dementia,VD)是一种神经退行性疾病,现研究认为VD的发生发展与血管损伤及内皮功能异常有关,尤其是皮层及丘脑、海马的缺血性病变。神经血管营养因子如血管内皮细胞生长因子(vascular endothelial cell growth fac⁃tor,VEGF)表达量的变化直接参与认知功能的发生发展[1];而脑源性神经营养因子(brain derived growth factor,BDNF)作为重要的神经血管营养因子,在脑组织内尤其是皮质及海马区分布广泛,BDNF分泌增加可减轻海马损害[2]。近来研究发现,前列腺素 E1(prostaglandin E1,PGE1)可上调血管内皮细胞中VEGF的表达[3],并能促进脑梗死后侧脑室室管膜下区内源性神经干细胞向缺血区的增殖、迁移[4]及改善脑梗死患者的血流动力学及神经功能缺损评分[5],但PGE1对VD的作用尚不清楚。本研究观察PGE1对VD大鼠学习记忆功能及海马组织VEGF、BDNF表达的影响。
1 材料与方法
1.1 分组与造模成年雄性Sprague-Dawley(SD)大鼠48只,体重300~350 g(中山大学实验动物中心提供,合格证号:44008500002363),随机分为假手术组、溶剂对照组、PGE1治疗组、PGE1+VEGFR拮抗剂组,每组12只。溶剂对照组、PGE1治疗组、PGE1+VEGFR拮抗剂组用BCCAO法[6]制作慢性脑低灌注(chronic cerebral hypoperfusion,CHP)诱导的VD模型。假手术组只分离暴露双侧颈总动脉但不结扎。术后第15d所有大鼠被迫进行5 d的定位航行实验(水迷宫实验的一部分)进行认知功能筛选[7],筛查比率(screening ratio,SR)等于(Val⁃ue1-Value2)/value 2*100%,其中数据 1(Value 1)为术后各个大鼠的逃避潜伏期,而数据2(Value 2)为所有大鼠的平均逃避潜伏期,若SR>20%提示认知功能障碍,即建模成功。水迷宫筛选实验后大鼠放于动物中心普通环境中饲养,实验中共死亡6只,4只死于术后2 d,考虑麻醉过深及缺血应激,另两只死于水迷宫训练后,考虑肺部感染,死亡率约10%;5只造模不成功。
1.2 药物处理 造模成功大鼠于术后24 d起,PGE1治疗组经尾静脉注射前列腺素E1(北京泰德制药,10 μg·kg-1·d-1,溶于 0.5 mL 生理盐水,连续7d),PGE1+VEGFR拮抗剂组在接受等剂量等疗程前列腺素E1治疗同时予腹腔注射VEGFR2特异性拮抗剂SU5416[8](Sigma,25 mg·kg-1·d-1,连续7 d),假手术组及溶剂对照组则给以等剂量等疗程的生理盐水。
1.3 Morris水迷宫实验(Morris Water Maze,MWM)药物处理后2 d所有大鼠采用MWM实验评估其学习记忆功能的改变,按文献[7]记载分别进行5 d的定位航行实验及1 d的空间探索实验,记录定位航行实验中大鼠的平均逃避潜伏期(大鼠从放入水中到爬上平台所需时间)及游泳轨迹和空间探索中大鼠穿越原平台次数及在原平台象限停留时间百分比。定位航行实验中游泳轨迹用于评估大鼠的学习能力及思考决断策略,平均逃避潜伏期则反应了大鼠的学习功能;空间探索实验用于评估大鼠的记忆功能。
1.4 蛋白印迹 水迷宫实验结束后即术后39 d,每组取6只大鼠麻醉后断头取脑,分离出海马,经组织裂解、蛋白提取、蛋白浓度测定后,取10 μL~16 μL样品进行电泳、转膜、抗体孵育(VEGFA pAb,Bioworlde.Inc,1:500;BDNF pAb,Bioworlde.Inc,1:500;B-actin 兔单抗,Cell Signal Technology,1:1000),4℃过夜、二抗孵育、显影,用核酸/蛋白凝胶图像分析仪(Bio-RAD,美国)进行蛋白半定量分析。
1.5 统计学方法 采用SPSS 19.0进行统计分析,实验数据以()表示。定位航行实验中大鼠逃避潜伏期采用重复资料方差分析进行统计,而其余计量资料采用单因素方差分析,Levene法进行方差齐性检,SNK法用于比较多组间两两差异,方差不齐时选择Tamhane,s T2法。检验水准α=0.05。
2 结果
2.1 大鼠的学习记忆功能 定位航行实验中,训练天数(F=494.79,P<0.01)和组别(F=38.82,P<0.01)对潜伏期有显著影响,且两者之间有交互作用(F=2.869,P<0.05),说明各组大鼠逃避潜伏期随训练天数而缩短的趋势不同。与溶剂对照组及PGE1+VEGFR拮抗剂组相比,PGE1治疗组平均潜伏期明显减少(P<0.05);与假手术组比,溶剂对照组逃避潜伏期显著延长(P<0.05),说明溶剂对照组、PGE1+VEGFR拮抗剂组大鼠学习能力下降,而PGE1治疗后VD大鼠学习能力提高(见表1、图1)。大鼠定位航行游泳轨迹显示,1 d各组绕圆式沿着池边缘游泳,轨迹呈“边缘型”,随着实验进行,各组逃避潜伏期及游泳距离逐渐缩短,部分直接游向平台,说明通过学习逐渐形成平台位置的记忆,3 d PGE1治疗组、假手术组便能迅速地找到平台,5 d轨迹近似“直线型”,显示了较强的学习能力(见图2)。
空间探索中,与溶剂对照组、PGE1+VEGFR拮抗剂组比,PGE1治疗组跨越平台次数增多(P<0.01),原平台所在象限停留时间百分比增大(P<0.05);与假手术组比,溶剂对照组跨越平台次数及原平台象限停留时间百分比降低(均P<0.01),提示溶剂对照组、PGE1+VEGFR拮抗剂组存在记忆功能受损,PGE1治疗可改善VD大鼠记忆功能(见表2)。
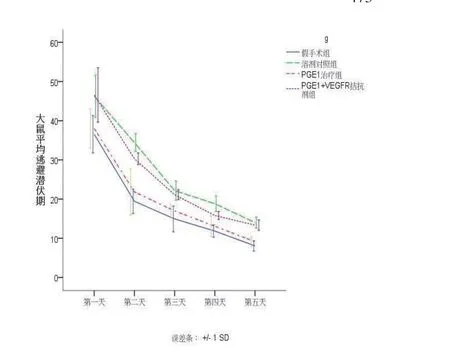
图1 药物处理后各组大鼠定位航行实验中逃避潜伏期线图 注:与溶剂对照组、PGE1+VEGFR拮抗剂比较,PGE1治疗组的平均潜伏期明显降低(P<0.05);与假手术组相比,溶剂对照组逃避潜伏期增加(P<0.05)

图2 药物处理后各组大鼠在定位航行实验中的游泳轨迹 注:A、B、C、D分别代表PGE1治疗组、溶剂对照组、假手术组、PGE1+VEGFR拮抗剂组;实验1 d,各组游泳轨迹呈“边缘型”,PGE1治疗组、假手术组3 d便能迅速地找到平台,5 d轨迹近似“直线型”
2.2 海马组织VEGF、BDNF蛋白的表达 蛋白印迹结果显示,PGE1治疗组、PGE1+VEGFR拮抗剂组VEGF蛋白相对表达量较溶剂对照组升高(P<0.05),但PGE1治疗组与PGE1+VEGFR拮抗剂组间无明显差异(P>0.05);而溶剂对照组VEGF蛋白的相对表达量较假手术组升高(P<0.05)。PGE1治疗组BDNF蛋白表达量高于溶剂对照组及PGE1+VEGFR拮抗剂组(P<0.05);而溶剂对照组BDNF蛋白的相对表达量则高于假手术组(P<0.01)(见图3、表3)。
3 讨论
导致VD的脑血管疾病中,以缺血性脑血管病最常见,卒中后痴呆发生率可达30%[9],痴呆患者常伴有学习记忆认知功能障碍,给个人、家庭及社会带来了极大的负担,因此探讨VD的发病机制及可能治疗尤为迫切。现认为血管损伤和内皮功能异常参与了VD的发生、发展,尤其是丘脑、海马区的血管损害。海马是学习记忆形成的关键结构,且对缺血缺氧改变敏感。CHP引起的线粒体功能障碍及蛋白合成抑制、微循环障碍及脂质过氧化等缺血缺氧性脑损害[10]易波及海马组织并降低大鼠学习记忆功能,因而与VD的发生密切相关[11]。
BCCAO法可引起持久性脑低灌注、蛋白表达异常、不可逆性记忆认知功能障碍等,且能较好的模拟人类VD的发生,常用于制作VD大鼠模型[6],本实验显示,溶剂对照组的学习获得能力较假手术组差且对平台位置存在着记忆障碍,进一步证实BCCAO法所致的CHP可导致大鼠学习记忆功能障碍,可用于VD大鼠模型的制作。
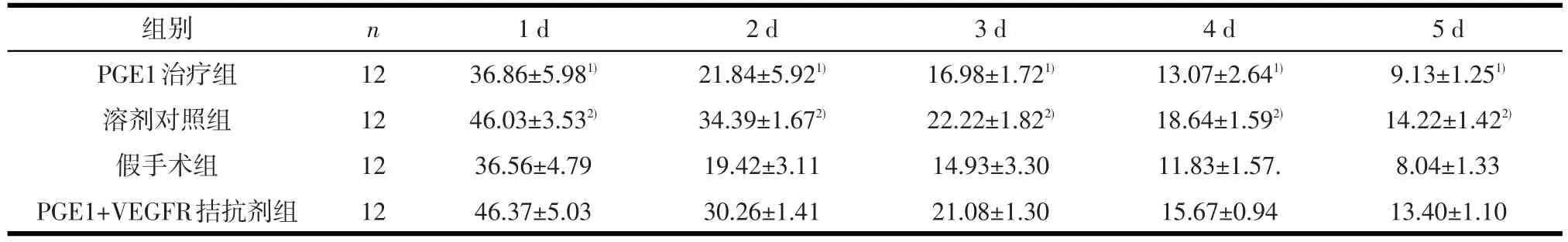
表1 药物处理后各组大鼠定位航行实验中每天逃避潜伏期(s)

表2 空间探索中大鼠跨越平台次数及原平台象限停留时间百分比
表3 各组大鼠海马组织VEGF、BDNF的相对表达量()

表3 各组大鼠海马组织VEGF、BDNF的相对表达量()
1)与溶剂对照组比较,P<0.05;与PGE1+VEGFR拮抗剂组比较,P>0.05;2)与溶剂对照组、PGE1+VEGFR拮抗剂组比较,均P<0.05;3)与假手术组比较,均P<0.05
分组PGE1治疗组溶剂对照组假手术组PGE1+VEGFR拮抗剂组n 6666 VEGF 0.057±0.0051)0.038±0.0023)0.027±0.0020.053±0.003 BDNF 0.481±0.0492)0.339±0.0213)0.224±0.0400.373±0.034

图3 大鼠海马组织VEGF、BDNF蛋白表达条带图
本实验将PGE1用于VD大鼠进行研究,结果发现PGE1治疗组学习记忆能力较溶剂对照组明显改善,首次证实了PGE1可减轻CHP所致的VD大鼠认知功能损害,其具体机制尚不清楚;我们尚发现PGE1治疗组VEGF、BDNF的表达均较溶剂对照组显著增加。VEGF、BDNF作为重要的神经血管因子,可促进血管的再生、神经的生长、抑制神经元凋亡及神经功能的恢复,在VD的发生发展中起着重要作用。Tarkowski等[12]研究发现VD患者脑脊液中VEGF水平显著升高,且中药治疗可通过促进VD大鼠海马组织VEGF表达改善其学习记忆能力[13],提示VEGF直接参与VD的发生并可改善认知功能;其机制亦可能与VEGF的促血管新生有关,Trollmann等[14]研究认为外源性VEGF治疗可增加早期缺血性脑损害大鼠模型的脑血流量并改善预后,且VEGF表达可提高脑组织抗低氧损害能力。而另一神经血管因子BDNF减轻海马损害并改善VD大鼠认知行为能力的作用亦有文献报道[15],因BDNF可促进神经再生及侧脑室下区、齿状回新生神经元的迁移[16];且BDNF可结合血管内皮细胞表面受体发挥血管保护作用并降低神经组织缺血缺氧性损害。因此,我们推测PGE1改善学习记忆的能力或与上调VEGF、BDNF表达有关。另外,该实验还显示溶剂对照组VEGF、BDNF的相对表达量均较假手术组升高,说明CHP导致的慢性缺血缺氧性脑损害可诱导内源性代偿性VEGF、BDNF的分泌。
VEGF主要通过与VEGFR2结合发挥作用,VEGFR不仅分布于血管内皮细胞表面,亦分布于其他细胞如神经元表面,SU5416是VEGFR2的特异性拮抗剂[8],可通过拮抗VEGF/VEGFR2的结合而阻止VEGF的促血管新生及神经元保护作用[3]。该实验显示PGE1+VEGFR拮抗剂组VEGF的表达量与PGE1治疗组间无明显差异,但PGE1+VEGFR拮抗剂组学习记忆功能较PGE1治疗组降低,说明VEGF可减轻低灌注性脑损害并改善认知功能,而VEGFR拮抗剂则可抑制VEGF的这一效用。
实验还发现PGE1+VEGFR拮抗剂组BDNF的表达亦较PGE1治疗组降低,提示VEGFR拮抗剂可通过阻碍VEGF/VEGFR结合而抑制BDNF的分泌,并进一步说明PGE1上调的BDNF表达可能与VEGF/VEGFR分子通路有关,但具体机制尚不清楚。Wang等[17]认为VEGF/VEGFR可促进血管内皮细胞增生及保护血管内皮细胞完整性,而脑血管内皮细胞增生及功能完整则可促进BDNF分泌[18];另外,VEGF/VEGFR结合后可激活相关细胞通路如PI3K/AKT、p44/42 MAPK等依赖的CREB等相关组件[19-20],而CREB是促进BDNF表达的重要因子。
总之,PGE1可上调血管性痴呆大鼠海马组织VEGF、BDNF蛋白的表达,并可改善血管性痴呆大鼠的学习记忆功能,而VEGFR拮抗剂SU5416可降低PGE1上调BDNF表达及改善学习记忆功能的作用。但相关的免疫组化学研究及PGE1对VD大鼠脑血流量的影响仍需进一步探讨,也是我们课题的下一部分研究内容。
[1]Ke XJ,Zhang JJ.Changes in HIF-1α,VEGF,NGF and BDNF levels in cerebrospinal fluid and their relationship with cogni⁃tive impairment in patients with cerebral infarction[J].Hua⁃zhong Univ Sci Technolog Med Sci,2013,33(3):433-437.
[2]Dayi A,Cetin F,Sisman AR,et al.The effects of oxytocin on cognitive defect caused by chronic restraint stress applied to ad⁃olescent rats and on hippocampal VEGF and BDNF levels[J].Med Sci Monit,2015,21:69-75.
[3]Wentong F,Hongjian L,Liaosheng Z.Protective effects of pros⁃taglandin E1 on human umbilical vein endothelial cell injury in⁃duced by hydrogen peroxide[J].Acta Pharmacol Sin,2010,31(4):485-492.
[4]吉章阁,张素平,凌莉,等.前列腺素E1对脑梗死后神经干细胞增殖和迁移的影响[J].中国神经精神疾病杂志,2013,39(6):326-330.
[5]易玉新,杨宇,屈晓冰,等.前列腺素E1脂微球制剂治疗老年脑梗塞的疗效[J].中日友好医院学报,2004,1.
[6]Shu Y,Zhang H,Kang T,et al.PI3K/Akt signal pathway in⁃volved in the cognitive impairment caused by chronic cerebral hypoperfusion in rats[J].Plos One,2013,8(12):e81901.
[7]Zhang ZH,Shi GX,Li QQ,et al.Comparison of cognitive perfor⁃mance between two rat models of vascular dementia[J].Int J Neurosci,2014,124(11):818-823.
[8]Yizhou W,Shukui Q,Xiaoqiang G,et al.Flk-1 specific kinase inhibitor SU5416 blocked angiogenesis of Lewis carcinoma in mouse and prolonged the survival[J].Chinese-German Journal of Clinical Oncology,2008,7(7):420-423.
[9]Hénon H,Pasquier F,Leys D.Poststroke Dementia[J].Cerebro⁃vascular diseases,2006,22(1):61-70.
[10]Liu H,Zhang J.Cerebral hypoperfusion and cognitive impair⁃ment:the pathogenic role of vascular oxidative stress[J].Int J Neurosci,2012,122(9):494-499.
[11]Zuloaga KL,Zhang W,Yeiser LA,et al.Neurobehavioral and imaging correlates of hippocampal atrophy in a mouse model of vascular cognitive impairment[J].Trans Stroke Res,2015,epub ahead of print.
[12]Tarkowski E,Issa R,Sjögren M,et al.Increased intrathecal lev⁃els of the angiogenic factors VEGF and TGF-beta in Alzheim⁃er's disease and vascular dementia[J].Neurobiol Aging.2002,23(2):237-243.
[13]马宏博,司国民,孙培军.益智通脉颗粒对血管性痴呆大鼠脑组织VEGF表达的影响[J].中国中医急症,2009,8(1):80-81.
[14]Trollmann R,Richter M,Jung S,et al.Pharmacologic stabiliza⁃tion of hypoxia-inducible transcription factors protects develop⁃ing mouse brain from hypoxia-induced apoptotic cell death[J].Neuroscience.2014,278:327-342.
[15]Ortiz JB,Mathewson CM,Hoffman AN,et al.Hippocampal brain-derived neurotrophic factor mediates recovery from chron⁃ic stress-induced spatial reference memory deficits[J].Eur J Neurosci,2014,40(9):3351-3362.
[16]Schabitz WR,Steigleder T,Cooper-Kuhn CM,et al.Intrave⁃nous brain-derived neurotrophic factor enhances poststroke sen⁃sorimotor recovery and stimulates neurogenesis[J].Stroke,2007,38(7):2165-2172.
[17]Wang L,Zhang T,Fang M,et al.Podocytes protect glomerular endothelial cells from hypoxic injury via deSUMOylation of HIF-1α signaling[J].Int J Biochem Cell Biol,2015,58:17-27.
[18]Grade S,Weng YC,Snapyan M,et al.Brain-Derived Neuro⁃trophic Factor Promotes Vasculature-Associated Migration of Neuronal Precursors toward the Ischemic Striatum[J].Plos One,2013,8(1):e55039.
[19]Matsuzaki H,Tamatani M,Yamaguchi A,et al.Vascular endo⁃thelial growth factor rescues hippocampal neurons from gluta⁃mate-induced toxicity:signal transduction cascades[J].FASEB J.2001,15(7):1218-1220.
[20]Tian X,Guo J,Zhu M,et al.Opioid receptor activation rescues the functional TrkB receptor and protects the brain from isch⁃emia-reperfusion injury in the rat[J].PLos One,2013,8(7):e69252.

