低位直肠间质瘤腹腔镜辅助下的经内外括约肌间切除术*
崔明明 张宏 刘鼎盛 张方圆 苟康 蔡圣彬 凌云志
·临床研究与应用·
低位直肠间质瘤腹腔镜辅助下的经内外括约肌间切除术*
崔明明 张宏 刘鼎盛 张方圆 苟康 蔡圣彬 凌云志
目的:针对伊马替尼治疗下的低位直肠间质瘤,探讨腹腔镜辅助下经内外括约肌间切除术的安全性和可行性。方法:随访2007年1月至2011年1月9例低位直肠间质瘤患者,在术前接受伊马替尼治疗后行腹腔镜辅助下的经内外括约肌间切除术。结果:伊马替尼治疗前肿瘤大小为5~9 cm(中位值7.0 cm),治疗后肿瘤大小为2~4.5 cm(中位值3.5 cm)(P<0.001)。治疗3~24个月(中位值7个月)行腹腔镜辅助下的经内外括约肌间切除术,住院时间5~9天(中位值7天),所有患者均行保护性造口,术后3个月行造口还纳术。Wexner评分在伊马替尼治疗前为1~4分(中位值2分),治疗后为1~5分(中位值2分)(P=0.397);造口还纳术后Wexner评分4~9分(中位值7分),较术前明显增加(P<0.001),术后1年为1~5分(中位值2分),与术前比较差异无统计学意义(P=0.842)。术后有6例继续服用伊马替尼24~30个月。1例未继续服用伊马替尼,患者在30个月时出现盆底复发。结论:腹腔镜辅助下的经内外括约肌间切除术对于低位直肠间质瘤的治疗是安全可行的。
直肠间质瘤 腹腔镜 经内外括约肌间切除术
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)多见于胃(50%~60%)与小肠(20%~30%),而结直肠间质瘤在临床上比较少见,发生率较胃和小肠间质瘤低[1]。有文献报道结肠和直肠间质瘤占胃肠道间质瘤的1.2%和4.4%[2],低位直肠间质瘤是指肿瘤离肛缘5 cm内的间质瘤,既往无规范化的手术方式,由于间质瘤在临床早期无特异性症状,一旦确诊,常因肿瘤较大、距肛缘较近而难以局部切除或保
留肛门,常需行腹会阴切除术。
随着靶向治疗药物的问世,很多病例在使用靶向药物治疗后肿瘤缩小[3]。这提高了低位直肠间质瘤手术的保肛概率。腹腔镜辅助下的经内外括约肌间切除术(laparoscopic intersphincteric resection,ISR),对于应用伊马替尼治疗后的低位直肠间质瘤切除在技术上是安全可行的。
1 材料与方法
1.1一般资料
选取2007年1月至2011年1月低位直肠间质瘤患者9例,其中男性5例,女性4例;年龄43~71岁,平均年龄56岁。病例标准:1)肿瘤距肛门较近,肿瘤未侵及周围脏器(前列腺或阴道),有远处转移,经靶向药物治疗后肿瘤可见明显缩小者,术前免疫组织化学检查提示CD34或CD117阳性者。2)所有病例均经肠镜,超声内镜,腹腔CT及盆腔MRI检查。肠镜和超声内镜主要用于评估肿瘤距肛缘的距离及肿瘤大小。CT和MRI则用于评估肿瘤大小,侵犯深度及淋巴结情况等。3)所有病例均经肛门用细穿刺针留取标本活检,病理均经HE染色和免疫组织化学检查,证实为直肠间质瘤。这些病例因肿瘤较大,距肛缘较近而难以行保肛手术。
所有病例在术前均使用靶向药物(伊马替尼)治疗(400 mg/天),服药后每半年复查CT或MRI,评估肿瘤缩小的程度,判断疗效。
1.2方法
经伊马替尼治疗后,所有病例均行腹腔镜直肠间质瘤ISR手术,术中建立气腹,维持腹内压在12 mmHg,脐部行12 mm套管针穿刺,于此腹腔镜进入,在腹腔镜监视下分别于脐部偏下左,右腹直肌外侧缘行5 mm套管针穿刺,分别于麦氏点和反麦氏点外下方行12 mm和5 mm套管针穿刺。因直肠间质瘤不经淋巴途径转移,无需在肠系膜下动脉根部切断血管。在Toldt's间隙游离肠管,进行全直肠系膜切除,向下游离至肛提肌水平,再自肛提肌裂口顺直肠壁向下游离。腹部游离完毕后行会阴部手术,牵开肛门,在齿状线水平游离肿瘤下缘,肿瘤侧可切除多些组织,分离后与腹腔相通,自肛门拉出肠管,切除标本。近端肠管置入吻合器抵钉座,在肛管上方的断端行烟缝合包,行肛管乙状结肠端端吻合术。所有病例均加行回肠保护性造口术。
1.3随访
术后随访28~36个月,每3个月进行临床检查,每6个月复查腹腔CT或MRI,每12个月复查肠镜。部分病例术后继续应用伊马替尼治疗。若无肿瘤复发,术后3个月行回肠造口还纳术。
2 结果
9例直肠间质瘤的临床特征和治疗效果见表1。伊马替尼治疗前肿瘤下缘距齿状线的距离为0~2 cm,中位值1 cm;肿瘤大小为5~9 cm,中位值7 cm;应用伊马替尼治疗3~24个月,中位值7个月。治疗后复查肿瘤大小为2~4.5 cm,中位值3.5 cm,肿瘤明显缩小(P<0.001);肿瘤下缘距齿状线的距离0.5~3 cm,中位值2 cm,肿瘤下缘距齿状线的距离延长(P<0.001)。9例患者在应用伊马替尼治疗后均接受腹腔镜直肠间质瘤ISR手术,手术均达到R0切除,远端切缘为阴性。9例患者均加行回肠保护性造口术。手术时间为200~240 min,中位值215 min。
术后有1例发生肠梗阻并发症,经保守治疗后缓解;有1例排尿功能障碍,出现尿潴留,经保守治疗后缓解,其余患者排尿功能恢复良好。术后住院时间为5~9天,中位值7天。术后有6例继续应用伊马替尼治疗,3例未用。9例患者在术后3个月均接受回肠造口还纳术。术后随访28~36个月。术后有6例继续服用伊马替尼治疗24~36个月。其中只有1例未继续服用伊马替尼治疗的在30个月出现盆底复发。9例术后均无肝转移等血行转移征象。在伊马替尼治疗前Wexner评分为1~4分(中位值2分),治疗后为1~5分(中位值2分)(P=0.397);造口还纳术后Wexner评分4~9分(中位值7分),较术前明显增加(P<0.001),术后1年为1~5分(中位值2分),与术前比较差异无统计学意义(P=0.842,表2)。

表19 例患者临床病理资料Table 1Clinicopathological data of 9 patients
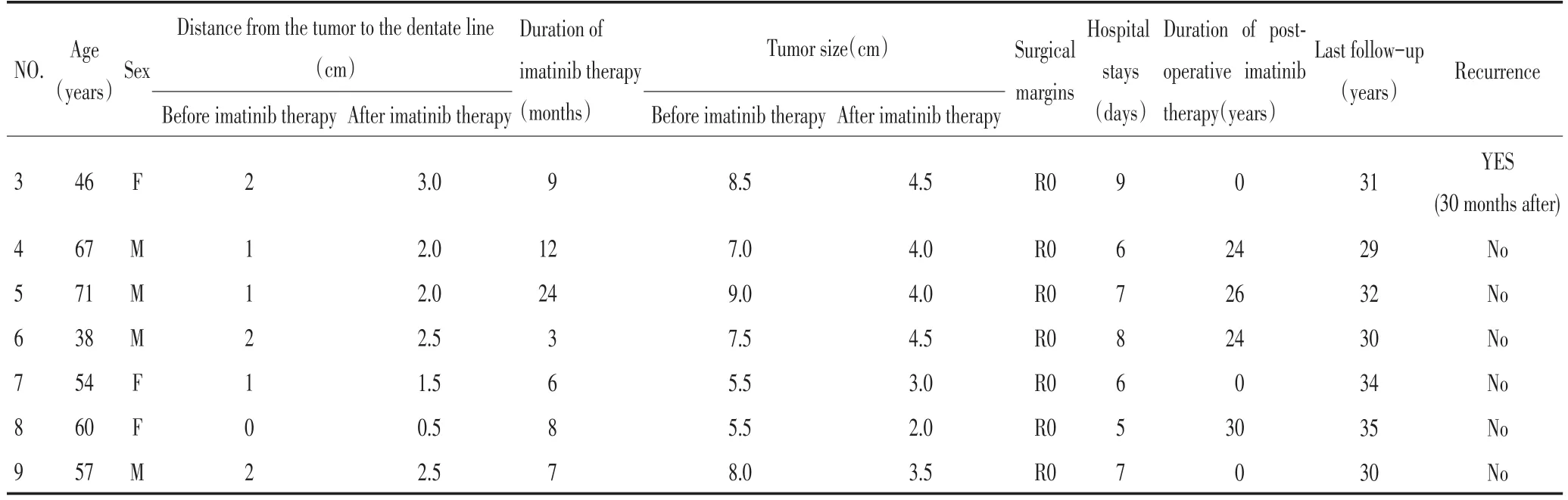
表19 例患者临床病理资料(续表1)Table 1Clinicopathological data of 9 patients
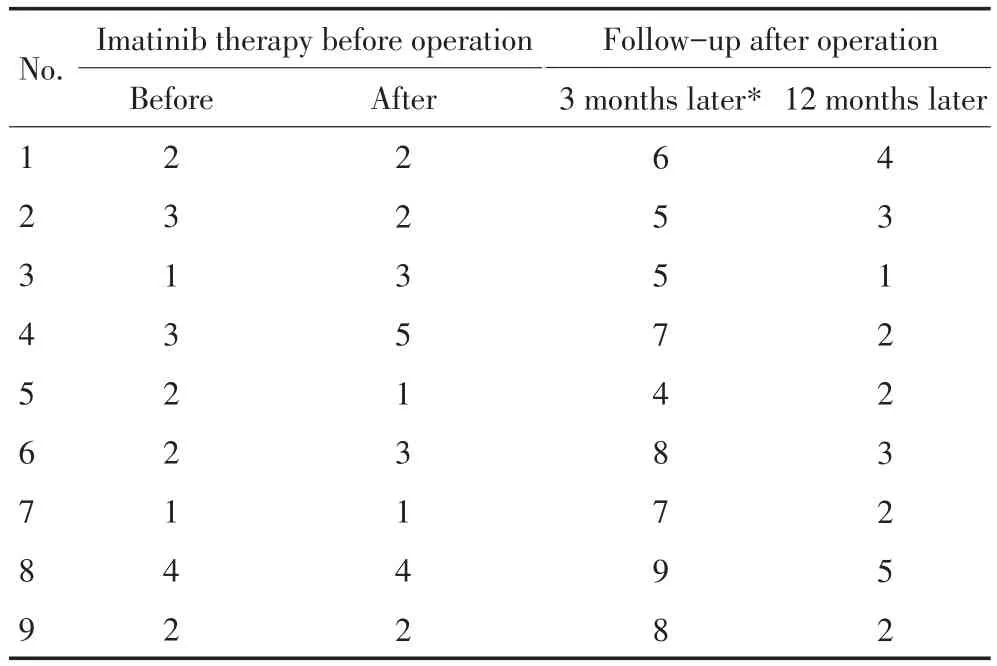
表2 Wexner评分Table 2Wexner scores
3 讨论
直肠间质瘤是起源于直肠间质星形胶质细胞的间叶源性肿瘤,具有多向分化的特征,肿瘤细胞存在c-kit基因突变及蛋白的表达;其发生率低,仅占直肠恶性肿瘤的0.1%。现在很多学者认为,所有的GIST都具有潜在恶性,提倡根据肿瘤大小和核分裂象用危险度分级来评价其侵袭行为。直肠间质瘤好发于中老年人,临床表现无特异性,常表现为排便习惯改变,排便刺激症状及肠梗阻,而便血少见,但也有文献报道便血为最常见的初始症状,且伴有便血症状的直肠间质瘤预后较差[4]。直肠指诊可发现直肠壁黏膜面光滑,肿物凸出于肠腔、基底宽、质硬、界限清、活动差。直肠间质瘤的确诊依靠病理诊断,本研究9例患者均先经肛门用细穿刺针取肿瘤组织,病理证实为间质瘤。直肠间质瘤主要转移途径为血行转移,多见于肝转移,一般不经淋巴途径转移。化疗和放疗疗效甚微,相比胃肠道间质瘤(28%~61%)[5],低位直肠间质瘤的远处转移率更低(13%)[6]。外科手术切除是治疗直肠间质瘤的有效方法[7],首次治疗能否完整切除肿瘤是影响预后的重要因素[8],要切除足够的正常边缘组织[9]。既往文献报道直肠间质瘤的局部复发率高于胃和小肠间质瘤,这可能与后者R0切除的可能性更高有关[10],手术应尽可能达到R0切除,文献报道约8.8%的病例为R1切除,这可能与肿瘤大小(>10 cm),肿瘤位置(位于直肠)以及术中肿瘤破裂有关[11]。对于低位直肠间质瘤而言,常需行腹会阴联合切除术,无法保留肛门[12],术后的生活质量较差。腹腔镜手术是目前结直肠手术的发展趋势,已经证实能完全达到传统开腹手术的切除效果,在总生存率、无瘤生存率及局部复发率与传统开腹手术比较无明显差异[13-14]。已有文献报道胃肠道间质瘤,尤其是直肠间质瘤也可受益于腹腔镜手术[15-16]。腹腔镜直肠间质瘤ISR手术,因术中腹腔镜可以在盆底获得更好的视野,通过多个观察角度,更清晰地分辨出盆底解剖结构,从而可以准确、完整及安全的切除病变,增加保留肛门功能的概率,并且术后性功能和排尿功能也恢复良好;而且因其腹壁除了戳卡孔外无辅助切口,更符合目前微创化的发展趋势,更易于被患者从心理上所接受。
有文献报道直肠间质瘤在术前若未经伊马替尼治疗,术后复发率约为40%,5年生存率约为54%[8]。伊马替尼被证实对控制GIST非常有效[17-19]。外显子11c-kit突变的病例,敏感度能达到83.5%;对于外显子9c-kit突变或无kit、PDGFRA突变的病例,敏感度能达到47.8%。临床研究表明约有50%患者对伊马替尼敏感,其中至少80%能获得有效缓解[3]。低位直肠间质瘤常因肿瘤较大,肿瘤下缘距肛缘较近及骨盆狭窄,手术操作空间小等因素难以手术切除,即使能够切除,也常无法保留肛门,需要行腹会阴联合切除术。自2005年以来,陆续有文献报道直肠间质瘤经过伊马替尼治疗,可以使肿瘤体积缩小,提高了
肿瘤的切除率[19],并使保留肛门的手术成为可能[9,20-21]。本研究中,伊马替尼治疗至少3个月后,出现肿瘤体积缩小,肿瘤下缘距肛缘的距离变长及肿瘤细胞核分裂象减少,使保留肛门括约肌的手术成为可能。关于外科手术的介入时机至今仍存在争议,有研究建议在出现药物耐药性及其他副作用之前,如果肿瘤体积停止缩小,这时就需要外科手术。最近的研究认为伊马替尼治疗的中位时间是28周,超过34周则获益较小[22];还有文献报道伊马替尼治疗的中位时间约为4个月(107天)[3]。也有研究报道应用伊马替尼治疗1.3~3个月后实施外科手术[15,20,23]。Verweij等[3]推荐伊马替尼的疗程应该为4~6个月。本研究中,伊马替尼的治疗时间绝大部分在3~12个月,但因个体差异,药物治疗期间需要严密观察不良反应和疗效。一旦出现耐药性或严重的不良反应,需要立即中止药物治疗。直肠间质瘤在术中不需高位切断肠系膜下动脉及全直肠系膜切除,但仍推荐术中按TME原则进行游离,因为在正确的解剖间隙内游离会减少出血和副损伤的可能。本研究中,有病例在伊马替尼治疗后,出现肿瘤下缘距肛缘的距离延长,这使得直肠低位前切除术成为可能,但此术式存在争议,因无法确定肿瘤下端的安全切缘,所以仍推荐行直肠ISR术[14]。考虑到伊马替尼治疗后会出现肠壁水肿,而且吻合口的位置较低,增加了吻合口瘘的发生概率,本研究9例均行回肠保护性造口术。术后患者并发症的发生率较低,仅出现1例肠梗阻和1例排尿功能障碍。术后的肠道功能、排尿功能等恢复较快,这可能与腹腔镜手术有关,对患者造成的不良反应较小。术后患者的肛门功能恢复良好,在回肠造口还纳之后,9例均无排便困难及便失禁的发生,术后1年Wexner评分与术前比较差异无统计学意义。
总之,对于低位直肠间质瘤来说,腹腔镜辅助下的经内外括约肌间切除术在技术上是安全可行的,术前应用伊马替尼治疗可使肿瘤体积缩小,肿瘤下端距肛缘距离延长及核分裂象减少,这使保留肛门括约肌的手术成为可能。本研究推荐联合伊马替尼和腹腔镜手术治疗低位直肠间质瘤,尽可能保留肛门功能,提高患者的术后生存质量。但因本研究病例较少,仍需进行大样本的统计研究。
1Miettinen M,Lasota J.Gastrointestinal stromal tumors:pathology and prognosis at different sites[J].Semin Diagn Pathol,23(2):70-83.
2Tran T,Davila JA,El-Serag HB.The epidemiology of malignant gastrointestinal stromal tumors:an analysis of 1,458 cases from 1992 to 2000[J].Am J Gastroenterol,2005,100(1):162-168.
3Verweij J,Casali PG,Zalcberg J,et al.Progression-free survival in gastrointestinal stromal tumours with high-dose imatinib:randomized trial[J].Lancet,2004,364(9440):1127-1134.
4Xiao CC,Zhang S,Wang MH,et al.Clinicopathological features and prognostic factors of rectal gastrointestinal stromal tumors[J].J Gastrointest Surg,2013,17(4):793-798.
5Rutkowski P,Nowecki ZI,Michej W,et al.Risk criteria and prognostic factors for predicting recurrences after resection of primary gastrointestinal stromal tumor[J].Ann Surg Oncol,2007,14(7):2018-2027.
6Agaimy A,Vassos N,Märkl B.Anorectal gastrointestinal stromal tumors:a retrospective multicenter analysis of 15 cases emphasizing their high local recurrence rate and the need for standardized therapeutic approach[J].Int J Colorectal Dis,2013,28(8):1057-1064.
7Bischof DA,Kim Y,Blazer DG,et al.Surgical management of advanced gastrointestinal stromal tumors:an international multi-institutional analysis of 158 patients[J].J Am Coll Surg,2014,219(3):439-449.
8Dematteo RP,Lewis JJ,Leung D,et al.Two hundred gastrointestinal stromal tumors:recurrence patterns and prognostic factors for survival[J].Ann Surg,2000,231(1):51-58.
9Casali PG,Blay JY.Gastrointestinal stromal tumours:ESMO Clinical Practice Guidelines for diagnosis,treatment and follow-up[J]. Ann Oncol,2010,21(5):98-102.
10 Agaimy A,Vassos N,Märkl B,et al.Anorectal gastrointestinal stromal tumors:a retrospective multicenter analysis of 15 cases emphasizing their high local recurrence rate and the need for standardized therapeutic approach[J].Int J Colorectal Dis,2013,28(8):1057-1064.
11 McCarter MD,Antonescu CR,Ballman KV,et al.Microscopically positive margins for primary gastrointestinal stromal tumors:analysis of risk factors and tumor recurrence[J].J Am Coll Surg,2012,215(1):53-59.
12 Pidhorecky I,Cheney RT,Kraybill WG,et al.Gastrointestinal stromal tumors:current diagnosis,biologic behavior,and management[J].Ann Surg Oncol,2000,7(9):705-712.
13 Kuroyanagi H,Oya M,Ueno M,et al.Standardized technique of laparoscopic intracorporeal rectal transection and anastomosis for low anterior resection[J].Surg Endosc,2008,22(2):557-561.
14 Fujimoto Y,Akiyoshi T,Kuroyanagi H,et al.Safety and feasibility of laparoscopic intersphincteric resection for very lower rectal cancer[J].J Gastrointest Surg,2010,14(4):645-650.
15 Nakamura T,Mitomi H,Onozato W,et al.Laparoscopic resection of a gastrointestinal stromal tumor of the rectum after treatment with imatinib mesylate:report of a case[J].Surg Today,2012,42(11):1096-1099.
16 Chen YH,Liu KH,Yeh CN,et al.Laparoscopic resection of gastrointestinal stromal tumors:safe,efficient,and comparable oncologic outcomes[J].J Laparoendosc Adv Surg Tech A,2012,22(8):758-763.
17 Joensuu H,Roberts PJ,Sarlom-Rikala M,et al.Effect of the tyrosine kinase inhibitor STI571 in a patient with a metastatic gastrointestinal stromal tumor[J].N Engl J Med,2001,344(14):1052-1056.
18 Balachandran VP,Dematteo RP.Targeted therapy for cancer the
gastrointestinal stromal tumor model[J].Surg Oncol Clin N Am,2013,22(4):805-821.
19 Eisenberg BL,Pipas JM.Gastrointestinal stromal tumor-background,pathology,treatment[J].Hematol Oncol Clin North Am,2012,26(6):1239-1259.
20 Wang JP,Wang T,Huang MJ,et al.The role of neoadjuvant imatinib mesylate therapy in sphincterpreserving procedures for anorectal gastrointestinal stromal tumor[J].Am J Clin Oncol,2011,34(3):314-316.
21 Beham AW,Schaefer IM,Schüler P,et al.Gastrointestinal stromal tumors[J].Int J Colorectal Dis,2012,27(6):689-700.
22 Tirumani SH,Shinagare AB,Jagannathan JP,et al.Radiologic assessment of earliest,best,and plateau response of gastrointestinal stromal tumors to neoadjuvant imatinib prior to successful surgical resection[J].Eur J Surg Oncol,2014,40(4):420-428.
23 Hou YY,Zohu Y,Lu SH,et al.Imatinib mesylate neoadjuvant treatment for rectal malignant gastrointestinal stromal tumor[J]. World J Gastroenterol,2009,15(15):1910-1913.
(2014-10-29收稿)
(2015-01-09修回)
(编辑:杨红欣)
Laparoscopy-guided intersphincteric resection for low rectal stromal tumor
Mingming CUI,Hong ZHANG*,Dingsheng LIU,Fangyuan ZHANG,Kang GOU,Shengbin CAI,Yunzhi LING
Hong ZHANG;E-mail:seasky1027@163.com
Objective:To investigate the clinical security and feasibility of neoadjuvant chemotherapy with imatinib following laparoscopy-guided intersphincteric resection for patients with gastrointestinal stromal tumor of the low rectum(GSTLR).Methods:Clinical data of nine patients with GSTLR who were admitted to the Shengjing Hospital between January 2007 and January 2011 were reviewed.These patients were treated with neoadjuvant imatinib chemotherapy after laparoscopic intersphincteric resection.Results:Prior to neoadjuvant chemotherapy,the tumor diameter ranged between from 5 cm to 9 cm(median=7.0 cm).After imatinib chemotherapy,the tumor diameter decreased to 2-4.5 cm(median=3.5 cm,P<0.001).Laparoscopic surgery through intersphincteric resection was performed after imatinib treatment for 3-24 months(median=7 months).All patients received a protective stoma,which was closed 3 months after the surgery.The Wexner scale scores ranged from 1 and 4(median=2)prior to neoadjuvant imatinib chemotherapy and changed to 1-5(median=2)after the chemotherapy(P=0.397).After stomal closure operation,the scores significantly increased to 4-9 (median=7,P<0.001)but were not statistically significantly different from those before the therapy.One year after laparoscopic surgery, the Wexner scale scores ranged from 1 to 5(median=2,P=0.842).Six patients were treated with imatinib for 24 and 30 months after laparoscopic surgery.Recurrence in pelvis occurred in only one patient,who ceased imatinib administration at the 30th month after the surgery.Conclusions:Laparoscopic surgery through intersphincteric resection was secure and feasible and thus could be used for treatment of GSTLR.
rectal stromal tumor,laparoscopy,intersphincteric resection

10.3969/j.issn.1000-8179.20141816
中国医科大学附属盛京医院结直肠肿瘤外科(沈阳市110004)
*本文课题受辽宁省自然科学基金项目(编号:2013010098)资助
张宏seasky1027@163.com
Department of Colorectal Surgery,China Medical University Shengjing Hospital,Shenyang 110004,China
This work was supported by the Liaoning Provincial Natural Science Foundation(No.2013010098)
崔明明专业方向为结直肠肿瘤外科治疗的研究。
E-mail:winds1027@163.com

