腹腔镜与开腹直肠癌手术的疗效观察
刘 超,文习刚,殷 奇,鲁 妍
(湖北省中山医院,湖北 武汉,430033)
1993 年Guillou 等通过59 例腹腔镜结直肠癌手术证实了腹腔镜手术的可行性,从此直肠癌手术的发展达到一个全新的境界[1]。随着近年腹腔镜器械的迅猛发展,腹腔镜结直肠手术在国内已得到广泛开展,但腹腔镜直肠癌全直肠系膜切除术(total mesorectal excision,TME)是否具有与开腹手术相同的治疗效果,目前仍存有争议。本观察回顾分析2010 年3 月至2012 年5 月湖北省中山医院手术治疗的40 例直肠癌患者,分别行腹腔镜与开腹TME,术后随访两年,旨在比较腹腔镜直肠TME 与开腹TME 的近期疗效。
1 资料与方法
1.1 临床资料观察组行腹腔镜TME(n=20),对照组行开腹TME(n=20)。病例纳入标准:术前肠镜及活检明确直肠腺癌,肿瘤距肛缘12 cm 以内;术前盆腔增强CT 或MRI分期T1~T3期,无需术前放化疗且无远处转移;无严重心、肝、脑、肺、肾等疾病。病例排除标准:T4需行新辅助放化疗及有远处转移;合并严重心、肝、脑、肺、肾等疾病;因急性肠梗阻、肠穿孔、肠出血等行急诊手术;行局部切除。两组均由同一组医师完成手术。两组患者年龄、性别、肿瘤部位、肿瘤Dukes 分期等差异无统计学意义,具有可比性(P >0.05)。见表1。
表1 两组患者一般情况的比较(±s)
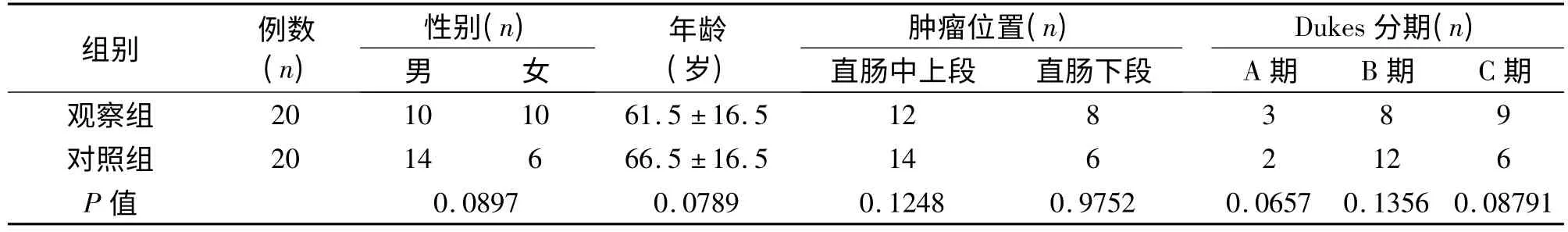
表1 两组患者一般情况的比较(±s)
1.2 手术方法
1.2.1 腹腔镜经腹直肠癌根治术(Dixon 术)[2-3]均全身麻醉,患者取截石位,头低足高20 ~30 度,手术台向右倾斜15 度,便于暴露左下腹。选择脐部作为腹腔镜入口,在右下腹腹直肌外缘做10 mm 切口,为主操作孔;分别于左、右侧腹及左侧腹直肌外缘做5 mm 切口,为辅助操作孔。建立气腹,穿刺Trocar,置入腹腔镜器械。进腹后探查病变,做出手术抉择。腹主动脉前打开后腹膜,游离、切断肠系膜下动静脉(图1)。由内向外游离结肠系膜。切开左侧后腹膜,将乙状结肠系膜自后腹膜壁游离(图2)。游离直肠时,沿直肠深筋膜与盆壁筋膜的间隙锐性分离(图3)。先分离其后部及侧部,再分离直肠前方。切开直肠前腹膜返折,由Denonvillier筋膜间的间隙分离直肠前壁与精囊腺(女性在直肠生殖膈平面进行分离)(图4)。切断两侧的侧韧带并注意保护盆腔的自主神经。最后将直肠游离至肿瘤下方。于肿瘤下方至少2 cm 处用腹腔镜切割缝合器切断直肠(图5)。下腹做相应大小的小切口,用塑料袋保护好切口,将带肿瘤的近端乙状结肠拉出腹腔外,切除肠段。将圆形吻合器的钉座放入近端乙状结肠,重新建立气腹,使用吻合器在腹腔镜直视下行乙状结肠-直肠端端吻合(图6)。冲洗盆腔,吻合口附近放置引流管,缝合切口。
1.2.2 腹腔镜腹会阴联合直肠癌切除术(Miles 术) 麻醉、体位、前部分操作同Dixon 术,靠近盆壁向下游离直肠,清除两盆壁脂肪淋巴组织。腹腔内用线型切割器离断乙状结肠,左下腹适当位置做腹壁造口。会阴组:荷包缝合肛门,切除直肠,由会阴取出标本,用大量蒸馏水经腹冲洗盆腔,彻底止血,放置引流管,缝合切口。
1.2.3 传统手术方式 采取下腹正中绕脐切口。分离乙状结肠两侧系膜,两边在腹膜返折处会师。再结扎肠系膜下动静脉并清扫相应部位淋巴结,沿直肠深筋膜与盆壁筋膜的间隙锐性分离。先分离其后部及侧部,再分离直肠前方。切开直肠前腹膜返折,由Denonvillier 筋膜之间的间隙分离直肠前壁与精囊腺(女性在直肠生殖膈平面分离)。切断两侧侧韧带,并注意保护盆腔的自主神经。直肠的切断采用闭合器,肠管吻合使用管状吻合器端端吻合。如果行Miles 术,则游离过程同上,盆腔直肠游离直达盆底,用线型切割器离断乙状结肠,在左下腹适当位置做腹壁造口。会阴组:荷包缝合肛门,切除直肠,从会阴取出标本,用大量蒸馏水经腹冲洗盆腔,彻底止血,放置引流管,缝合切口。
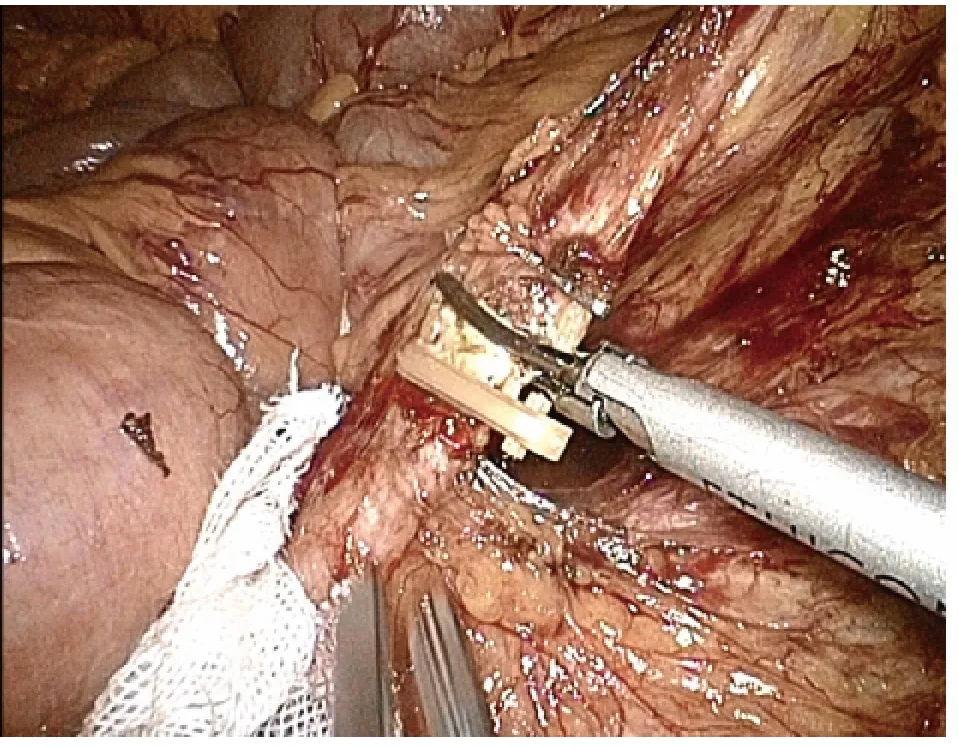
图1 根部结扎离断肠系膜下动脉
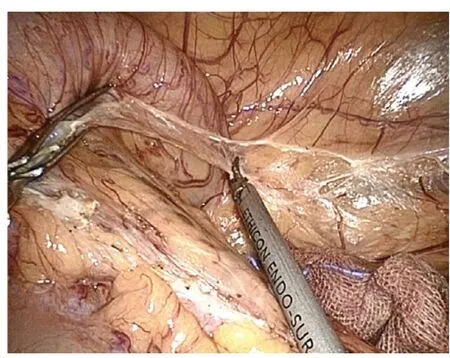
图2 由后腹膜壁游离乙状结肠系膜
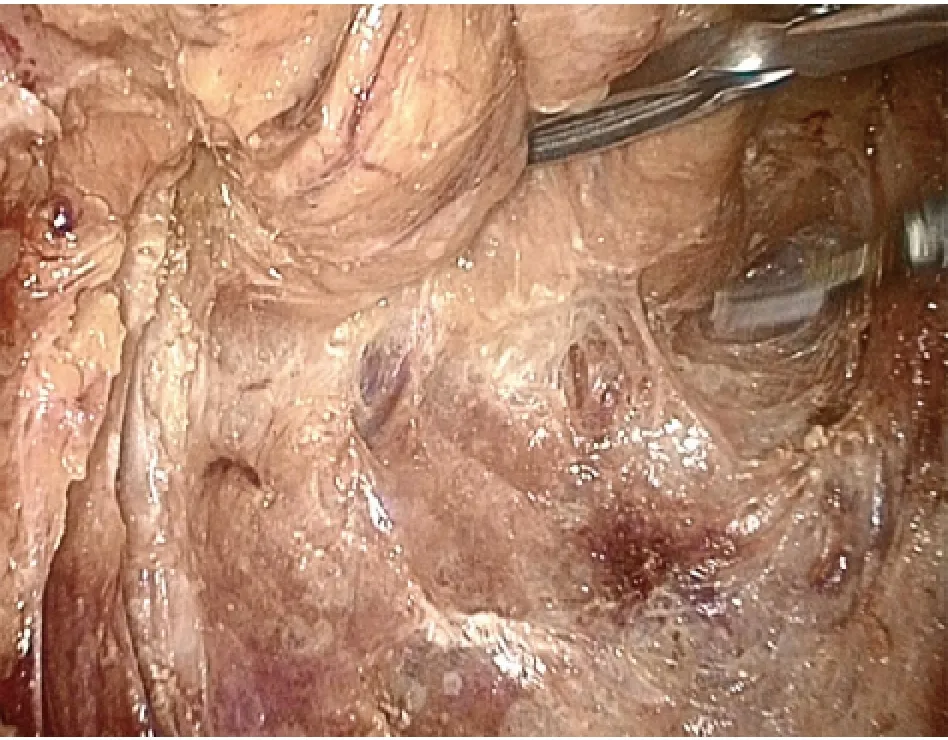
图3 分离直肠后间隙
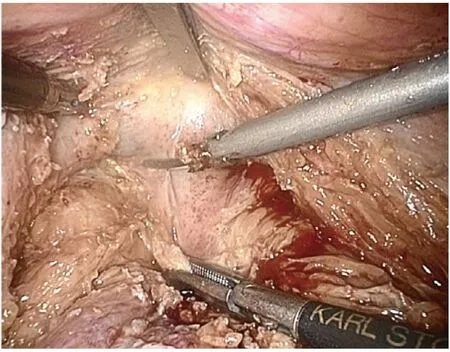
图4 分离Denonvillier 筋膜之间的间隙(男性)
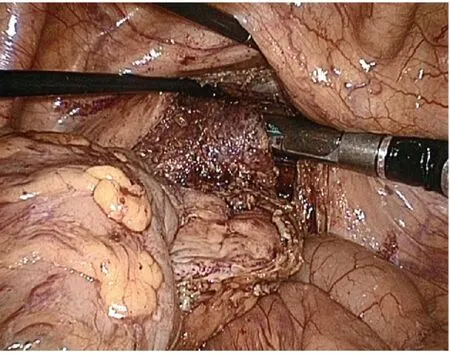
图5 肿瘤下方2 cm 处用腹腔镜切割缝合器切断直肠
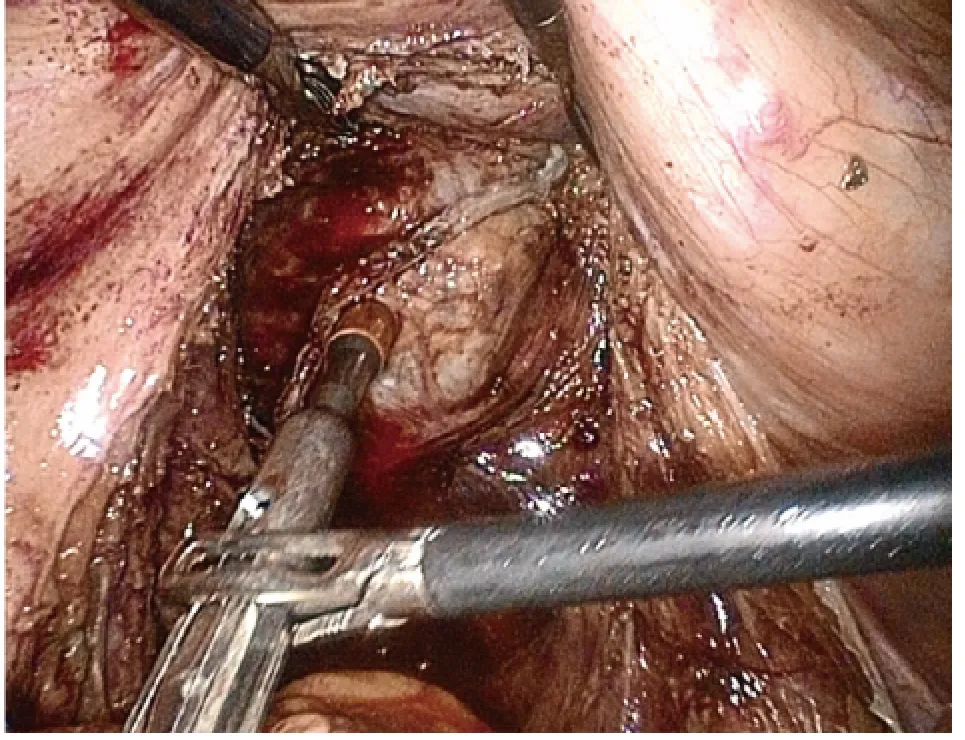
图6 腹腔镜直视下乙状结肠-直肠端端吻合器与抵钉座对接
1.3 观察指标手术相关指标包括手术时间、术中出血量;术后恢复指标:排气时间、骶前引流管拔除时间、下床活动时间、进食时间、住院时间;肿瘤根治性指标:切除标本长度、清扫淋巴结数量;术后并发症:相关并发症、一般并发症;患者一般情况:年龄、性别、肿瘤部位、肿瘤Dukes 分期等指标。
1.4 统计学处理使用SPSS 21 软件进行统计、分析,计量资料以均数±标准差(¯±s)表示,组间比较采用t 检验,计数资料比较采用χ2检验,P <0.05 为差异有统计学意义。
2 结 果
2.1 手术情况观察组均成功完成腹腔镜手术,无一例中转开腹,术中未见明显副损伤及大出血。观察组术中出血量较对照组减少,差异有统计学意义(P <0.05),而两组手术时间、手术切除标本长度、手术根治性差异无统计学意义(P >0.05)。见表2。2.2 术后恢复情况 观察组术后排气时间、骶前引流管拔除时间、下床活动时间、进食时间、住院时间优于对照组,差异有统计学意义(P <0.05)。见表2。
2.3 术后近期并发症两组患者术后均无死亡病例,两组感染相关并发症(以切口感染最明显)差异有统计学意义(P <0.05);吻合口漏、尿潴留、肠梗阻等非感染性并发症两组差异无统计学意义(P>0.05)。见表3。
2.4 术后随访两组患者均术后随访12 ~36 个月,术后均行FOLFOX6 方案化疗,化疗期间每月随访一次,化疗结束后每3 个月门诊随访复查,12 ~24个月之间每6 个月门诊复查,24 个月后每半年电话随访。观察组1 例患者因心肌梗死死亡,2 例患者电话更换无法随访;对照组现无死亡病例,3 例电话更改。目前,观察组局部复发1 例,肝脏转移1 例;对照组肝脏转移2 例,尚无局部复发病例。两组术后随访情况相比差异无统计学意义(P >0.05)。
表2 两组患者手术情况的比较(±s)
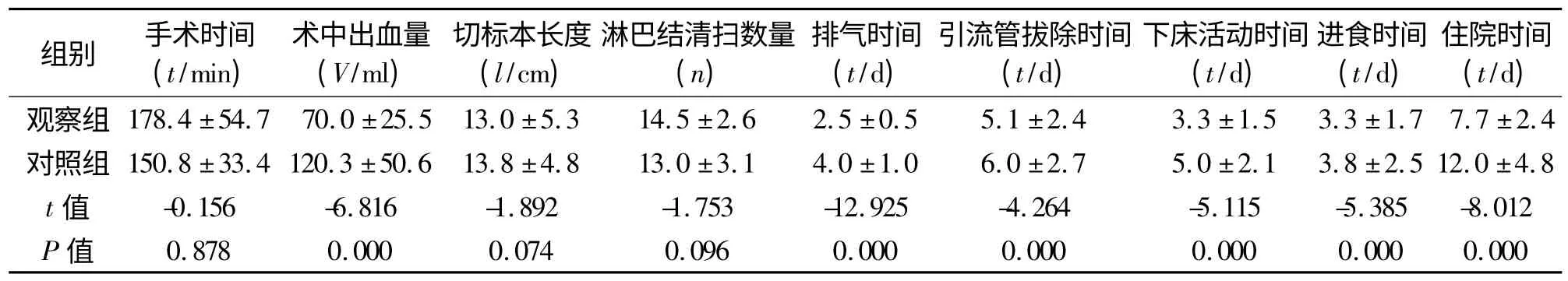
表2 两组患者手术情况的比较(±s)
?

表3 两组患者并发症的比较(n)
3 讨 论
直肠癌是消化道常见恶性肿瘤之一,随着社会人口平均年龄的不断提高,其发病率呈明显上升趋势,给患者生活质量带来很大影响,尤其距肛缘5 cm以内的肿瘤,更涉及到能否保肛的问题。手术切除仍是治疗直肠癌最主要的方法。Heald 等[4]于1982年提出的TME 概念使直肠癌切除术成为可靠的手术方式,1991 年Jacobs 等[5]报道了腹腔镜结肠癌切除术,使腹腔镜技术逐渐进入结直肠领域,并得到快速发展。腹腔镜直肠癌TME 手术的安全性、可行性已得到充分证实[6],但2013 年NCCN 指南指出现阶段腹腔镜技术用于临床实验阶段,不推荐在临床中常规应用。究其原因:一方面是中低位直肠周围解剖复杂,手术要求高,需要有经验的团队合作进行;再一方面是有关于腹腔镜直肠癌的远期预后尚不明确。
由于本研究标本数不多,暂未出现中转开腹情况。Miyajima 等[7]报道了一项日本回顾性多中心随机对照研究,纳入1 057 例腹腔镜直肠癌患者,包括腹腔镜直肠前切除术938 例、腹会阴联合切除107例、Hartmann 术10 例及其他手术2 例,总中转开腹率为7.3%,因此腹腔镜直肠癌手术在经选择的病例中由经验丰富的团队完成是安全的。
Lujan 等[6]的前瞻性多中心非随机研究分析了4 970 例直肠癌患者的临床资料,结果发现,腹腔镜组低位前切除术率高于开腹组[69.4%(963/1387)vs.61.0%(1841/3018),P <0.05],腹腔镜组患者术后生活质量优于开腹组。Trastulli 等[8]分析了9个临床随机对照实验,对比1 544 例直肠癌患者,其中开腹组703 例,腹腔镜组841 例,结果显示腹腔镜组较开腹组患者术中出血量少,术后进食早,肠道功能恢复快,住院时间短。我们的研究数据与其一致,与开腹手术相比,腹腔镜手术出血量少,术后排气时间、骶前引流管拔除时间、下床活动时间、进食时间、住院时间均较短。本研究中两组均R0 切除,手术下切缘距肿瘤均达2 cm 以上,环周切缘病理均为阴性,手术标本长度、淋巴结清扫数量差异无统计学意义(P >0.05)。van der Pas 等[9]的RCT 研究结果也提示相似结果,而且还提示对于低位、中位、高位直肠癌TME 完成率的差异也无统计学意义(P>0.05)。术后近期并发症主要为:吻合口漏、吻合口出血、肠梗阻、输尿管损伤、尿潴留、切口感染及肺部感染,与文献[10]报道相似。术中仔细检查吻合口发现出血可行经肛门止血,输尿管损伤术中注意正确的分离层次也可避免。本研究中吻合口漏、肠梗阻等非感染相关并发症发生率两组差异无统计学意义(P >0.05),而切口感染等感染相关性并发症发生率差异有统计学意义(P <0.05)。
本研究短期随访结果显示,观察组实际随访17例,对照组实际17 例,两组均无一例因“直肠癌”死亡,观察组局部复发率与远处转移率均为5.9%,对照组尚无局部复发情况,远处转移率10%,均高于现有研究结果[6,11],考虑可能存在两个因素:一是本研究样本小,部分患者随访不到位,二是患者肿瘤学类型特殊(远处转移者均为低分化腺癌),化疗反应不明显。但对于腹腔镜治疗直肠癌的远期预后尚无太多研究报道,目前的Ⅰ类证据主要来源CLASSIC研究,5 年研究结果提示两组生存率、无瘤生存期、局部复发率、切口种植率及远处转移率相近[12]。
综上所述,腹腔镜直肠癌TME 根治术是安全、可行的手术,具有出血少、切口小、康复快、并发症少等优势,短期预后与开腹手术相当。随着腔镜设备的不断发展,目前“3D”技术已成功融入其中,它能克服传统腔镜二维图像,使得图像更加逼真,操作准确性很高,解剖更加清楚,减少副损伤,进一步提高了腹腔镜手术的安全性与可行性。腹腔镜直肠癌根治术有望取代开腹直肠癌根治术成为首选术式。
[1] Xiong B,Ma L,Zhang C.Laparoscopic versus open total mesorectal excision for middle and low rectal cancer:a meta-analysis of results of randomized controlled trials[J].J Laparoendosc Adv Surg Tech A,2012,22(7):674-684.
[2] 吴东硕.普通外科腹腔镜手术图解[M].北京:人民卫生出版社,2008:89-101.
[3] 郑民华.普通外科腹腔镜手术操作规范与指南[M].北京:人民卫生出版社,2009:41-52.
[4] Heald RJ,Husband EM,Ryall RD.The mesorectum in rectal cancer surgery--the clue to pelvic recurrence?[J].Br J Surg,1982,69(10):613-616.
[5] Jacobs M,Verdeja JC,Goldstein HS.Minimally invasive colon resection(laparoscopic colectomy)[J].Surg Laparosc Endosc,1991,1(3):144-150.
[6] Lujan J,Valero G,Biondo S,et al.Laparoscopic versus open surgery for rectal cancer:results of a prospective multicentre analysis of 4,970 patients[J].Surg Endosc,2013,27(1):295-302.
[7] Miyajima N,Fukunaga M,Hasegawa H,et al.Results of a multicenter study of 1,057 cases of rectal cancer treated by laparoscopic surgery[J].Surg Endosc,2009,23(1):113-118.
[8] Trastulli S,Cirocchi R,Listorti C,et al.Laparoscopic vs open resection for rectal cancer:a meta-analysis of randomized clinical trials[J].Colorectal Dis,2012,14(6):e277-296.
[9] van der Pas MH,Haglind E,Cuesta MA,et al.Laparoscopic versus open surgery for rectal cancer(COLOR II):short-term outcomes of a randomised,phase 3 trial[J].Lancet Oncol,2013,14(3):210-218.
[10] 许钊荣,池畔.腹腔镜与开腹结直肠癌根治术后并发症发生率的比较[J].中华胃肠外科杂志,2012,15(8):810-813.
[11] Guillou PJ,Quirke P,Thorpe H,et al.Short-term endpoints of conventional versus laparoscopic-assisted surgery in patients with colorectal cancer(MRC CLASICC trial):multicentre,randomised controlled trial[J].Lancet,2005,365(9472):1718-1726.
[12] Jayne DG,Thorpe HC,Copeland J,et al.Five-year follow-up of the Medical Research Council CLASICC trial of laparoscopically assisted versus open surgery for colorectal cancer[J].Br J Surg,2010,97(11):1638-1645.

