红油香椿嫩芽不同部位理化指标及其体外抗氧化活性
王赵改,杨慧,陈丽娟,梁万平,张乐
(1.河南省农业科学院农副产品加工研究所,河南郑州 450008;2.驻马店市农业科学院资源环境研究所,河南驻马店 463000)
红油香椿嫩芽不同部位理化指标及其体外抗氧化活性
王赵改*1,杨慧1,陈丽娟1,梁万平2,张乐1
(1.河南省农业科学院农副产品加工研究所,河南郑州 450008;2.驻马店市农业科学院资源环境研究所,河南驻马店 463000)
试验以红油香椿为对象,研究香椿嫩芽的叶、茎不同空间部位(顶部、中部、下部)的总多酚、VC、可溶性糖、叶绿素、黄酮、可溶性蛋白质、亚硝酸盐等理化指标及其抗氧化活性,以期为香椿合理、科学、安全地开发利用加工提供理论依据。理化分析显示:除可溶性蛋白质及亚硝酸盐外,其他理化指标在香椿嫩叶中的含量均极显著高于茎中的含量(p<0.01),在叶中,总多酚及VC主要集中在顶叶;叶绿素及黄酮主要富集在下部叶片;可溶性糖在中叶中含量最高。茎中不同空间部位各理化指标之间差异不显著。抗氧化活性测定结果基本和理化分析结果一致,叶部的总还原力仍高于茎部。就嫩叶各空间部位来说,顶叶对清除·OH能力及总还原能力最高,远远高于其它部位;而不同部位茎的DPPH·的清除能力差别不大,浮动范围在2.29~3.37之间。
香椿不同部位;香椿嫩芽品质;抗氧化活性
香椿在中国有2 300多年的栽培历史,是中国特产食用植物资源,也是唯一可以进行设施栽培的木本蔬菜,其嫩芽味道鲜美、风味独特,富含至少17种氨基酸和多种维生素,营养全面均衡,逐渐成为餐桌上的高档珍稀保健蔬菜[1]。香椿还因富含黄酮、生物碱等生物活性物质而具有较高的药用价值,还具有抗菌消炎[2]、预防癌症[3]、降血糖[4]和抗氧化等功效[5-6]。
多年来,香椿的生产一直是房前屋后的零星栽培,在市场经济的驱使下,香椿栽培在全国范围内出现规模化猛增[7]。有关香椿种质资源利用、品种选育、栽培技术等采前方面的研究备受关注。然而,目前香椿的消费多以鲜嫩食用为主,由于果蔬采后均具有鲜活易腐、不耐贮运,生产季节性极强等特点,造成鲜食消费的空间很有限,这也是目前香椿产业发展的瓶颈。因此,香椿采后研究将是今后研究的重点,而香椿采后鲜嫩组织中有效成分的分析及功能研究是采后工作开展的基础。尽管杨玉珍[8]对不同种源的香椿营养成分进行了研究,但有关主要有效成分在香椿幼嫩组织内的空间积累分布却尚未见报道,其不同空间部位的抗氧化活性功能的研究也未见开展。因此,试验中分别对红油香椿幼嫩组织空间部位(叶、茎及其不同部位)的理化因子及其提取液的抗氧化活性进行了研究,不仅为香椿幼嫩组织的合理、科学、安全开发利用提供了理论依据和技术支持,同时为拓宽香椿幼嫩组织的消费方式,促进香椿产业的健康可持续发展提供了思路。
1 材料与方法
1.1 试验材料
香椿品种为棚栽红油香椿,于2014年2月中旬采自河南省郑州市中牟县田庄村的河南省农业科学院香椿示范基地,选取新鲜、健壮、成熟度及长度相对一致,无病虫害和机械损伤、带有6个分支、长度15 cm左右的香椿嫩芽进行试验。
1.2 试验设计
带有6个分支的香椿嫩芽长度约15 cm,其中最下面的2支作为下部(取嫩芽下部长度约5 cm),中间2支作为中部(取嫩芽中部长度约5 cm),最上面2支为上部(取嫩芽上部长度约5 cm),上、中和下3部分又分为叶部和茎部,即分为上叶、中叶、下叶、上茎、中茎及下茎共6个部位。
1.3 指标的测定
1.3.1 品质指标的测定总多酚含量的测定参照Wang等的方法[9];抗坏血酸VC测定参照Gao[10]等的方法;可溶性蛋白质含量的测定采用考马斯亮蓝法[11];还原糖含量采用蒽酮比色法测定[12];叶绿素含量的测定采用分光光度法[13];黄酮含量测定采用硝酸铝法,具体参照Hsu等的方法[14];亚硝酸盐含量的测定参照GB5009.33—2010。
1.3.2 抗氧化活性的测定
1)抗氧化物质的提取:将香椿嫩芽切碎称取10 g,加入体积分数60%乙醇100 mL于60℃、80 W功率下超声提取30 min,10 000 r/min下离心后收集上清液,沉淀再加体积分数60%乙醇50 mL,重复提取2次,合并3次上清液定容至200 mL,作为抗氧化物质提取液,其质量浓度为50 mg/mL,于4℃冷藏备用。将香椿6部位提取液分别稀释成1、3、5、7、9 mg/mL 5个质量浓度,用于抗氧化活性测定。
2)清除羟基自由基能力、清除DPPH自由基能力及总还原能力的测定参照Jiang等[15]的方法,稍作改动。
1.4 数据处理与分析
所有数据均采用Origin 8.6和SPSS11.5软件进行分析。
2 结果与分析
2.1 红油香椿嫩芽不同部位品质和生理生化指标
2.1.1 红油香椿嫩芽不同部位总多酚含量红油香椿嫩芽不同部位总多酚含量如图1所示,香椿上叶、中叶、下叶中总多酚含量分别高达8.98 mg/g、7.26 mg/g和6.95 mg/g,分别是上茎、中茎和下茎的3.84倍、4.65倍和3.74倍,且达到极显著差异(p<0.01),但中叶及下叶之间达不到显著水平(p>0.05),说明叶部中总多酚的累积量远远高于茎中的累积量,且上部位多酚的累积量高于中部和下部中的累积量;上茎与中茎总多酚含量差异显著(p<0.05),下茎与中茎、上茎差异不显著(p>0.05),叶中总多酚的累积量远远高于茎中的累积量[16]。
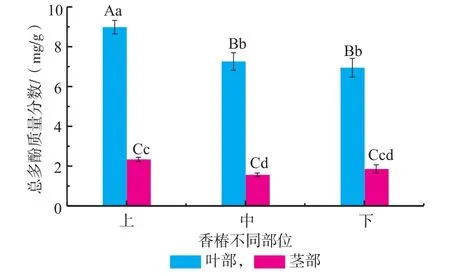
图1 香椿嫩芽不同部位总多酚含量Fig.1Total polyphenol content of different fractions in Toona Sinensis buds
2.1.2 红油香椿不同部位抗坏血酸(VC)含量红油香椿嫩芽不同部位抗坏血酸含量如图2所示,上叶、中叶及下叶中的抗坏血酸含量显示上叶>中叶>下叶,且存在极显著差异(p<0.01),同部位叶部抗坏血酸含量分别比茎部高78.20%、87.04%和85.96%,达到极显著水平(p<0.01),而茎部不同部位之间上茎与中茎、下茎存在显著差异(p>0.05)。说明抗坏血酸在叶部的累积量高于茎部,同时上叶及上茎中的累积量高于其它两部位,这与总多酚的累积趋势基本一致,可能是随着生长时间的延长,抗坏血酸分解的缘故。
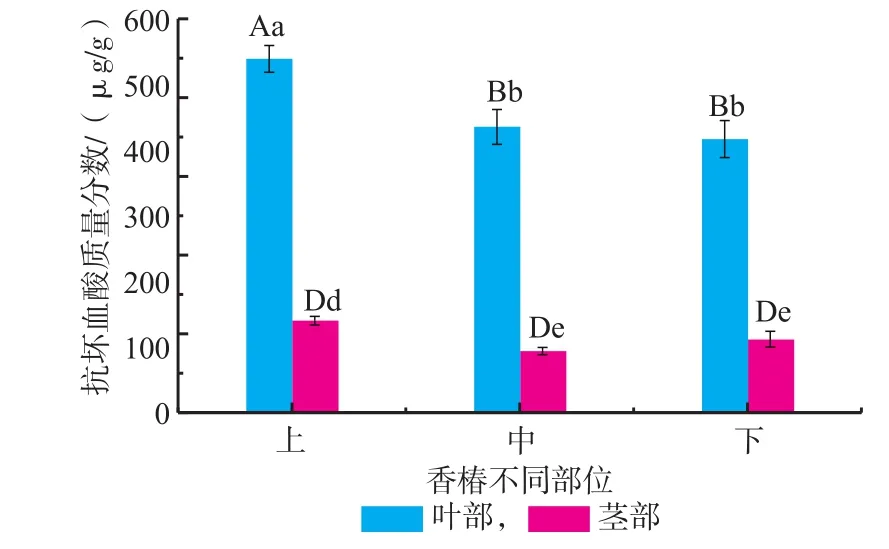
图2 香椿嫩芽不同部位抗坏血酸含量Fig.2Total ascorbic acid content of different fractions in Toona Sinensis buds
2.1.3 红油香椿嫩芽不同部位可溶性蛋白质含量由图3知,可溶性蛋白质在茎部中的含量高于叶部(p<0.01),茎的中部与下部差异不显著(p>0.01),但与上部存在显著差异(p<0.05);叶中不同部位可溶性蛋白质含量相当,不存在显著性差异(p>0.05)。
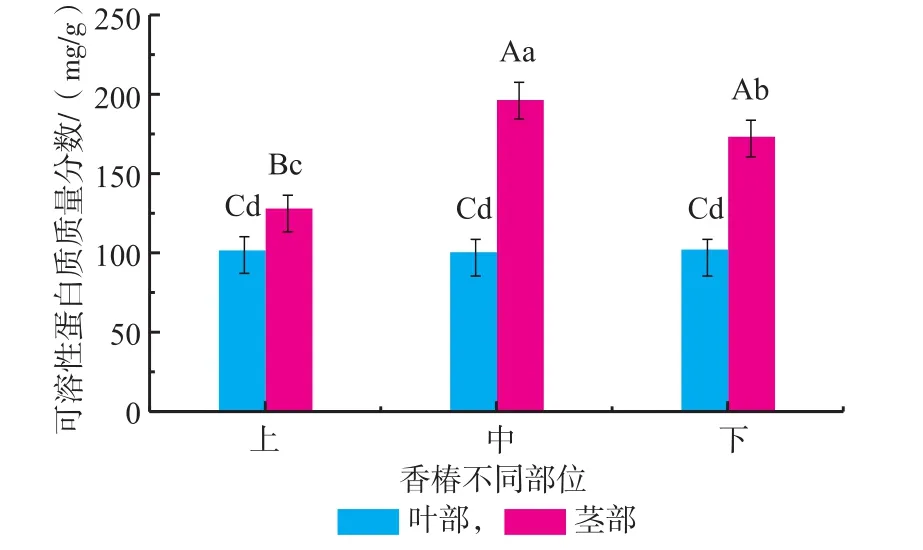
图3 香椿嫩芽不同部位可溶性蛋白质含量Fig.3Soluble protein content of different fractions in Toona Sinensis buds
2.1.4 红油香椿不同部位可溶性糖含量研究香椿嫩芽中糖类物质主要以两种形式存在:不溶的膳食纤维素和可溶性糖类,后者可以供人体消化吸收,故把它作为衡量香椿嫩芽品质的重要指标之一[7]。由图4知,香椿嫩芽叶中可溶性糖含量高于茎中,其中中叶部位可溶性糖类含量高达3.07 mg/g,其次是下叶部位为1.62 mg/g,均极显著高于其它部位(p<0.01),而其它部位之间差异不显著(p>0.01)。表明可溶性糖随着植物生长而不断累积,主要在叶部中存在,且在中部及下部中含量较高。
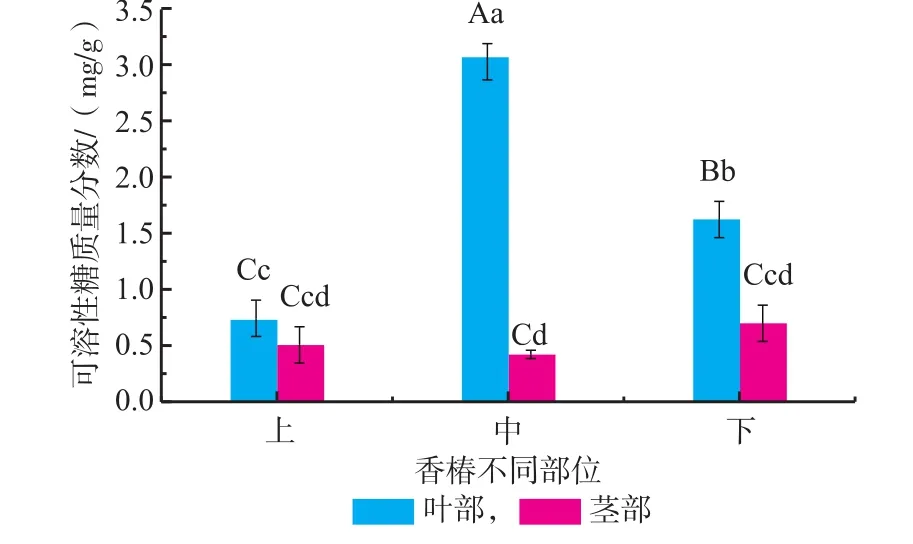
图4 不同部位对香椿可溶性糖含量的影响Fig.4Soluble saccharides content of different fractions in Toona Sinensis buds
2.1.5 红油香椿嫩芽不同部位叶绿素含量叶绿素是蔬菜中含有的绿色色素,其含量多少可用来鉴定蔬菜的新鲜程度,其变化还可作为绿色植物衰老的指标。由图5可知,叶中叶绿素含量远远高于茎中,且达到极显著水平(p<0.01),其中下叶中叶绿素含量最高为1.77 mg/g,分别比中叶、上叶高30%和327%;叶绿素在茎中不同部位的含量相当,无显著性差异(p<0.05)。香椿嫩芽叶部叶绿素含量从高到低依次为下部>中部>上部,且差异极显著。该现象可以从香椿嫩芽的外观上得到反映,香椿萌发时花青素含量较高,呈现为紫红色,而随着幼芽的长大、新叶的出现,刚开始萌发的嫩叶紫色逐渐变浅,颜色逐渐加深,即花青素含量逐渐下降,叶绿素含量逐渐升高,因而香椿上叶部最幼嫩的部位呈颜色紫红,而中部、下部往往为紫绿色或绿色。
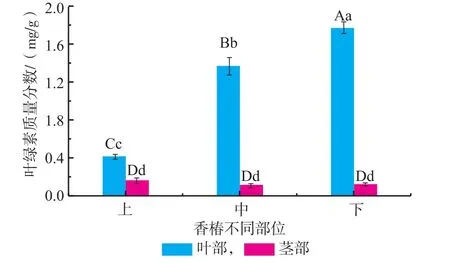
图5 不同部位对香椿叶绿素含量的影响Fig.5Chlorophyll content of different fractions in Toona Sinensis buds
2.1.6 红油香椿嫩芽不同部位黄酮含量由图6知,香椿叶中黄酮含量高于茎部。叶中不同部位黄酮含量从高到低依次为下部>中部>上部,且差异极显著(p<0.01);茎中下部黄酮含量高于上部和中部,差异极显著(p<0.01)。总体来讲,黄酮的累积与香椿生长期相关,生长期愈长,黄酮累积量愈多,故在下部含量较高,这与王昌禄报道的“黄酮在香椿老叶比嫩叶中含量较高”相吻合[8]。
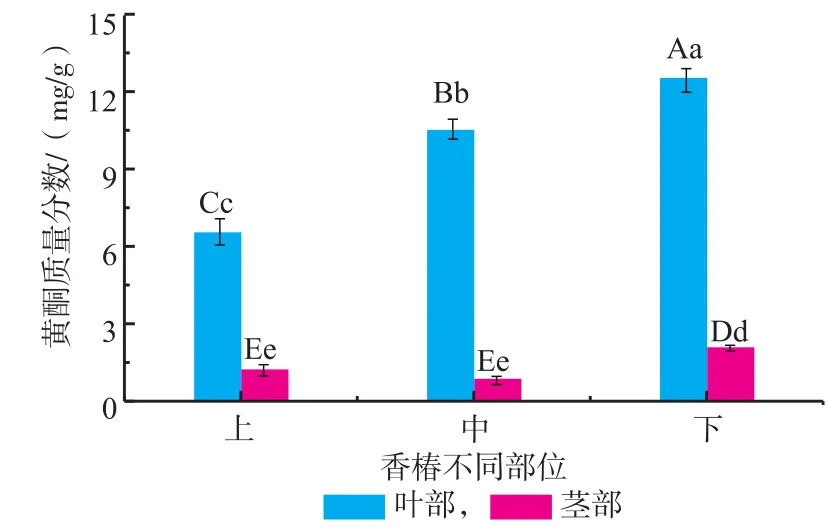
图6 不同部位对香椿黄酮含量的影响Fig.6Flavone content of different fractions in Toona Sinensis buds
2.1.7 红油香椿嫩芽不同部位亚硝酸盐含量由图7知,亚硝酸盐在茎部的含量高于叶部,其中在中茎部位含量最高,为13.65 μg/g,显著高于上部和下部(p<0.05),而叶中亚硝酸盐含量基本相当,无显著性差异(p>0.05),表明亚硝酸盐主要富集在茎部,极显著高于叶部(p<0.01),这与杨玉珍等人的研究结果一致[7]。
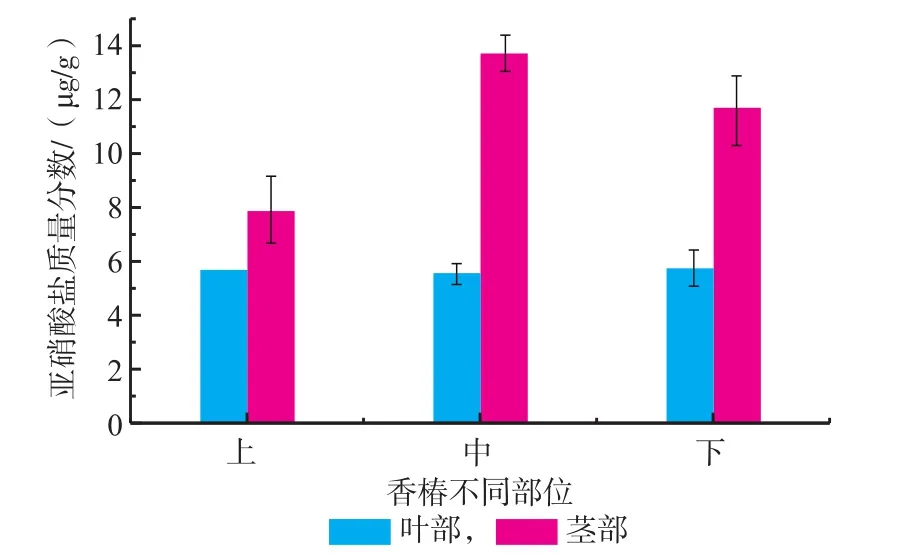
图7 不同部位对香椿亚硝酸盐含量的影响Fig.7Nitrite content of different fractions in Toona Sinensis buds
2.2 红油香椿嫩芽不同部位提取液体外抗氧化性
2.2.1 红油香椿嫩芽不同部位提取液清除·OH能力香椿清除·OH能力的大小与提取液质量浓度、不同部位关系密切,如图8所示。随着香椿提取液浓度的增加,清除·OH能力逐渐升高。统计分析表明(表1),不同质量浓度提取液清除·OH能力的差异极显著,香椿嫩芽部位不同其清除·OH能力也有所差异,其半数抑制质量浓度IC50:上叶3.0 mg/mL,中叶6.72 mg/mL,下叶7.03 mg/mL;上茎5.84 mg/mL,中茎5.58 mg/mL,下茎5.53 mg/mL。表明抗氧化物质在香椿不同部位累积量不同,上叶累积最多,清除率最高,且当提取液质量浓度为7 mg/mL时,清除率高达89%,随后清除率趋于平衡。
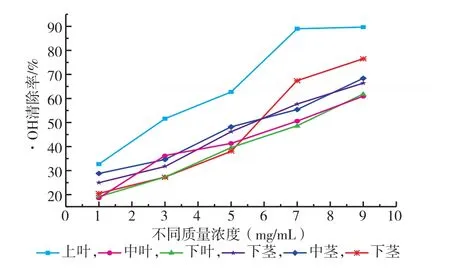
图8 香椿不同部位提取液清除·OH的能力Fig.8The activity of scanvaging·OH of extracts of different fractions in Toona Sinensis buds
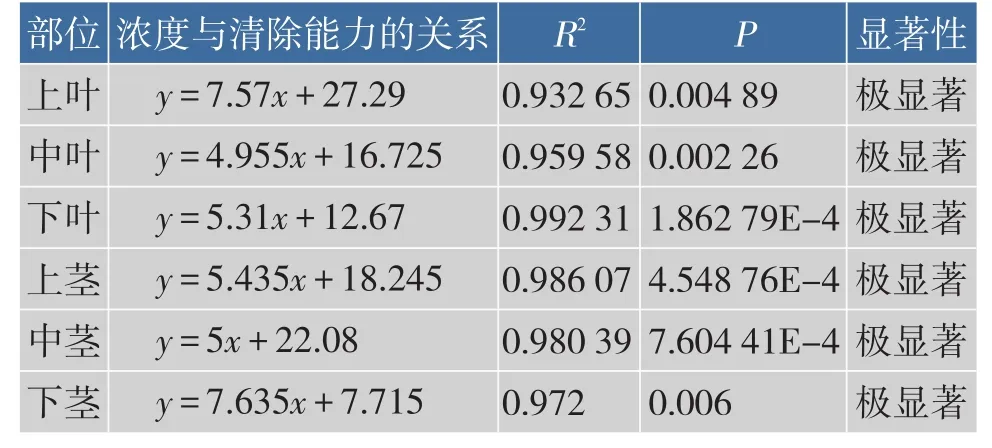
表1 香椿各部位不同质量浓度提取液清除·OH能力的统计分析结果Table 1Analysis of scanvaging·OH activity of extracts of different fractions in Toona Sinensis buds
2.2.2 红油香椿嫩芽不同部位提取液清除DPPH·能力香椿清除DPPH·的能力与香椿提取液质量浓度、不同部位的关系如图9所示,随着香椿提取液质量浓度的增大,清除DPPH·能力逐渐升高[16-17]。
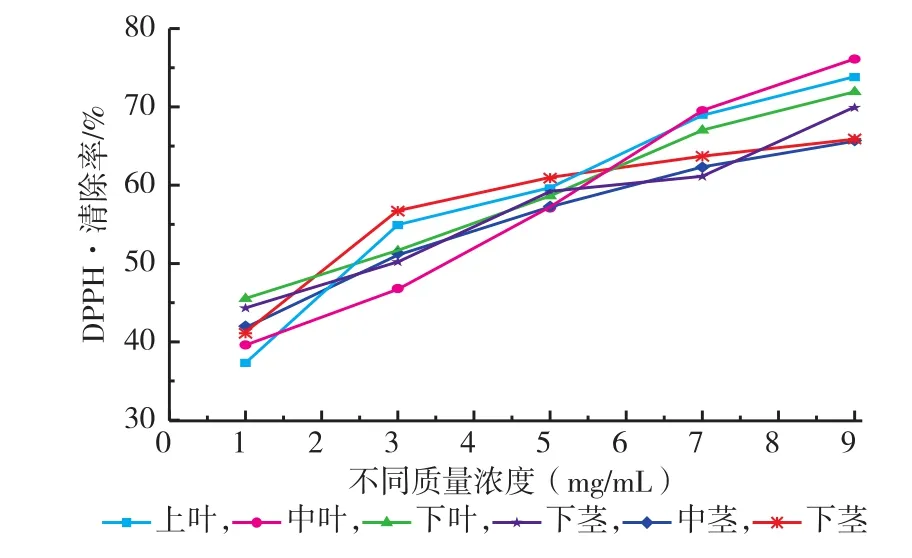
图9 香椿不同部位提取液清除DPPH·的能力Fig.9The activity of scanvaging DPPH·of extracts of different fractions in Toona Sinensis buds
香椿各部位不同质量浓度提取液清除DPPH·能力的统计分析结果见表2,除下茎外,香椿各部位不同质量浓度提取液清除DPPH·能力的差异极显著。
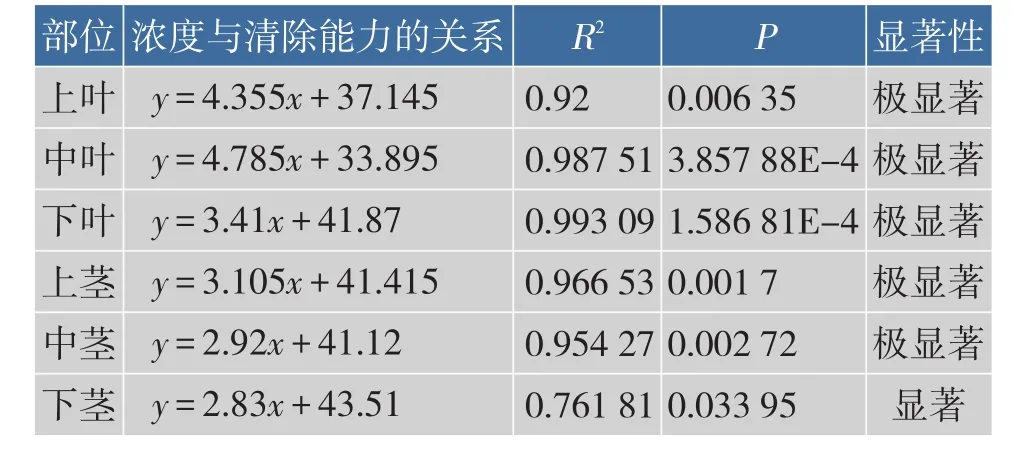
表2 香椿各部位不同质量浓度提取液清除DPPH·能力的统计分析结果Table 2Analysis of scanvaging DPPH·activity of extracts of different fractions in Toona Sinensis buds
由香椿各部位半数抑制质量浓度可知,中叶(3.37 mg/mL)>中茎(3.04 mg/mL)>上叶(2.95 mg/ mL)>上茎(2.76 mg/mL)>下叶(2.38 mg/mL)>下茎(2.29 mg/mL),IC50整体在2.29~3.37 mg/mL之间变化,表明香椿嫩芽中部对DPPH·的清除能力最高,其次是上部,最后是下部,同时相同部位叶部对DPPH·的清除能力高于茎部。
2.2.3 红油香椿嫩芽不同部位提取液总还原力研究由图8示,随着香椿提取液浓度的增加,其总还原力逐渐升高。由香椿各部位不同浓度提取液总还原力的统计分析结果见表3所示,香椿各部位不同浓度提取液总还原力差异极显著。香椿部位不同,其总还原能力也不同,总体来说,叶部还原能力高于茎部,且上叶>中叶>下叶,在茎部,下茎>中茎>上茎,说明活性物质在香椿各部位的积累量不同。
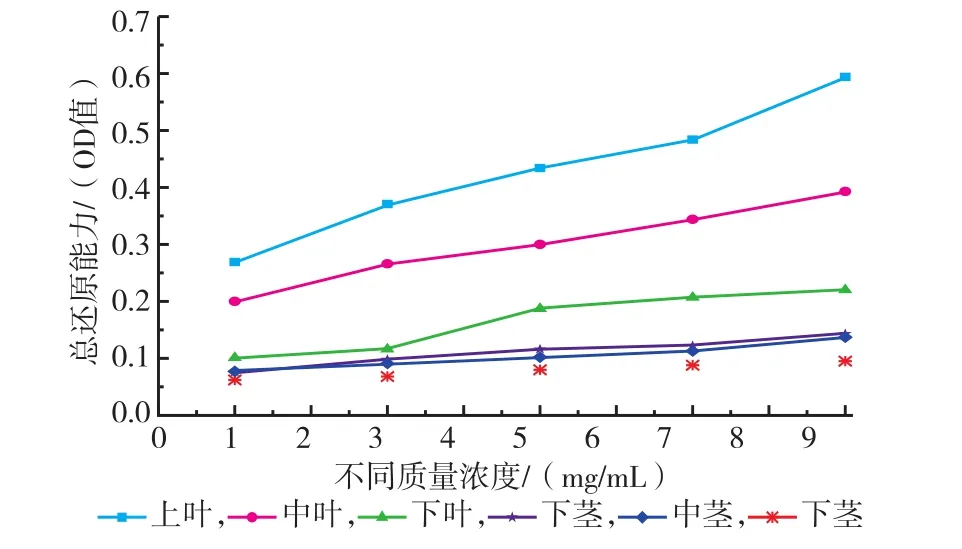
图10 香椿不同部位提取液的总还原力Fig.10The total reducing power of extracts of different fractions in Toona Sinensis buds
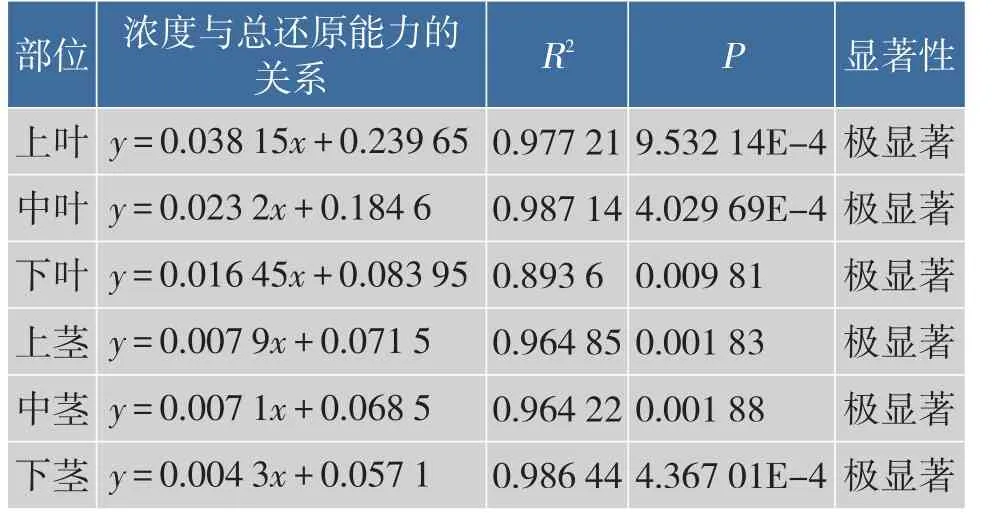
表3 香椿各部位不同质量浓度提取液总还原力的统计分析结果Table 3Analysis of the total reducing power of extracts of different fractions in Toona Sinensis buds
3 讨论
在食品安全与健康问题成为当前国内外日益关注焦点的背景下,香椿以绿色、营养、保健等优点迎合了现代人追求健康饮食时尚的新潮流,深受国内外民众的喜爱。然而对于香椿不同的组织部位,即使是同一品种,其营养成分、活性物质及亚硝酸盐等富集规律也随时发生着变化。试验结果表明,总多酚、VC、可溶性糖、叶绿素及黄酮在叶中的含量均极显著高于茎中(p<0.01),其中总多酚及VC主要富集在上叶,可溶性糖在中叶中含量最高,叶绿素及黄酮均随着生长期的延长逐渐增加,且下叶>中叶>上叶。相反的,可溶性蛋白质及亚硝酸盐在茎中的含量高于叶中,均呈“中茎>下茎>上茎”的趋势,而在叶中差别不大。同时,香椿中富含的黄酮、多酚和皂苷等物质具有较高的抗氧化活性[18-19]。对香椿嫩芽不同组织部位的抗氧化活性研究表明,活性物质等在不同的组织部位的累积量也不同,其中上叶清除·OH能力及总还原能力最高。当其质量浓度达到7 mg/mL时,清除·OH率高达89%,远远高于其它部位的。香椿叶部的总还原力高于茎部的。香椿嫩芽整体对DPPH·的清除能力差别不大,IC50浮动范围在2.29~3.37 mg/mL之间。
综合分析,香椿嫩芽上部的抗氧化能力最好,且叶中的活性物质比茎中的要高。
4 结语
对香椿嫩芽不同部位的营养成分、亚硝酸盐及抗氧化活性进行研究,有利于充分利用香椿嫩芽不同部位,为香椿嫩叶规模化加工提供更合理、科学的理论依据,充分提高农林产物的深加工价值。如叶中总多酚、VC、可溶性糖及黄酮含量较高,可利用嫩叶部分加工成各种产品,如香椿菜、香椿酱和香椿茶等产品,也可用于提取活性成分,制成功能性药品。但是香椿嫩芽的亚硝酸盐质量分数远高于国标中对绿叶蔬菜亚硝酸盐的限定(4 mg/kg),因此加工时需要烫漂,以降低亚硝酸盐含量。
[1]何丹.8个种源香椿的营养动态变化分析[D].武汉,华中农业大学园林植物与观赏园艺学院,2006.
[2]田迪英,杨荣华.香椿的抗菌作用研究[J].食品工业科技,2002,23(11):21-22.
TIAN Diying,YANG Ronghwa.Toona sinensis antibacterial action research[J].Journal of Food Industry Science and Technology,2002,23(11):21-22.(in Chinese)
[3]Chang H L,Hsu H K,Su J H,et al.The fractionated<i>Toona sinensis</i>leaf extract induces apoptosis of human ovarian cancer cells and inhibits tumor growth in a murine xenograft model[J].Gynecologic Oncology,2006,102:309-314.
[4]Chang,H C,Hung W C,Huang M S,et al.Extract from the leaves of Toona sinensis roemor exerts potent antiproliferative effect on human lung cancer cells[J].The American Journal of Chinese Medicine,2002,30:307-314.
[5]Hsieh T J,Tsai Y H,Liao M C,et al.Anti-diabetic properties of non-polar Toona sinensis Roem extract prepared by supercritical CO2fluid[J].Food and Chemical Toxicology,2012,50:779-789.
[6]Hsieh T J,Liu T Z,Chia Y C,et al.Protective effect of methyl gallate from<i>Toona sinensis</i>(Meliaceae)against hydrogen peroxide-induced oxidative stress and DNA damage in MDCK cells[J].Food and Chemical Toxicology,2004,42:843-850.
[7]杨玉珍,彭方仁,李洪岩.不同种源香椿芽菜营养成分的变化研究[J].河南农业科学,2007(4):83-85.
YANG Yuzhen,PENG Fangren,LI Hongyan.Changes of nutrition ingredient of different provenance Toona Sinensis[J].Journal of Henan Agricultural Science,2007(4):83-85.(in Chinese)
[8]王昌禄,江慎华,陈志强,等.香椿老叶中活性物质提取及其抗氧化活性的研究[J].农业工程学报,2007,23(10):229-234.
WANG Changlu,JIANG Shenhua,CHEN Zhiqiang,et al.Study on extraction of active substances and antioxidant activity of Toona Sinensis old leaves[J].Journal of Agricultural Engineering,2007,23(10):229-234.(in Chinese)
[9]WANG Kaijin,YANG Chongren,ZHANG Yingjun.Phenolic antioxidants from Chinese toon(fresh young leaves and shoots of Toona sinensis)[J].Food Chemistry,2007,101(1):365-371.
[10]GAO Mengsha,FENG Lifang,JIANG Tianjia.Browning inhibition and quality preservation of button mushroom(Agaricus bisporus)by essential oils fumigation treatment[J].Food Chemistry,2014,149(15):107-113.
[11]王赵改,杨慧,李靖,等.采收期对不同品种双孢蘑菇品质的影响[J].河南农业科学,2012,41(7):107-110,127.
WANG Zhaogai,YANG Hui,LI Jing,et al.Effect of harvest time on the different breed abisporus garicus quality[J].Journal of Henan Agricultural Science,2012,41(7):107-110,127.(in Chinese)
[12]赵世杰,刘华山,董新纯,等.植物生理学实验指导[M].北京:中国农业出版社,1998.
[13]张香美,赵凤存,李慧荔,等.小根蒜提取物对香椿保鲜效果的影响[J].中国农学通报,2009,25(4):55-58.
ZHANG Xiangmei,ZHAO Fengcun,LI Huili,et al.Effects of small root garlic extract on the Toona Sinensis fresh keeping[J]. China Agriculture Bulletin,2009,25(4):55-58.(in Chinese)
[14]Hsu C L,Chen W L,Weng Y M,et al.Chemical composition,physical properties,and antioxidant activities of yam flours as affected by different drying methods[J].Food Chemistry,2003,83:85-92.
[15]JIANG Shenhua,WANG Changlu,CHEN Zhiqiang.Antioxidant properties of the extract and subfractions from old leaves of Toona Sinensis roem(Meliaceae)[J].Journal of Food Biochemistry,2009,33:425-441.
[16]YANG Ying,WANG Jun,XING Zhien,et al.Identication of phenolics in Chinese toon and analysis of their content changes during storage[J].Food Chemistry,2011,128:831-838.
[17]芦艳,鲁周民,樊美丽.枇杷花不同花期醇提物抗氧化活性的比较[J].现代食品科技,2013,29(9):2141-2146.
LU Yan,LU Zhoumin,FAN Meili.Comparison of alcohol extract antioxidant activity of different flowering Loquat flower[J]. Journal of Modern Food Science and Technology,2013,29(9):2141-2146.(in Chinese)
[18]WANG Kaijin,YANG Chongren,ZHANG Yingjun.Phenolic antioxidants from Chinese toon(fresh young leaves and shoots of Toona sinensis)[J].Food Chemistry,2007,101:365-371.
[19]Li H B,Wong C C,Cheng K W,et al.Antioxidant properties in vitro and total phenolic contents in methanol extracts from medicinal plants[J].LWT-Food Science and Technology,2008,41:385-390.
Effects of Different Parts on Quality and Vitro Antioxidation Activity of Extracts from Toona sinensis
WANG Zhaogai1,*,YANG Hui1,CHEN Lijuan1,LIANG Wanping2,ZHANG Le1
(1.Institute of Agricultural Products Processing,Henan Academy of Agricultural Sciences,Zhengzhou 450008,China;2.Institute of Resources and Environment,Zhumadian Academy of Agricultural Sciences,Zhumadian 463000,China)
In order to make full use of resource of Toona sinensis and provide theoretical basis for the development and processing,the quality and vitro antioxidation activity of different parts(upper,middle,bottom)of Toona Sinensis immature leaves and stems were studied.The qualities include total polyphenol,Vc,soluble saccharide,chlorophyll,flavonoid,soluble protein and nitrite.Quality analysis showed that contents in leaves were significantly higher than that of in stems(p<0.01)except for soluble proteins and nitrites.Total polyphenols and Vc were mainly concentrated in the upper leaves,soluble saccharide content was the highest in the middle leaves,chlorophyll and flavonoids existed in the bottom leaves.Analysis of composition contents was no difference in stem.Antioxidant activity showed that scavenging hydroxyl free radical and total reduction power of leaves were far higher thanthat of in stems.Activities of scavenging hydroxyl free radical and total reduction power were strongest in upper leaves.There was little difference in scavenging DPPH·,ranging from 2.29 to 3.37.
Different parts of Toona sinensis,Quality,Vitro Antioxidation Activity
S644.4
A
1673—1689(2015)06—0646—07
2014-06-19
河南省财政预算项目(20148010);河南省科技成果推广示范项目
王赵改(1980—),女,河南驻马店人,理学博士,副研究员,主要从事农产品保鲜与加工研究,E-mail:zgwang1999@126.com

