发酵灵芝胞外多糖硫酸化修饰
沈洁,刘昱均,张珏
(1.江南大学化学与材料工程学院,江苏无锡 214122;2.卫生部核医学重点实验室,江苏省原子医学研究所,江苏无锡 214063)
发酵灵芝胞外多糖硫酸化修饰
沈洁1,刘昱均1,张珏*2
(1.江南大学化学与材料工程学院,江苏无锡 214122;2.卫生部核医学重点实验室,江苏省原子医学研究所,江苏无锡 214063)
发酵灵芝胞外多糖表现出微弱的抗肿瘤活性,硫酸化是改善多糖抑癌活性的重要途径,而多糖的硫酸化取代度与其生物活性密切相关。为了了解硫酸化取代度与硫酸化条件之间的关系,以获取不同取代度的产品,对发酵灵芝胞外多糖的硫酸化试剂以及硫酸化反应条件与取代度之间的关系进行了较深入研究。实验结果表明,氨基磺酸比氯磺酸的硫酸化过程更加缓和,尿素的加入也有利于缓和反应条件,提高取代度。
灵芝;多糖;硫酸化
灵芝具有扶正固本、滋补强壮、延年益寿等功效[1]。随着发酵技术的成熟,灵芝的深层发酵技术丰富了灵芝资源,可以定向获取有效成分[2]。灵芝多糖为灵芝的重要成分之一,具有抗肿瘤[3-5]、抗病毒[6]、抗氧化[7-9]和提高免疫调节[10-12]等多种生物活性。但是和灵芝子实体多糖类似,灵芝胞外多糖的抗癌活性很低甚至没有抗癌活性;而多糖的化学修饰尤其是硫酸化修饰已成为多糖活性提高的重要途径[9,13-21]。多糖的糖羟基被硫酸基团取代后不仅提高了多糖的水溶性,而且由于硫酸基团空间位阻和电荷排斥效应导致糖链的屈伸度增强,甚至使糖链在局部区域形成螺旋结构[16],从而提高了多糖的生物活性。硫酸化灵芝胞外多糖具有很好的抑制肝癌细胞的能力[24],因此有必要了解取代度和硫酸化反应条件之间的对应关系。目前大多数研究对来源于子实体的灵芝多糖进行硫酸化改性[10,25-26],对发酵法获取灵芝多糖的硫酸化修饰的研究相对较少[24]。本文作者研究了发酵灵芝胞外多糖硫酸化修饰,并在文中探讨了各种因素对取代度的影响。
1 材料与方法
1.1 材料与仪器
发酵灵芝胞外多糖,由江南大学食品科学与技术国家重点实验室提供。无水硫酸钠、N,N-二甲基甲酰胺、苯酚、吡啶、浓硫酸、乙醇、氯化钡、氢氧化钠、甲酰胺、氨基磺酸(AR),均由国药集团化学试剂有限公司提供;明胶(BS),Amresco生物科技有限公司产品;氯磺酸(CP),上海金山亭化工试剂厂产品。
T-6型紫外分光光度计,普析通用仪器有限责任公司制造;透析袋(截留分子量3 500 Da),美国Viskase公司制品;EZ585Q冷冻干燥机,美国FTS System公司制造;MB104型红外光谱仪,ABB Bomem制造;Waters 600型高效液相色谱仪,美国Waters公司制造;2410型示差折光检测器,美国Waters公司制造;Empower工作站,美国Empower公司产品。
1.2 方法
1.2.1 发酵灵芝胞外多糖硫酸化修饰将一定量的灵芝胞外多糖加入装有DMF的三口烧瓶中,室温下搅拌30 min。待温度升至反应所需温度后缓慢加入硫酸化试剂。反应结束后迅速将烧瓶置于冰水浴中,反应液用4 mol/L NaOH调节pH至7后用体积分数90%乙醇沉淀,离心取沉淀。沉淀先用体积分数90%乙醇洗涤,再用去离子水复溶,用流水透析24 h。透析袋内液体冷冻干燥后即得灵芝胞外硫酸化多糖。产物红外吸收光谱见图1。硫酸酯化胞外多糖(GIP-SA)除保留母体多糖的特征吸收峰外,增加了两个新吸收分峰,1 263.44 cm-1和815.64 cm-1,分别为S—O的伸缩振动峰和C—O—S的拉伸振动,说明灵芝胞外多糖的糖链上已引入了硫酸酯基。
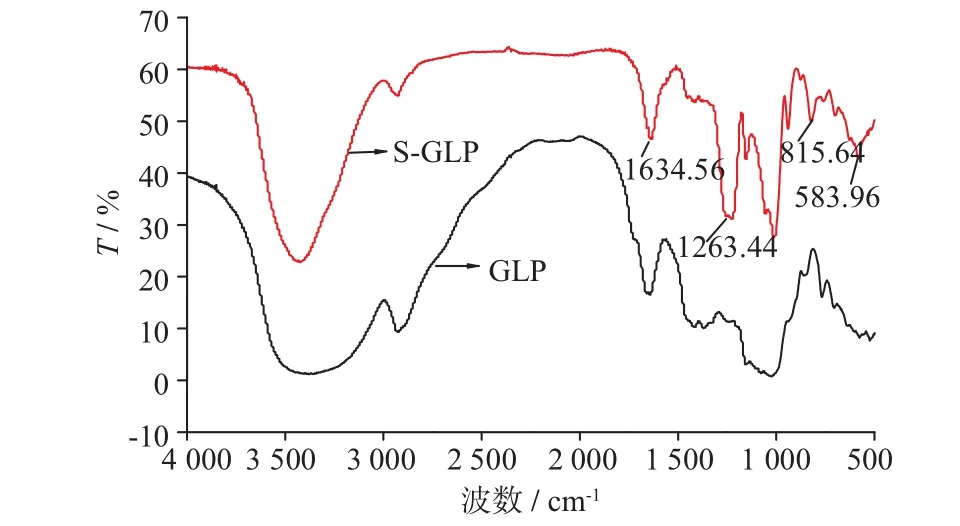
图1 胞外多糖(GLP)及其硫酸酯化产物(S-GLP)的红外吸收光谱Fig.1Infraraed Spectrum of GLP and S-GLP
1.2.2 取代度测定采用BaCl2-明胶浊度法[27],取代度(DS)计算公式:

式中S为含硫率(质量分数)。
1.2.3 红外光谱分析取3 mg左右冷冻干燥后的灵芝多糖,与1 g溴化钾碾细混匀后压片,使用MB104型红外分光光度仪,测定的红外光谱波长范围为500~4 000 cm-1。
1.2.4 相对分子质量测定色谱柱:Ultrahydrogel™Linear 300 mm×7.8 mmid×2;流动相:0.1 mol/L NaNO3;体积流量0.9 mL/min,柱温45℃。样品制备:样品溶解于流动相中,用微孔过滤膜过滤后进样。
2 结果与讨论
2.1 硫酸酯化试剂的筛选
硫酸基团的引入量对多糖的活性有重要影响,而硫酸化试剂对反应有一定的影响。以实验分别考察了氯磺酸和氨基磺酸对取代度(DS)的影响。
从图2可看出,氯磺酸和氨基磺酸在各自最佳反应温度下的取代水平相似,但氨基磺酸对反应温度的响应更为宽泛。相比用氯磺酸合成的硫酸酯化灵芝多糖,氨基磺酸法合成的硫酸酯化灵芝多糖色泽较浅,反应过程温和。
2.2 不同溶剂的筛选
多糖的硫酸酯化反应可以看做双分子亲核取代反应,其反应速率与底物浓度和试剂的亲核能力有关。不同极性的溶剂对硫酸酯化的影响不同。选取吡啶、二甲基甲酰胺、甲酰胺3种常用的强极性、强亲核试剂为溶剂,考察了其在不同硫酸酯化试剂中的酯化效果(图3)。
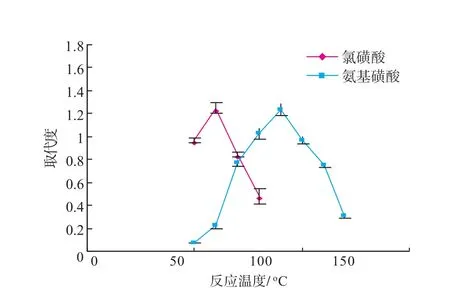
图2 硫酸酯化试剂的筛选Fig.2Screen of sulfuric acid esterification reagent.
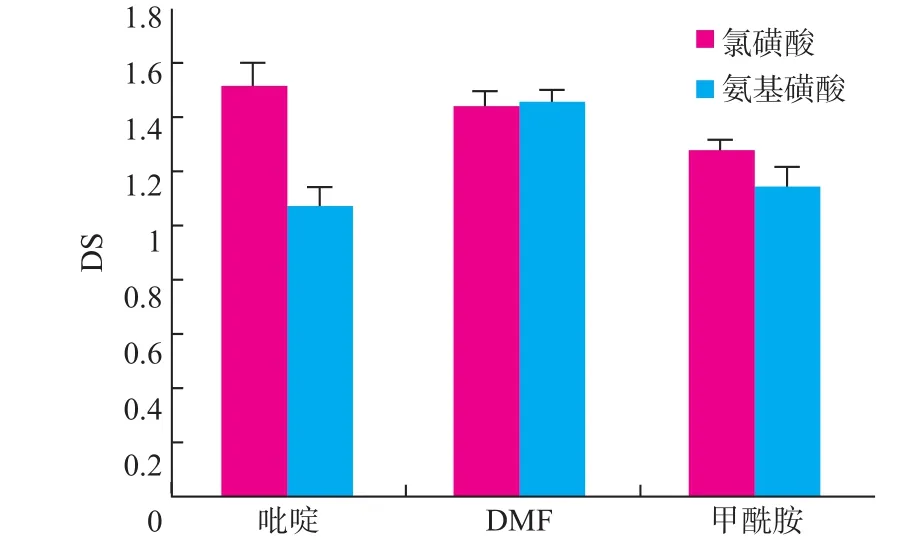
图3 硫酸酯化溶剂的筛选Fig.3Selection of solvent.
从溶剂极性考虑,吡啶的极性最强,但其沸点也最低,溶解氨基磺酸的效果也较差,多糖在吡啶中的溶解度也不高,溶剂和多糖的体积质量比50∶1(mL/g)的条件下不能完全溶解多糖。但吡啶与氯磺酸能发生络合,使得氯磺酸在酯化过程中不至于放热过快。与之相类似的是二甲基甲酰胺,因而以氯磺酸为硫酸酯化试剂的反应过程中以吡啶为溶剂和以二甲基甲酰胺为溶剂的效果差别不大。甲酰胺极性最小,对灵芝多糖的溶解性也较差,导致取代度较低。以氨基磺酸为硫酸酯化试剂,需要90℃的反应温度,并且氨基磺酸的活性较低,使得固液反应更加困难,因而选用对灵芝多糖和氨基磺酸溶解性都较好的二甲基甲酰胺为溶剂的效果更理想。
2.3 多糖硫酸酯的单因素考察
2.3.1 单糖残基与硫酸化试剂的摩尔比对取代度的影响随着硫酸酯化试剂用量与多糖的比例提高,将有利于取代度的增加;但过多的硫酸酯化试剂也会降低系统的pH,进而容易发生多糖的降解反应。多糖的单糖残基与硫酸酯化试剂的摩尔比对取代度的影响见图4。
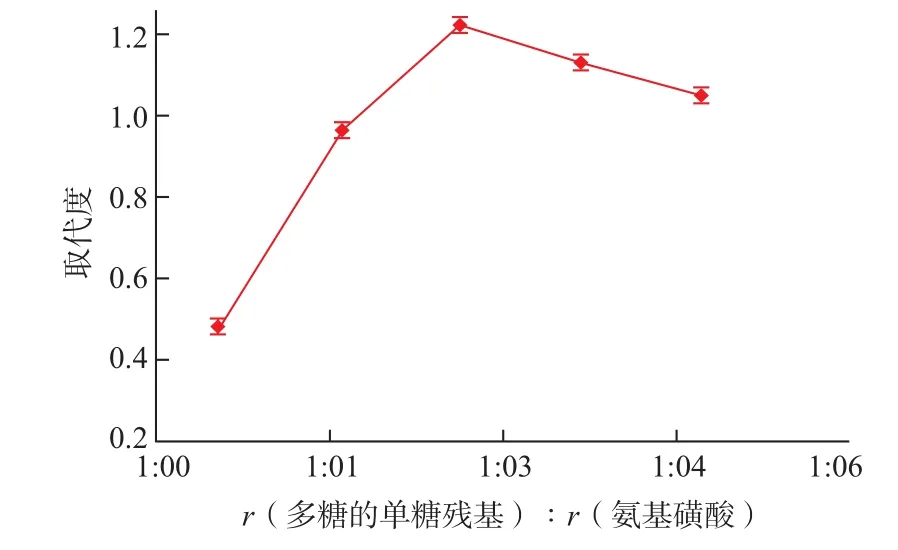
图4 单糖残基与硫酸化试剂的摩尔比对硫酸酯化灵芝胞外多糖取代度的影响。Fig.4Effect of molar ratio of sulfamic acid to sugar unit on DS.
由图4可知,当多糖的单糖残基与硫酸酯化试剂的摩尔比超过1∶3后,多糖的取代度有所降低,可能是过量的氨基磺酸酸性过强,使得部分氨基磺酸作用于多糖的糖链上使得多糖降解。由此考虑多糖的单糖残基与氨基磺酸的摩尔比为1∶3为最适单糖残基与硫酸化试剂的摩尔比。
2.3.2 溶剂和多糖的体积质量比对取代度的影响溶剂的多少不仅影响反应底物的浓度,也决定了体系中溶解底物的量。室温下多糖在无水有机溶剂中的溶解度都不大,但在90℃下二甲基甲酰胺溶剂中,多糖具有较好的溶解性;而90℃下,氨基磺酸在二甲基甲酰胺中的溶解性较好。溶剂和多糖的体积质量比对灵芝胞外多糖硫酸酯化取代度的影响见图5。当溶剂和多糖的体积质量比小于50∶1(mL/g)时,多糖在二甲基甲酰胺溶剂中无法完全溶解,反应体系为液—液反应和固—液反应,反应物之间不能充分接触;当溶剂完全溶解多糖后,进一步增加溶剂的量反而使得灵芝胞外多糖硫酸酯化取代度降低,这是由于反应物浓度变小使得底物间碰撞概率降低,也不利于获得高取代度的硫酸酯化胞外多糖。
由图5可见,二甲基甲酰胺与灵芝多糖的体积质量比为50∶1(mL/g)较合理。
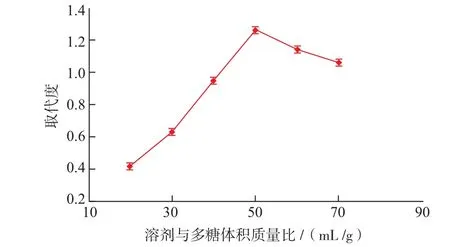
图5 溶剂和多糖的体积质量比对硫酸酯化灵芝胞外多糖取代度的影响.Fig.5Effect of ratio of DMF to sugar unit(V/m)on DS.
2.3.3 反应时间对取代度的影响硫酸酯化反应是一个可逆反应,随着时间的延长,体系会达到热力学平衡。硫酸酯化多糖的时间进程见图6。

图6 反应时间对灵芝胞外多糖硫酸酯化取代度的影响。Fig.6Effect of reaction time on DS.
由图6可知,当反应时间为2.5 h时,取代度达到1.34。当反应时间继续延长,取代度并没有明显增加,并可能伴随降解反应。故最佳的反应时间定为2.5 h。
2.3.4 硫酸化调节剂对取代度的影响由于氨基磺酸的反应活性低,早期就有学者将硫酸化调节剂引入氨基磺酸参加的合成反应过程中。国内外文献报道的硫酸化调节剂类型往往是含有氮元素的氨、胺、酞胺类化合物,如尿素、硫脲、氧化胺等,可以起到平缓硫酸化、减少多糖降解的作用。根据文献报道的硫酸化调节剂类型,选取了尿素、硫脲、氧化胺3种硫酸化调节剂,考察其在多糖硫酸酯化过程中的催化效果。选取的反应条件为:氨基磺酸的反应温度为90℃,单糖残基与硫酸化试剂的摩尔比r(多糖的单糖残基)∶r(氨基磺酸)=1∶3,溶剂和多糖的体积质量比为50∶1(mL/g),反应时间为2 h。图7表明,尿素的催化效果较好,考虑到成本上较其它两种物质低很多,故选用尿素为硫酸化调节剂。
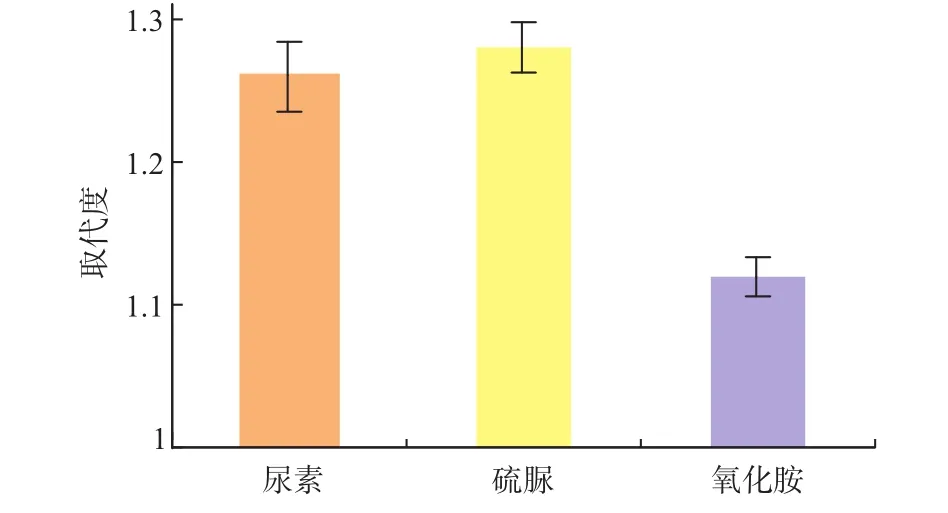
图7 硫酸化调节剂对灵芝胞外多糖硫酸酯化取代度的影响Fig.7Effect of regulator on DS
尿素加入量对灵芝胞外多糖硫酸酯化取代度的影响见图8。
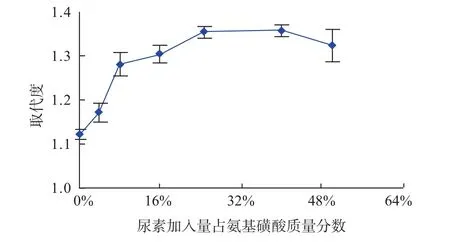
图8 尿素加入量对灵芝胞外多糖硫酸酯化取代度的影响。Fig.8Effect of weight ratio of urea to sulfamic acid on DS.
由图8可知,尿素加入量占氨基磺酸质量分数为25%时,硫酸酯化多糖的取代度最高,再增加尿素的量不能明显提高硫酸酯化多糖的取代度。考虑到后续产物处理,故选择尿素的加入量与氨基磺酸摩尔比为1∶6.4。
2.4 灵芝胞外多糖及其硫酸酯化衍生物的相对分子质量
硫酸酯化胞外多糖的相对分子质量显著增加,胞外多糖硫酸酯化前后Mw/Mn增大,说明硫酸酯化后多糖衍生物的相对分子质量分布更分散。由于小分子量多糖在氨基磺酸作用下更容易水解为小分子物质,使得Mw/Mn增大。如图9和表1所示。
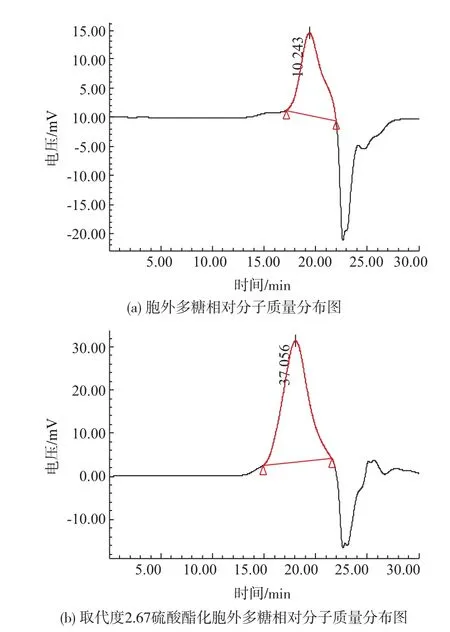
图9 硫酸酯化前后多糖相对分子质量的变化Fig.9Molecular weight changes after sulfated esterification
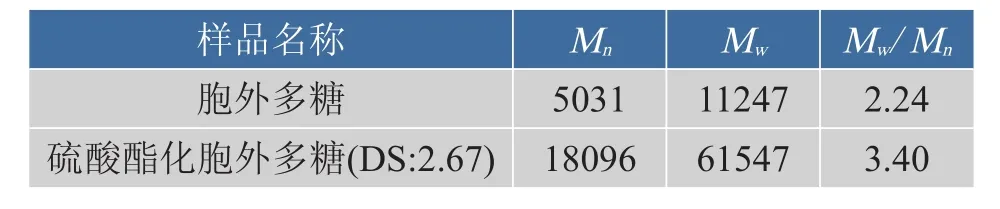
表1 灵芝胞外多糖硫酸酯化改性前后相对分子质量变化Table.1Molecular weight changes after sulfatedesterification of Ganoderma lucidum polysaccharide
3 结语
对发酵灵芝多糖进行硫酸化修饰并探讨了硫酸化反应条件与取代度之间的关系。分别采用氨基磺酸和氯磺酸为硫酸化酯化试剂,结果表明这两种酯化剂在各自最佳条件下有相似的取代度,氨基磺酸使反应更加温和。与吡啶、甲酰胺这两种溶剂相比,二甲基甲酰胺对反应物的溶解性较好而使反应有最高的取代度。此外,考察了各种因素对取代度的影响。单糖残基与氨基磺酸的最佳摩尔比为3∶1,过量的氨基磺酸导致多糖降解,不利于反应进行;溶剂和多糖的体积质量比为50∶1(mL/g)时利于反应物溶解并使它们相互间充分接触以提高取代度;反应时间为2.5 h时反应体系达到热力学平衡,从而取代度最高。将尿素作为硫酸化调节剂,其加入量为氨基磺酸质量的25%(质量分数)时能明显提高取代度。
[1]林志彬.灵芝的现代研究[M].北京:北京医科大学-中国协和医科大学出版社,1996:113.
[2]Liu G Q,Wang X L,Han W,et al.Improving the fermentation production of the individual key triterpene ganoderic acid Me by the medicinal fungus ganoderma lucidum in submerged culture[J].Molecules,2012,17(11):12575-12586.
[3]Zong A Z,Cao H Z,Wang F S.Anticancer polysaccharides from natural resources:A review of recent research[J].Carbohydrate Polymers,2012,90(4):1395-1410.
[4]Wang J G,Zhang L.Structure and chain conformation of five water-soluble derivatives of a beta-D-glucan isolated from Ganoderma lucidum[J].Carbohydrate Research,2009,344(1):105-112.
[5]Chen L D,Xu Z T,Chen X U,et al.Ganoderma lucidum Polysaccharides:Immunomodulation and potential Anti-Tumor activities[J].American Journal of Chinese Medicine,2011,39(1):15-27.
[6]Yang L Q,Zhang L M.Chemical structural and chain conformational characterization of some bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76(3):349-361.
[7]Wang J G,Wang Y T,Liu X B,et al.Free radical scavenging and immunomodulatory activities of Ganoderma lucidum polysaccharides derivatives[J].Carbohydrate Polymers,2013,91(1):33-38.
[8]Fan L P,Li J W,Deng K Q,et al.Effects of drying methods on the antioxidant activities of polysaccharides extracted from Ganoderma lucidum[J].Carbohydrate Polymers,2012,87(2):1849-1854.
[9]Feng Y L,Li W Q,Wu X Q,et al.Rapid and efficient microwave-assisted sulfate modification of lentinan and its antioxidant and antiproliferative activities in vitro[J].Carbohydrate Polymers,2010,82(3):605-612.
[10]Ye L B,Zhang J S,Zhou K,et al.Purification,NMR study and immunostimulating property of a fucogalactan from the fruitingbodies of ganoderma lucidum[J].Planta Medica,2008,74(14):1730-1734.
[11]Juan H F,Cheng K C,Huang H C,et al.Ganoderma lucidum polysaccharides in human monocytic leukemia cells:from gene expression to network construction[J].Bmc Genomics,2007(8):1.
[12]Jiao L L,Jiang P,Zhang L P,et al.Antitumor and immunomodulating activity of polysaccharides from enteromorpha intestinalis[J]. Biotechnology and Bioprocess Engineering,2010,15(3):421-428.
[13]Tao Y Z,Zhang L,Cheung P C K.Physicochemical properties and antitumor activities of water-soluble native and sulfated hyperbranched mushroom polysaccharides[J].Carbohydrate Research,2006,341(13):2261-2269.
[14]吴琼,代永刚,陈丽娜.碱溶性银耳多糖硫酸酯化的研究[J].食品研究与开发,2010,31(12):71-73.
WU Qiong,DAI Yonggang,CHEN Lina.Sulfated of alkai soluble tremella polysaccharide from tremella fuciformis[J].Food Reserch and Devlopment,2010,31(12):71-73.(in Chinese)
[15]刘燕琼,黄雪松.硫酸化大蒜多糖的制备及其鉴定[J].食品科学,2007,28(2):91-94.
LIU Yanqiong,HUANG Xuesong.Preparation sulfated galic polysaccharide and identification by spectrum[J].Food Science,2007,28(2):91-94.(in Chinese)
[16]金秧敏,王春花,王鑫滢.多糖硫酸化修饰和硫酸酯多糖的抗病毒活性研究进展[J].中国兽医杂志,2010,46(10):59-6146.
JING Yangmin,WANG Chunhua,WANG Xinying.Progress in sulfation of polysaccharide and Their antitumor activity[J].Chinese Journal of Veterinary Medicine,2010,46(10):59-61.(in Chinese)
[17]麻兵继,冯雅岚,申进文,等.硫酸化分级香菇多糖抗氧化活性研究[J].中国药师,2010,13(4):451-453.
MA Jibin,FENG Yalan,SHEN Jinwen,et al.Study on antitumor activity of sulfated dractional lentina in vitro[J].China Parmacist,2010,13(4):451-453.(in Chinese).
[18]Chen S G,Wang J F,Xue C H,et al.Sulfation of a squid ink polysaccharide and its inhibitory effect on tumor cell metastasis[J]. Carbohydrate Polymers,2010,81(3):560-566.
[19]Bao H,Choi W S,You S.Effect of sulfated modification on the molecular characteristics and biological activities of polysaccharides from hypsizigus marmoreus[J].Bioscience Biotechnology and Biochemistry,2010,74(7):1408-1414.
[20]Li S,Xu S Q,Zhang L N.Advances in conformations and characterizations of fungi polysaccharides[J].Acta Polymerica Sinica,2010(12):1359-1375.
[21]Lins K O A L D P,Bezerra D P,Alves A P N N,et al.Antitumor properties of a sulfated polysaccharide from the red seaweed Champia feldmannii[J].Journal of Applied Toxicology,2009,29(1):20-26.
[22]Hayashi K,Nakano T,Hashimoto M,et al.Defensive effects of a fucoidan from brown alga Undaria pinnatifida against herpes simplex virus infection[J].International Immunopharmacology,2008,8(1):109-116.
[23]Wijesekara I,Pangestuti R,Kim S K.Biological activities and potential health benefits of sulfated polysaccharides derived from marine algae[J].Carbohydrate Polymers,2011,84(1):14-21.
[24]Liu Y J,Shen J.The polysaccharides from Ganoderma lucidum:Are they always inhibitors on human hepatocarcinoma cells[J]. Carbohydrate Polymers,2012,90(3):1210-1215.
[25]Liu W,Wang H Y,Yao W B,et al.Effects of sulfation on the physicochemical and functional properties of a Water-Insoluble polysaccharide preparation from ganoderma lucidum[J].Journal of Agricultural and Food Chemistry,2010,58(6):3336-3341.
[26]Wang J G,Zhang L I.Structure and chain conformation of five water-soluble derivatives of a beta-D-glucan isolated from Ganoderma lucidum[J].Carbohydrate Research,2009,344(1):105-112.
[27]张惟杰.糖复合物生化研究技术[M].杭州:浙江大学出版社,1994.
Sulfated Modification of Extracellular Polysaccharide from Submerged Fermentation of Ganoderma lucidum
SHEN Jie1,LIU Yujun1,Zhang Jue*2
(1.College of Chemical&Material Engineering,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of NuclearMedicine of Ministry of Health,Jiangsu Institute of Nuclear Medicine,Wuxi 214063,China)
The extracellular polysaccharides from submerged fermentation of Ganoderma lucidum exhibit low anticancer activity.Sulfation of polysaccharides is an important approach to improve anticancer activity of polysaccharides.In addition,the degree of sulfated substitution(DS)is closely related to its biological activities.In order to understand the relationship between DS and sulfated conditions and obtain the sulfated derivatives with different DS,the sulfuric acid esterification reagent and the relationship between the sulfated reaction conditions and DS were further investigated.The results showed that aminosulfonic acid offered milder reaction conditions than that of chlorosulfonic acid.On the other hand,the addition of urea also gave mild reaction conditions and improved DS.
Ganoderma lucidum,polysaccharide,sulfation
O657.3
A
1673—1689(2015)06—0666—06
2014-01-29
无锡市科技支撑计划——社会发展项目(CSE01N1239);中央高校自主科研项目(JUSRP11517);食品科学与技术国家重点实验室自由探索基金项目(SKLF-ZZB-201504)。
张珏(1969-),女,上海人,工学博士,副研究员,主要从事天然产物活性和免疫学研究。E-mail:zhangjue@jsinm.org

