柚皮多糖提取分级及分子质量的分布*
郭文,陶红,于立梅,赵瑞峰,冯志斌,梁慧
1(仲恺农业工程学院轻工食品学院,广东广州,510225)
2(广东中烟工业有限公司技术中心,广东广州,510620)
柚子属于芸香科柑橘,是大众化的水果之一,广东梅县柚子是广东省“三高”农业战略龙头产品,目前梅州金柚的栽培已近百年历史,全市总面积2.67万hm2,产量30万t以上,全省金柚产量高达40万t,是全国最大的金柚商品生产基地。1995年被国家首批百家中国特产之乡组委会命名为“金柚之乡”。
柚子皮占整个柚子的43%~48%,含有多种对人体健康有益的非营养性生理活性成分,如黄酮类化合物、活性多糖、类柠檬苦素、香精油、天然色素、膳食纤维等,这些成分高于柚果实[2-4]。柚皮具有抑菌、抗氧化且具有止咳、化痰、理气、抗炎、止痒等功效[5-6]。
目前多糖提取方法主要有水浸提法、酸碱提取法、微波提取法等,而本研究则利用复合酶提取柚皮多糖。
1 材料与方法
1.1 材料
蜜柚采自梅州柚子园,选择同品种、大小、果色均匀、成熟度基本一致,无机械损伤、无病虫侵染等蜜柚作为试验材料。将果皮切成薄片在恒温干燥箱进行烘干,粉碎机将其磨成粉末备用。试剂为分析纯葡萄糖,无水乙醇,丙二醇,5%苯酚,浓H2SO4,去离子水,三氯甲烷,正丁醇,活性炭等,均购于广州一马生物科技有限公司。果胶酶,天津酶制剂厂;纤维素酶,上海伯奥生物科技有限公司。
1.2 仪器
DU-730型紫外可见分光光度计(日本岛津分析仪器厂);恒温水浴锅(广东环凯微生物科技有限公司);电热恒温培养箱(上海索谱仪器有限公司);旋转蒸发器RE-52AA(上海亚荣生化仪器厂);凝胶渗透色谱(美国Waters公司)。
1.3 实验方法
1.3.1 复合酶提取制备柚皮多糖条件优化
1.3.1.1 液料比对多糖得率的影响
准确称量30 g柚粉,纤维素酶和果胶酶的酶均在添加量1%、温度45℃、pH 6.5,液料比分别按10∶1、15∶1、25∶1、30∶1、35∶1处理,混匀,恒温酶解,反应结束后,将其置于100℃水浴中10 min使酶灭活,冷却至室温,离心,在上清液中加入无水乙醇至最终浓度为80%,4℃静置12 h,置于4 000 r/min离心机中离心20 min,收集沉淀。测定沉淀物多糖含量及计算得率。
1.3.1.2 酶解时间对多糖得率的影响
准确称量30 g柚粉,纤维素酶和果胶酶的酶均在添加量1%、温度45℃、pH 6.5,酶解时间分别按30、60、90、120、150、180 min 处理,同上。
1.3.1.3 酶解温度对多糖得率的影响
纤维素酶和果胶酶的酶均在添加量1%,液料比、酶解时间和pH按照确定的最佳值,酶解温度分别按 40、45、50、55、60、65℃处理,同上。
1.3.1.4 酶添加量对多糖得率的影响
酶解时间、液料比、酶解温度和pH值按照确定的最佳值,酶添加量分别按 0.5%、1%、1.5%、2%、2.5%和3%处理,同上。
1.3.1.5 复合酶法正交试验
根据单因素试验结果,用正交试验对影响提取的因素:酶解时间、复合酶添加量、液料比及酶解温度进行条件优化。
1.3.2 柚皮多糖的提取分级制备
有机溶剂沉淀分级法——参照史军花等方法[7]。
按照优化工艺条件提取多糖,在200 mL的柚皮提取浓缩液中,加入无水乙醇400 mL和去离子水200 mL,配制成乙醇体积分数为50%的混合液。将混合液放入4℃冰箱,静置24 h,进行醇析。将醇析后的混合液,在4 000 r/min离心机下,进行沉淀分离,用烧杯分别收集沉淀物和柚皮澄清液,沉淀物即50%的乙醇沉淀的柚皮粗多糖,编号为a粗多糖。如上述方法,分别采用70%、90%的乙醇继续醇沉柚皮澄清液,分别得到b粗多糖、c粗多糖。将a粗多糖、b粗多糖、c粗多糖冷冻干燥备用。
1.3.3 分级多糖去蛋白
采用Sevag法。
1.3.4 分级多糖脱色
采用活性炭脱色。
1.3.5 多糖含糖量的测定
采用苯酚-硫酸法[8]。

1.3.5 多糖分子质量测定
采用Waters凝胶渗透色谱(GPC)[9]。
2 结果与分析
2.1 液料比对酶法提取柚皮多糖得率的影响
不同的液料比会影响到提取溶剂对活性物质的溶解情况。复合酶提取料液比对多糖得率的影响如图1所示。由图1可知,多糖得率随液料比的增加而逐渐升高,20∶1时达到最大,之后继续增大液料比,多糖得率平缓到30∶1,随后下降。有这样的趋势可能是因为液料比过低,活性物质不能充分溶解,影响到提取率。随着液料比的过多增加,稀释了体系使酶浓度降低,酶与底物的结合不充分,多糖得率下降。考虑到成本,选择15∶1~25∶1为柚皮多糖提取的最适液料比。

图1 液料比对酶法提取柚皮多糖得率的影响Fig.1 The effect of ratio of liquid to solid on yield of Polysaccharide from Pomelo peel
2.2 复合酶量对酶法提取柚皮多糖得率的影响
每种酶在反应体系中的加入量对多糖的得率有很大影响,酶用量对多糖得率的影响见图2。由图2可见,随着酶用量的增加,酶与底物接触机会增加,多糖得率随之升高。当酶量大于1.5%时,多糖得率下降,原因可能是酶的种类不同,活性中心结构不同,空间结构不同,由于当酶浓度升高到一定程度,酶分子过于饱和,一部分没有机会与底物结合,酶解速度降低,因此,酶用量范围果胶酶和纤维素酶为1%~2%较理想。

图2 酶用量对酶法提取柚皮多糖得率的影响Fig.2 The effect of enzyme quantities on yield of Polysaccharide from Pomelo peel
2.3 酶解时间对酶法提取柚皮多糖得率的影响
浸提时间影响到溶剂与不同细胞位置活性物质的接触,并将其溶解提取出来。浸提时间越长,溶剂能够充分渗透到柚皮细胞组织的各个部位,与活性物质充分接触溶解,从而提高产率。由图3可知,当酶解时间为90 min时,多糖的提取率最大,超过120 min,多糖提取率反而下降。因此,选择60~120 min为柚皮多糖提取的最适酶解时间。
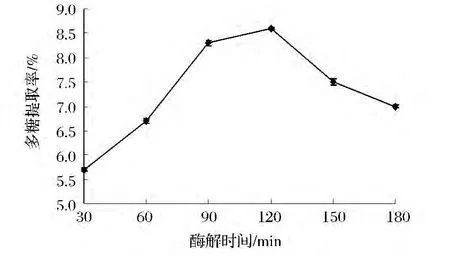
图3 酶解时间对复合酶提取柚皮多糖得率的影响Fig.3 The effect of enzymolysis time on yield of Polysaccharide from Pomelo peel
2.4 酶解温度对酶法提取柚皮多糖得率的影响
酶解温度对复合酶提取柚皮多糖得率的影响如图4所示。
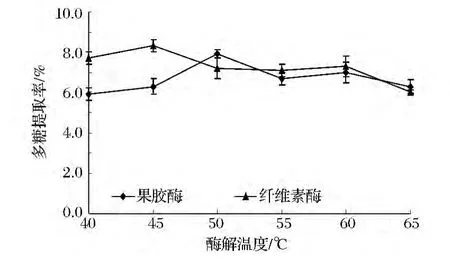
图4 酶解温度对复合酶提取柚皮多糖得率的影响Fig.4 The effect of enzymolysis temperature on yield of Polysaccharide from Pomelo peel
由图4可知,随着温度的升高多糖提取率也升高,2种酶最适温度不同,果胶酶50~55℃、纤维素酶45℃时得率达至最大,因为随着温度升高,分子运动速度加快,渗透、扩散、溶解速度加快,同时,高温可以引起细胞膜结构的变化,弱化或破坏了细胞壁的完整性,使多糖易于从柚皮的外层细胞转移到溶剂中。继续升高温度,酶蛋白开始变性,酶活力减弱直至完全丧失,反应速度亦逐渐降低,多糖得率随之下降。综合考虑,选择45~50℃最适酶解温度。
2.5 正交试验优化复合酶提取柚皮多糖工艺
影响柚皮多糖得率的各因素主次次序由表1可知,即B>C>A>D。由极差分析各因素的最佳试验组合为A2B3C3D2,实际组合为A1B2C2D2,浸提得率为9.49%。,通过验证,确定最佳组合为A2B3C3D2,即酶用量1.5%、酶解时间120 min、料液比1∶25、酶解温度50℃,浸提得率为10.39%。

表1 正交试验结果Table 1 The results of orthogonal test
2.6 不同分级的柚皮粗多糖含量的变化
乙醇通过降低多糖水溶液的介电常数,增加溶质分子的静电作用力,多糖发生聚合而析出;另外乙醇可减少多糖与水的作用,使多糖脱水而相互聚集沉淀。由表2可知,一定浓度的乙醇对应沉淀一定量的多糖,采用复合酶提取,不同浓度的乙醇分级后,不同级分多糖含量有差异,各为a粗多糖为5.6 g/100 g柚粉,b粗多糖为1.9 g/100 g柚粉,c粗多糖为1.8 g/100 g柚粉。其中不同分级的柚皮粗多糖纯度也不同,a粗多糖纯度和b粗多糖纯度没有显著差异,分别为42.2%、42.8%;c粗多糖纯度为56.2%。孔梦晓等人[10]则采用水提醇沉淀法提取了柚皮多糖,纯化后其平均收率为6.92%,刘国聪等人[11]则采用石油醚回流脱脂,热水提取沙田柚柚皮多糖的方法,测得柚皮水溶性多糖含量是7.28%。他们测定的结果与本次试验的结果存在差异,其原因可能是①柚皮的品种、成分含量等不同,其含糖量会有所差异。

表2 不同分级的柚皮粗多糖含量的变化Table 2 Changes of the content of crude polysaccharide of different grades from Pomelo peel
2.7 不同分级的柚皮多糖分子质量差异
2.7.1 粗多糖(a)分子质量变化
从色谱图5和表3可以看出,粗多糖(a)淋洗时间在9~15 min,出现2个谱峰。说明有两部分多糖。利用随机的Breeze软件计算得:粗多糖(a)的峰①的重均分子量Mw为24 100 Da,数均分子质量Mn为21 300 Da,峰位分子质量Mp28 540 Da,分子质量分布宽度(Mw/Mn)为1.13;粗多糖(a)的峰②的分子质量很小,是峰①的大约10倍左右,峰②重均分子质量Mw为2 180 Da,数均分子质量Mn为2 060 Da,峰位分子质量Mp2 650 Da,分子质量分布宽度(Mw/Mn)为1.06。说明50%乙醇沉淀多糖主要是大分子质量多糖。分子质量分布宽度的数值比1越大,其分子质量分布越宽,多分散性程度越大。

图5 粗多糖(a)凝胶色谱图Fig.5 GPC chromatogram of crude polysaccharide(a)
2.7.2 粗多糖(b)分子质量变化
从色谱图6和表3得知,粗多糖(b)淋洗时间在11~15 min,出现2个谱峰,说明有两部分多糖。利用随机的Breeze软件计算得:粗多糖(b)的峰②的分子质量很小,是峰①的大约1/10倍左右,分子质量分别为重均分子质量Mw为1 920 Da,数均分子质量Mn为2 030 Da,峰位分子质量Mp2 390 Da,分子质量分布宽度(Mw/Mn)为1.05.。粗多糖(b)的峰①的重均分子质量Mw为11 700 Da,数均分子质量Mn为11 200 Da,峰位分子质量Mp13 540 Da,分子质量分布宽度(Mw/Mn)为1.04。

图6 粗多糖(b)分子量色谱图Fig.6 GPC chromatogram of crude polysaccharide(b)
2.7.3 粗多糖(c)分子量变化
从色谱图7和表3得知,粗多糖(c)在色谱柱上出现一个谱峰,说明有一部分多糖。淋洗时间在13~15 min,利用随机的Breeze软件计算得:粗多糖(c)的峰①的重均分子质量Mw为2 130 Da,数均分子质量Mn为1 890 Da,峰位分子质量Mp2 540 Da,分子质量分布宽度(Mw/Mn)为1.12。

图7 粗多糖(c)分子量色谱图Fig.7 GPC chromatogram of crude polysaccharide(c)
不同分级的柚皮多糖分子质量表征如图5~图7,由图5~图7可以看出,不同溶剂分级的柚皮多糖经过凝胶渗透色谱柱淋洗时间不同,粗多糖(a)淋洗时间最低为9 min,最高在15 min。淋洗时间长短表明这3种粗多糖分子质量有一定的差异,当其流经凝胶色谱柱较大的分子被排除在粒子的小孔之外,只能从粒子间的间隙通过,速率较快;而较小的分子可以进入粒子中的小孔,通过的速率要慢得多。经过一定长度的色谱柱,分子根据相对分子质量被分开,相对分子质量大的在前面(即淋洗时间短),相对分子质量小的在后面(即淋洗时间长)。
不同分级的多糖分子质量呈现趋势为粗多糖(c)的分子质量最小,粗多糖(a)分子质量最大,且在粗多糖a,b中出现了和c一个级的分子质量,可能是因为不同分子质量多糖的沉淀不仅与乙醇浓度有关,还与乙醇加入的顺序有关。如先加乙醇后加料分子量较大,先加料后加乙醇则分子量较小。

表3 粗多糖(a、b、c)凝胶色谱表征Table 3 The data of GPC chromatogram of crude polysaccharide(a,b,c)
本实验采用先加料后加乙醇的方法,随着乙醇的加入,多糖分子表面出现乙醇浓度差,当沉淀大分子多糖时,则有小分子多糖混在大分子多糖里。
3 结论
由于植物多糖的来源广泛,不同种的植物多糖的结构,分子构成及分子质量各不相同,生物活性也不同。在提取多糖过程中,利用适量的酶可提高提取率,加速多糖的释放。同时,使用酶法可分解提取液中淀粉、果胶、蛋白质等的产物,有利于多糖的纯化。本文采用复合酶提取、有机溶剂分级沉淀法制备柚皮多糖,得出优化工艺为:酶用量1.0%、酶解时间90 min、料液比 1∶20、酶解温度 50℃,多糖得率为9.32%。不同分级的柚皮粗多糖含量和纯度各不同,不同分级的多糖分子质量测定表明:乙醇浓度越低,沉淀多糖的分子质量越大,不同分级的多糖分子质量呈现趋势为粗多糖(c)的分子质量最小,粗多糖(a)分子质量最大,且在粗多糖a,b中出现了和c一个级的分子质量,可能是因为不同分子质量多糖的沉淀不仅与乙醇浓度有关,还与乙醇加入的顺序有关。
[1]任贻军,张宏琳,李建英.胡柚的化学成分及药理作用研究[J].中草药,2009,37(21):18-19.
[2]WU Ting,GUAN Yue-qing,YE Jian-nong,et al.Determination of flavonoids and ascorbic acid in grapefruit peel and juice by capillary electrophoresis with electrochemical detection[J].Food Chemistry,2007,100(4):1 573 -1 579.
[3]贾冬英,姚开,谭敏,等.柚果皮中生理活性成分的研究进展[J].食品与发酵工业,2001,27(11):74-78.
[4]Builarelli F,Cartoni G P,Coccioli F,et al.Aanlysis of bitter essential oils from orange and grapefruit by high performance liquid chromatography with microbore columns[J].Journal of Chromatography A,1999,730(1 -2):9 -16.
[5]Viuda-Martos M,Ruiz-Navajas Y,et al.Antifungal activity of lemon(Citrus lemon L.),mandarin(Citrus retivulata L.),grape fruit(Citrus paradise L.)and orange(Citrus sinensis L.)essential oils[J].Food Control,2008,19(12):1 130-1 138.
[6]Alessandra Bocco,Marie-Elisabeth Cuvelier,et al.Antioxidant activity and phenolic composition of citrus peel and seed extract[J].Journal of Ariculture Food Chemistry,1998,46(6):2 123 -2 129.
[7]史军花,梁忠岩.猴头发酵菌丝多糖的分离、提纯、纯化及其初步研究[J].长春师范学院学报,2002,21(1):
[8]王忠民,王跃进,周鹏.苯酚-硫酸法测定葡萄多糖含量[J].陕西:新疆农业大学学报,2004,27(2):87-90.
[9]Yamamoto Y,Nunome T,Yamauchi R,et al.Structure of an exocellular polysaccharide of Lactobacillus helveticus TN-4,a spontaneous mutant strain of Lactobacillus helveticus TY1-2[J].Carbohydr Res,1995,275(2):319 - 332.
[10]孔梦晓,等.柚皮多糖的提取纯化工艺及鉴定[J].食品工程,2011(8):157.
[11]刘国聪.沙田柚皮水溶性多糖的提取和测定[J].食品科学,2007,28(11):223.

