纳米硫化铜与明胶蛋白质的直接键合作用*
刘 岑,黎幼群,唐世华,邓 秋
(广西民族大学a.化学化工学院;b.广西林产化学与工程重点实验室,广西 南宁 530006)
纳米硫化铜与明胶蛋白质的直接键合作用*
刘 岑,黎幼群,唐世华,邓 秋
(广西民族大学a.化学化工学院;b.广西林产化学与工程重点实验室,广西南宁530006)
在pH=12.0的明胶溶液中,采用一锅化学反应法制得水溶性明胶/CuS纳米生物复合物.利用透射电子显微镜(TEM)、X射线粉末衍射(XRD)对复合物进行表征,显示纳米CuS颗粒为球状且表面被明胶大分子包覆.紫外-可见吸收光谱(UV-Vis)和傅里叶红外光谱(FT-IR)表明CuS与明胶肽链的酰胺基键合;CuS与明胶的键合,对明胶内源荧光有着较强的猝灭作用,为静态猝灭过程.由修正的Scatchard公式模型求出复合物的表观形成常数,结合位点数以及反应的热力学参数(△rHm=37.88kJ·mol-1;△rSm=216.77J·K-1·mol-1;△rGm=-57.44/-58.98/-60.69kJ·mol-1),结果表明反应是自发进行(△rGm<0),且为熵驱动(△rSm>0).
纳米CuS;明胶;纳米生物复合物;热力学
0 引言
纳米生物复合物是无机纳米颗粒与生物分子在纳米至亚微米范围复合的产物[1],此类材料具有良好的生物相容性与分子识别等功能,已广泛地应用于生物传感器、基因及药物载体、组织工程仿生材料等[2-5],是材料、化学和生物等领域的研究热点.纳米硫化铜是具有较短带隙的半导体,具有特殊的光致发光及电致发光,以及高电导率和高能电容等特性,是太阳能电池、光滤波器的良好材料[6-9].纳米硫化铜具有近红外吸收性能,是一种有潜力的光热剂和造影剂[10],对于肿瘤的光热治疗有着广阔的应用前景.纳米硫化铜的颗粒大小和化学计量学影响其带隙和光致发光特性,其水溶性和良好分散性是纳米硫化铜许多应用的必要条件,而以天然生物分子为模板制备的纳米硫化铜则能很好地满足这些要求[11-12].目前,一些生物分子如壳聚糖[13]、DNA[14]、牛血清蛋白[15]等已成功用于合成纳米生物复合物.明胶是由动物的骨、生皮、肌腱等结缔组织的胶原蛋白经酸式或碱式水解得到的多分散性的纤维状蛋白质分子[16];其分子中羧基、氨基、巯基、羟基和醛基等[17]侧链基团有较高的反应活性,可与一些金属离子如Cu2+、Fe3+[18]等发生键合作用.此外明胶具有许多优异的物理化学性能,如:良好的乳化性、生物相容性、生物可降解性等,是制备纳米生物复合物的理想基材.纳米颗粒与明胶分子直接键合,反应条件温和,原料来源广泛,制备产物重复性高,可控性好,且明胶对人体及环境没有毒性,因此被称为“绿色”化学方法[19].已有相关文献报道在明胶溶液中合成金属硫化物纳米颗粒,如:PbS[20]、CdS[21]、Cu2S[22]等,但相关报道均集中在纳米生物复合物的制备、表征、功能开发及应用等方面[23-24],有关纳米颗粒与生物大分子的键合反应机制,尤其是反应的热力学性质方面研究较少.
鉴于此,本研究在pH=12.0的条件下采用一锅化学反应法制备了明胶/CuS纳米生物复合物,利用透射电子显微镜、X射线粉末衍射对复合物进行了表征.利用紫外-可见吸收光谱、傅里叶红外光谱和荧光猝灭法探索纳米CuS与明胶大分子相互作用的机制和热力学特征,研究结果对指导纳米生物复合物的合成以及分子水平上评价纳米材料安全性等方面有着重要的意义[25].
1 实验部分
1.1试剂与仪器
明胶(CP),上海化学试剂分装厂;CuCl2·2H2O(AR),中国医药(集团)上海化学试剂公司;Na2S· 9H2O(AR),成都市科龙化工试剂厂;盐酸(AR),国药集团化学试剂有限公司;NaOH(AR),广州化学试剂厂;二次蒸馏水.
HS-3D功能型pH计(上海三信);SCD-6节能型智能恒温槽(宁波新芝);D/MAX 2500X射线粉末衍射仪(日本Rigaku);JEM-1011透射电子显微镜(日本电子);2802PCS紫外-可见吸收光谱仪(上海优尼柯);500ⅡFT-IR傅立叶红外分光光度计(美国Nicolet);LS-55荧光光度计(美国Perkin Elmer).
1.2样品制备
准确量取10ml浓度为1.25×10-4mol/L的明胶溶液,分别置于25ml的烧杯中,依次加入不同体积的浓度为0.010mol/L的Cu2+溶液,混匀,调溶液的pH为12.0;加入0.50ml浓度为0.10mol/L的S2-离子,混匀,调pH至12.0.最后将溶液移至25ml的比色管中,用pH为12.0的二次蒸馏水定容,即得明胶和S2-浓度不变、Cu2+浓度不同的体系.样品溶液在测试温度下恒温水浴20h,使其充分平衡.
2 结果与讨论
2.1明胶/CuS纳米生物复合物的形貌分析
图1为明胶/CuS的透射电镜(TEM)照片,图2为X射线衍射(XRD)图谱.从图1可看出CuS为均匀分散的球形颗粒,粒径主要分布在30~40nm.图2中,明胶的XRD谱图呈宽大的弥散峰,峰包中心2θ约在21°处,表明明胶蛋白为非晶态物质;与明胶相比,明胶/CuS亦为弥散峰,没有显示出CuS的特征衍射峰,同时EDX分析也没有发现Cu元素,说明纳米CuS颗粒被明胶大分子包覆.另外,实验条件下所制备的明胶/CuS褐色溶液室温放置20天,无沉淀生成,表明明胶包覆在CuS纳米颗粒表面(即化学修饰),减少了纳米CuS的表面能,所制得明胶/CuS纳米生物复合物具有较好的亲水性.
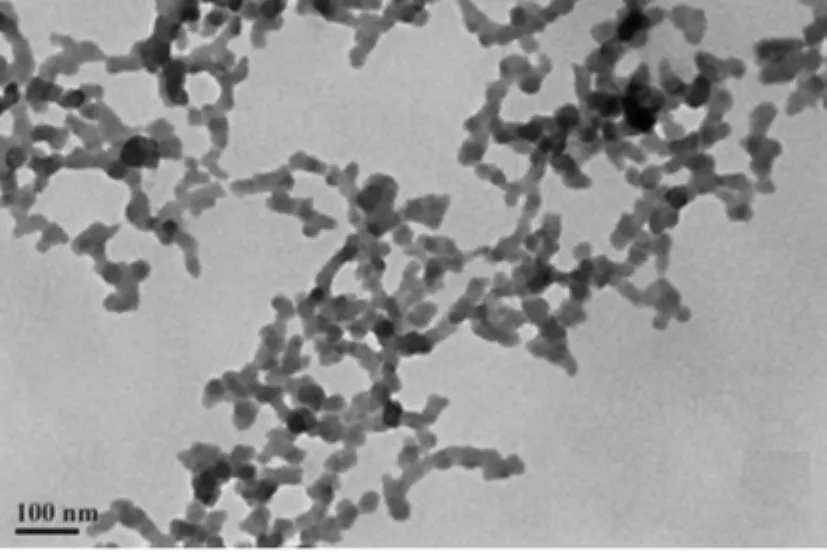
图1 明胶/CuS的TEM照片Fig.1 SEM image of gelatin/CuS
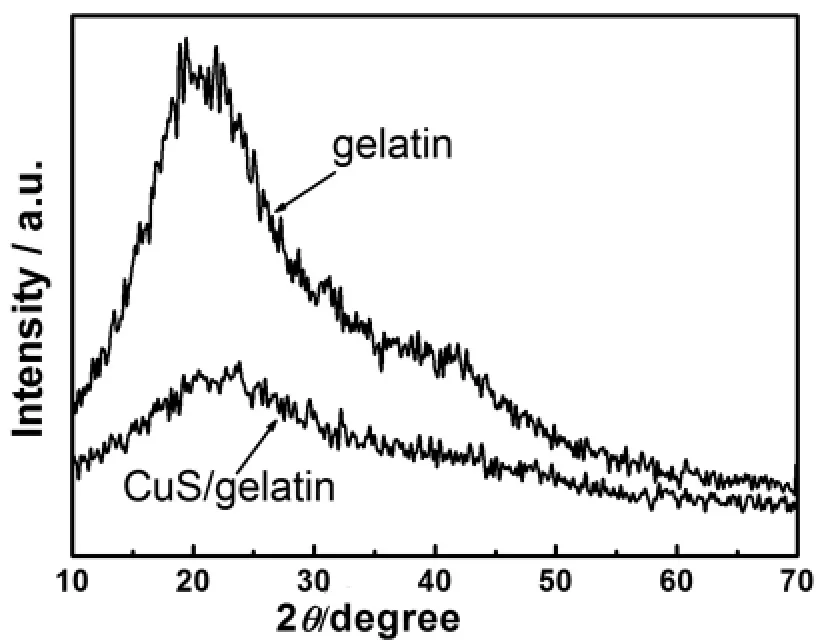
图2 明胶/CuS的粉末XRD图谱Fig.2 Power XRD pattem of gelatin/CuS
2.2明胶、明胶/Cu2+和明胶/CuS的紫外-可见吸收光谱
以pH=12.0的水溶液为参比,测得明胶(曲线1)、明胶/Cu2+(曲线2)和明胶/CuS(曲线3)的紫外-可见吸收光谱(图3).由于明胶蛋白质分子中芳香氨基酸残基的π→π*电子跃迁,使明胶在289nm处有一强吸收峰[26].与纯明胶相比,明胶/Cu2+溶液的最大吸收峰红移,吸收强度增大,且在550nm出现新吸收峰,表明Cu2+与明胶络合形成了明胶/Cu2+复合物[27];明胶/CuS在1045nm处出现新的吸收峰,表明S2-与明胶/Cu2+复合物的Cu2+结合,生成了CuS微粒[28].明胶/Cu2+或明胶/CuS体系紫外-可见吸收光谱表现出的增色效应以及新吸收峰的出现均说明Cu2+或CuS与明胶结合形成了复合物,诱导明胶大分子的肽链伸展,使包埋在明胶分子内部的酪氨酸等残基的芳香杂环裸露出来,从而289nm处的吸收增强[29].
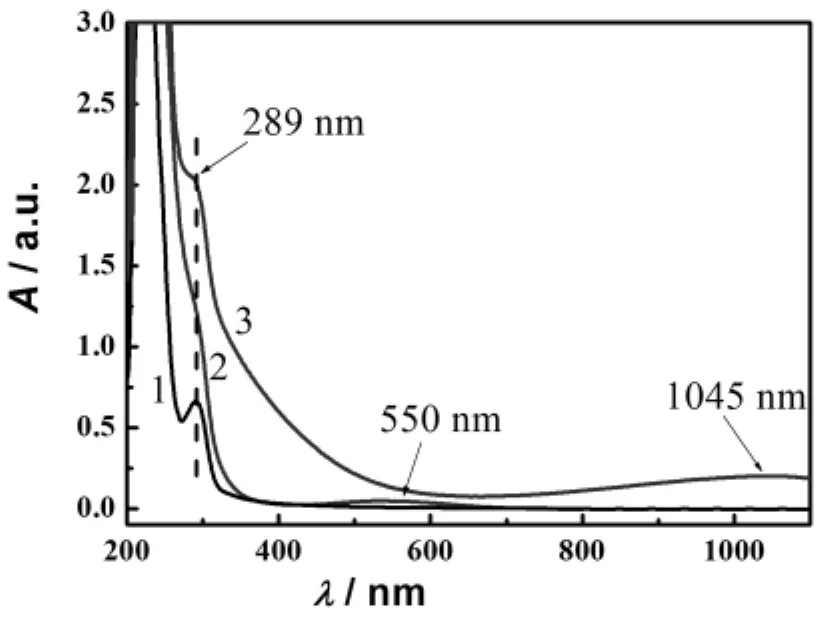
图3 明胶、明胶/Cu2+和明胶/CuS溶液的紫外-可见吸收光谱Fig.3 UV-Vis spectra of gelatin,gelatin/Cu2+and gelatin/CuS
2.3明胶、明胶/Cu2+和明胶/CuS的红外光谱特征
明胶、明胶/Cu2+和明胶/CuS的红外光谱见图4.由图4可知:明胶(曲线1)分子中酰胺键的3个特征吸收带1678.69(酰胺I带:主要是反对称羧基或C=O的伸缩振动)、1532.57(酰胺II带:主要是C─N伸缩或N─H的弯曲振动)和1244.68cm-1(酰胺III带:主要是C─N伸缩振动)在与Cu2+络合后分别移动至1669.92cm-1、1525.86cm-1和1244.42cm-1(曲线2),说明Cu2+与酰胺基的O原子和N原子络合能力较大,当Cu2+与酰胺基络合后,C和O以及N和H原子间的电子云密度分别移向O和N原子,导致C=O的伸缩振动以及N─H和C─N混频的振动频率降低[30].
加入S2-后,明胶分子的特征峰分别位移至1667.55cm-1、1528.15cm-1和1241.88cm-1(曲线3),与明胶/Cu2+相比,羰基峰的峰位降低,N─H振动频率升高,说明原先配位状态的Cu2+进一步与S2-结合,由于S2-是供电子基,S2-与Cu2+的结合使酰胺基上的C和O以及N和H原子间的电子云密度分别向O和H原子方向移动,酰胺基的化学环境发生新的变化,其结合能、振动能也相应发生改变.明胶分子侧链羧基的吸收峰(1450.50cm-1)没有明显的位移,但在此位置,明胶/Cu2+和明胶/CuS的吸收强度却依次增大,表明明胶/Cu2+和明胶/CuS的形成对明胶分子侧链羧基亦有一定影响.明胶/CuS在441.59cm-1处出现较强新峰,表明体系有CuS生成[31].红外光谱表明,CuS与明胶分子链的酰胺基发生了配位作用,CuS在该位点成核并生长,对酰胺基和羧基的振动产生了影响.
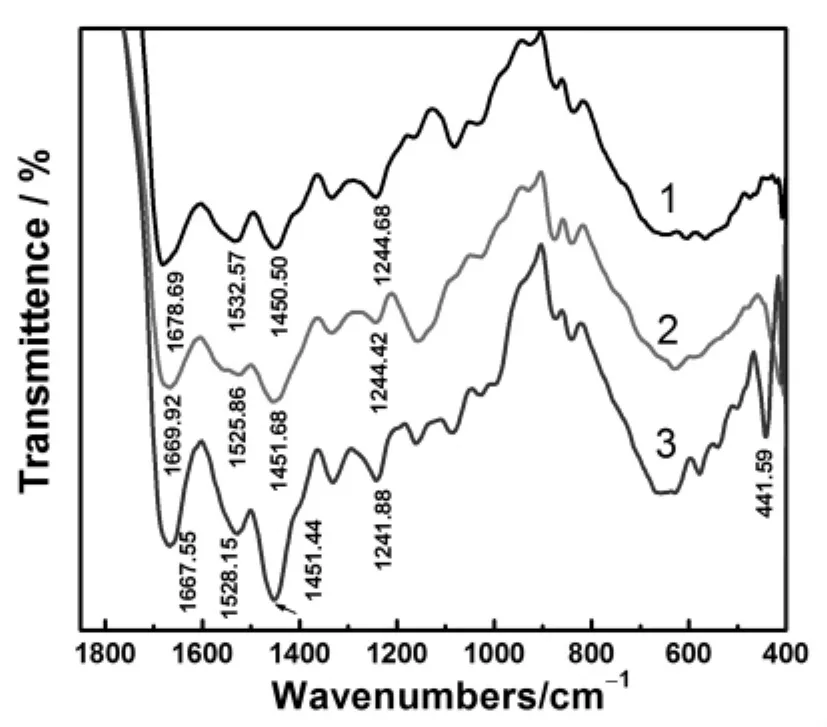
图4 纯明胶、明胶/Cu2+和明胶/CuS的红外光谱Fig.4 FT-IR spectra of gelatin,gelatin/Cu2+and gelatin/CuS
2.4纳米CuS对明胶的荧光猝灭常数和猝灭机理
在组成明胶蛋白质的18种氨基酸中,酪氨酸是主要的荧光贡献基团,明胶的荧光及其变化直接反映了酪氨酸残基本身及其周围微环境的变化[32].图5给出了293K时CuS对明胶的荧光猝灭光谱.由图5可知,随着CuS浓度的增大(由于S2-过量可认为Cu2+反应完全,故图5中以Cu2+浓度替代CuS浓度,下同),CuS对明胶内源荧光猝灭增强,表明CuS与明胶之间存在相互作用.
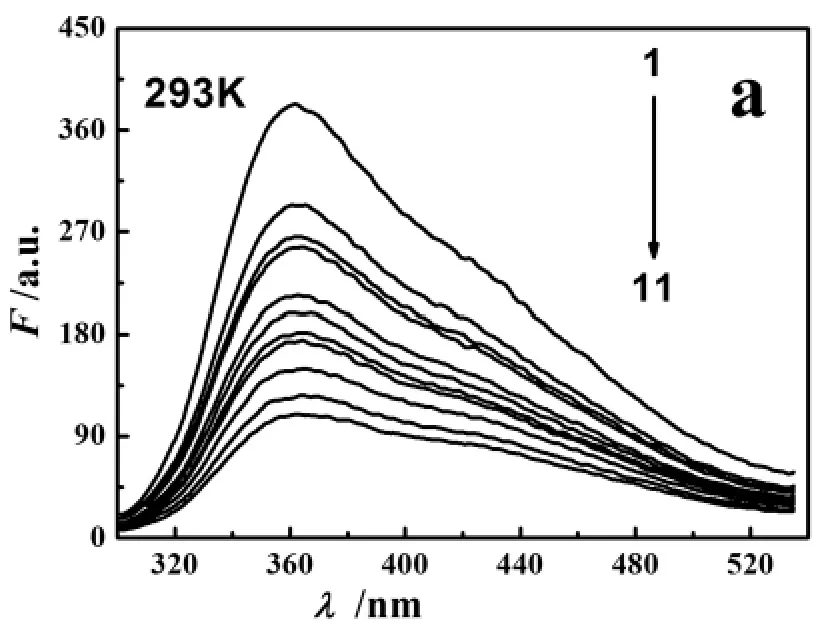
图5 CuS对明胶的荧光猝灭光谱图Fig.5 Fluorescence quenching spectra of gelatin with CuS
荧光猝灭有静态猝灭和动态猝灭[33].前者是由于猝灭剂与基态荧光分子结合而生成不发光的复合物;后者是由于猝灭剂与激发态的荧光分子碰撞,以能量转移或电荷转移形式损失激发能,两种作用机制均导致荧光分子的荧光强度降低.Stern-Volmer方程通常用来分析荧光猝灭方式:
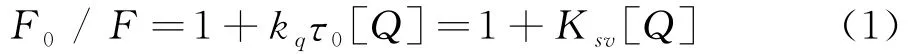
式(1)中F0为荧光分子(明胶)的荧光强度;F为加入猝灭剂(CuS)时荧光分子(明胶)的荧光强度;kq为双分子荧光猝灭速率常数(kq值约为2.0×1010L·mol-1·s-1);τ0为生物大分子的平均荧光寿命(τ0约为10-8s);[Q]为猝灭剂浓度;Ksv是Stern-Volmer猝灭常数.根据公式(1),以F0/F对CuS的浓度作图(图6),求得不同温度下CuS对明胶的动态猝灭常数Ksv和猝灭速率常数kq,列于表1.从表1数据可见,kq值均为1012,结合紫外-可见光谱和红外光谱结果,表明CuS与明胶发生了键合反应,CuS对明胶荧光猝灭为静态猝灭过程[34-35].

图6 CuS对明胶荧光猝灭的Stern-Volmer图Fig.6 The quenching curves of CuS on gelatin

表1 不同温度下的Stern-Volmer直线方程、相关系数、猝灭常数和猝灭速率常数Tab.1 Stern-Volmer regression equation,correlation coefficient,quenching constants and bimolecular quenching rate constants at different temperatures(λex=284nm)
2.4纳米CuS与明胶的键合常数和热力学参数CuS与明胶的键合反应的总反应可表达为:
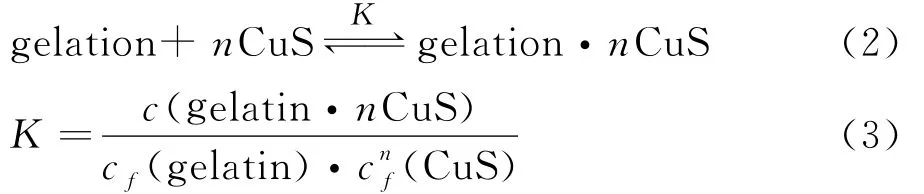
式中,c(gelatin·nCuS)和cf(CuS)分别表示复合物gelatin·nCuS的浓度和CuS的游离浓度,cf(gelatin)和ct(gelatin)分别表示明胶的游离浓度和总浓度,n为结合位点数,K为表观形成常数.
由修正的Scatchard公式模型可得到如下方程式[36]:


表2 不同温度下CuS与明胶反应的表观形成常数、结合位点数和热力学参数(λex=284nm)Tab.2 The apparent formation constants,binding sites and thermodynamic parameters of gelatin with CuS at different temperatures(λex=284nm)
由表2可知,n≈1表明CuS与明胶之间有一个结合位点(酰胺基),与红外分析结果相符.△rGm为负值,表明CuS与明胶的结合反应是自发过程;反应的焓变△rHm为正值,表明反应吸热.熵变为较大的正值,表明△rGm主要来自于熵变的贡献,反应为熵驱动.熵增的原因可能是CuS与明胶的结合过程中,明胶分子、Cu2+和S2-表面水化层结构被破坏,大量水分子释放导致体系混乱度增加.
3 结论
纳米硫化铜与明胶蛋白质在pH为12.0的条件下直接键合生成明胶/CuS纳米生物复合物,复合物为均匀分散的球形,稳定性较好.紫外-可见吸收光谱和红外光谱表明,Cu2+与明胶肽链中的酰胺基螯合生成明胶/Cu2+螯合物,随后加入的S2-与明胶/ Cu2+反应生成明胶/CuS复合物;CuS与明胶的键合导致明胶内源荧光猝灭.通过修正的Scatchard公式模型计算复合物的表观形成常数和热力学参数,表明反应是自发的吸热反应,且为熵驱动.研究结果可对纳米生物复合物的制备及纳米材料安全性评价提供理论基础.
[1]Darder M,Aranda P,Ruiz-Hitzky E.Bionanocomposites:a new concept of ecological,bioinspired,and functional hybrid materials [J].Adv.Mater.,2007,19(10):1309-1319.
[2]张阳德.纳米生物材料学[M].北京:化学工业出版社,2005:10-13.
[3]熊玲,奚廷斐,蒋学华,等.纳米特性引发的生物效应及其纳米生物材料安全性评价[J].中国临床康复,2006,10(45):132-135.
[4]Seok H,Park T H.Integration of biomolecules and nanomaterials:towards highly selective and sensitive biosensors[J].Biotechnol.J.,2011,6(11):1310-1316.
[5]Lee S W,Mao C,Flynn C E,et al.Ordering of quantum dots using genetically engineered viruses[J].Science,2002,296(5569):892-895.
[6]Chung J S,Sohn H J.Electrochemical behaviors of CuS as a cathode material for lithium secondary batterie[J].J.Power Sources,2002,108(1):226-231.
[7]Zhang X,Wang G,Gu A,et al.CuS nanotubes for ultrasensitive nonenzymatic glucose sensors[J].Chem.Commun,2008(45):5945-5947.
[8]Isac L,Duta A,Kriza A,et al.Copper sulfide sobtained by spray pyrolysis-Possible absorbers in solid-state solar cells[J].Thin Solid Films,2007,515(15):5755-5758.
[9]Wang X,Fang Z,Lin X.Copper sulfide nanotubes:facile,largescale synthesis,and application in photodegradation[J].J.Nanopart.Res.,2009,11(3):731-736.
[10]Ku G,Zhou M,Song S,et al.Copper sulfide nanoparticles as a new class of photoacoustic contrast agent for deep tissue imaging at 1064nm[J].Acs Nano,2012,6(8):7489-7496.
[11]Iwahori K,Takagi R,Kishimoto N,et al.A size controlled synthesis of CuS nano-particles in the protein cage,apoferritin[J]. Mater.Lett.,2011,65(21):3245-3247.
[12]陈彰旭,郑炳云,李先学,等.模板法制备纳米材料研究进展[J].化工进展,2010,29(1):94-99.
[13]Kong L,Gao Y,Cao W,et al.Preparation and characterization of nano-hydroxyapatite/chitosan composite scaffolds[J].J.Biomed.Mater.Res.,2005,75(2):275-282.
[14]Kang J,Li X,Wu G,et al.A new scheme of hybridization based on the Aunano-DNA modified glassy carbon electrode[J].Anal. Biochem.,2007,364(2):165-170.
[15]Zhang J,Han B,Chen J,et al.Synthesis of Ag/BSA composite nanospheres from water-in-oil microemulsion using compressed CO2as antisolvent[J].Biotechnol.Bioeng.,2005,89(3):274-279.
[16]Gómez-Guillén M C,Giménez B,López-Caballero M A,et al. Functional and bioactive properties of collagen and gelatin from alternative sources:A review[J].Food Hydrocolloids,2011,25(8):1813-1827.
[17]胡欣,蔡朝霞,马美湖.溶剂热法制备氨基修饰的Fe3O4纳米粒子及其性能[J].磁性材料及器件,2011,42(5):32-35.
[18]唐世华,黄建滨.Cu2+和Fe3+与明胶的相互作用[J].物理化学学报,2001,17(10):873-878.
[19]Virkutyte J,Varma R S.Green synthesis of metal nanoparticles:Biodegradable polymers and enzymes in stabilization and surface functionalization[J].Chem.Sci.,2011,2(5):837-846.
[20]Mozafari M,Moztarzadeh F.Controllable synthesis,characterization and optical properties of colloidal PbS/gelatin core-shell nanocrystals[J].J.Colloid Interface Sci.,2010,351(2):442-448.
[21]Tang S H,Li Y Q,Wang J,et al.Optical properties of gelatin/ CdS bionanocomposite and its conformational change[J].中国组织工程研究,2013,17(34):6166-6172.
[22]Muradov M B,Nuriev M A,Eivazova G M.Electric conductivity of nanocompounds based on polymer and chalcogenide semiconductors CdS,Cu2S[J].Surf.Eng.Appl.Elect.,2007,43(5):391-394.
[23]Li J,Chen Y P,Yin Y,et al.Modulation of nano-hydroxyapatite size via formation on chitosan-gelatin network film in situ [J].Biomaterials,2007,28(5):781-790.
[24]Peter M,Binulal N S,Nair S V,et al.Novel biodegradable chitosan-gelatin/nano-bioactive glass ceramic composite scaffolds for alveolar bone tissue engineering[J].Chem.Eng.J.,2010,158(2):353-361.
[25]熊玲,奚廷斐,蒋学华,等.纳米特性引发的生物效应及其纳米生物材料安全性评价[J].中国临床康复,2007,10(45):132-135.
[26]Wang J,Wu J,Zhang Z,et al.Sonocatalytic damage of bovine serum albumin(BSA)in the presence of nanometer anatase titanium dioxide(TiO2)[J].Chin.Chem.Lett.,2005,16(8):1105-1108.
[27]Amelia M,Flamini R,Latterini L.Recovery of CdS nanocrystal defects through conjugation with proteins[J].Langmuir,2010,26(12):10129-10134.
[28]Gautam U K,Mukherjee B.A simple synthesis and characterization of CuS nanocrystals[J].Bull.Mater.Sci.,2006,29(1).
[29]席小莉,杨曼曼,杨频.表柔比星-铜体系与DNA作用的光谱和电化学法研究[J].化学学报,2008,66(10):1181-1186.
[30]张叔良,易大年,吴天明.红外光谱分析与新技术[M].北京:中国医药科技出版社,1993:140-142.
[31]刘丽华,张培萍,李献洲.金属硫化物矿物的远红外光谱表征[J].分析测试技术与仪器,2006(1):34-37.
[32]唐世华,张宁.荧光光度法研究明胶的等电点[J].明胶科学与技术,2000,20(2):69-73.
[33]杨曼曼,席小莉,杨频.用荧光猝灭和荧光加强两种理论研究喹诺酮类新药与白蛋白的作[J].高等学校化学学报,2006,27(4):687-691.
[34]Papadopoulou A,Green R J,Frazier R A.Interaction of flavonoids with bovine serum albumin:a fluorescence quenching study[J].J.Agric.Food.Chem.,2005,53(1):158-163.
[35]Soares S,Mateus N,De Freitas V.Interaction of different polyphenols with bovine serum albumin(BSA)and human salivaryα-amylase(HSA)by fluorescence quenching[J].J.Agric.Food. Chem.,2007,55(16):6726-6735.
[36]Tang S H,Li Y Q.Interaction via in situ binding of CdS nanorods onto gelatin[J].J.Colloid Interface Sci.,2011,360(1):71-77.
[37]Kathiravan A,Renganathan R,Anandan S.Interaction of colloidal AgTiO2nanoparticles with bovine serum albumin[J].Polyhedron,2009,28(1):157-161.
[责任编辑 黄招扬]
[责任校对 黄祖宾]
Direct Bonding of Nano-copper Sulfide with Gelatin
LIU Cen,LI You-qun,Tang Shi-hua,DENG Qiu
(a.School of Chemistry and Chemical Engineering,b.Guangχi Key Laboratory of Chemistry and Engineering of Forest Products,Guangχi University for Nationalities,Nanning530006,China)
The gelatin/CuS bionanocomposite was synthesized by the direct bonding of nano copper sulfide and gelatin in gelatin solution at pH=12.0.The samples were characterized by TEM and XRD,which shows that the spherical CuS particles were enshrouded by gelatin.It was speculated that CuS and gelatin bonded in amide group of gelatin by means of UV-Vis and FT-IR;the binding of CuS and gelatin has a strong ability to quench the intrinsic fluorescence of gelatin,which is a static quenching procedure.The apparent formation constant,binding sites and thermodynamic parameters(△rHm=37.88kJ·mol-1;△rSm=216.77J·K-1·mol-1;△rGm=-57.44/-58.98/-60.69kJ·mol-1)were calculated by the modified Scatchard equation,the results indicate that the reaction was spontaneous(△rGm<0),and entropy driven(△rSm>0).
Nano CuS;gelatin;bionanocomposite;thermodynamics
O62
A
1673-8462(2015)02-0081-06
2015-01-22.
国家自然科学基金(21067001).
刘岑(1989-),女,湖北咸宁人,广西民族大学化学化工学院应用化学专业硕士研究生;唐世华(1954-),男,河南驻马店人,广西民族大学化学化工学院教授,硕士生导师.

