链球菌蛋白G的结构域重构、表达及鉴定
许 瑞,赵登云,洪 炀,陆 珂,李 浩,林矫矫,2,冯金涛,徐玉梅,朱传刚
(1. 中国农业科学院上海兽医研究所 农业部寄生虫学重点开放实验室 国家防治动物血吸虫病专业实验室,上海200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;3. 上海徐汇区中心医院,上海 200031)
链球菌蛋白G的结构域重构、表达及鉴定
许 瑞1,赵登云1,洪 炀1,陆 珂1,李 浩1,林矫矫1,2,冯金涛1,徐玉梅3,朱传刚1
(1. 中国农业科学院上海兽医研究所 农业部寄生虫学重点开放实验室 国家防治动物血吸虫病专业实验室,上海200241;2. 江苏省动物重要疫病与人兽共患病防控协同创新中心,扬州 225009;3. 上海徐汇区中心医院,上海 200031)
链球菌蛋白G(streptococcal protein G, SPG)具有与多种动物IgG结合的特性。本研究对链球菌蛋白G进行生物学分析,设计重组蛋白G的基因序列,构建重组蛋白G的原核表达质粒,并在大肠杆菌中进行表达,得到带有GST标签的融合蛋白,通过GST亲和层析纯化蛋白。Western blot结果显示,重组蛋白具备与IgG结合的能力。ELISA测定重组蛋白与牛、山羊、兔、鼠4个物种IgG的亲和力,显示重组蛋白G的亲和力普遍高于商品化链球菌蛋白G。本研究成功重构并表达、纯化了链球菌重组蛋白G,得到其与4个物种抗体IgG的亲和力常数,有助于SPG在其他相关研究中的应用。
链球菌蛋白G;重组;亲和力常数
链球菌蛋白G(streptococcal protein G,SPG)是一种能与人及多种动物IgG结合的链球菌细胞壁蛋白,最早在1973年由Kronvall报道。A、C、G群链球菌的细胞壁及培养上清均含该蛋白,且其特性与葡萄球菌蛋白A(SPA)明显不同。1984年,Bjorck等[1]将这种蛋白统称为链球菌蛋白G,并对其进行了分离纯化。目前,SPA由于具有与抗体Fc端结合的特性,较为广泛的应用于免疫学实验中,而SPG与SPA相比,IgG的结合力更强,结合谱更广[2]。
SPG的结构如图1所示,从N端开始有三个同源结构A1、A2和A3,每个同源结构由24个氨基酸组成,同时这三个同源结构被51个氨基酸的同源区域B1、B2隔开,接着是一个间隔区S,随后是55个氨基酸的同源结构C1、C2和C3,它们之间又被D1和D2区隔开,C3区之后为亲水区W,最后为M区[3]。研究表明,SPG三个同源的氨基酸序列C1、C2和C3区与IgG Fc端的结合有关,且C1和C2只有2个氨基酸序列不同,C1和C3区有6个氨基酸序列不同,且C3结构与IgG的结合能力相当于C1结构的7倍[4]。
为获得一种能高效结合IgG的工具蛋白,本研究将SPG基因的IgG结合片段进行重构,只保留蛋白与IgG的Fc端特异性结合的C区,并探讨该重组蛋白G结合不同物种IgG的生物学活性。

图1 链球菌蛋白G氨基酸序列结构[3]Fig.1 The amino acid of SPG sequences
1 材料与方法
1.1 质粒、菌种 E.coli BL21购自北京全式金生物技术有限公司;质粒pGEX-2T为本实验室保存。
1.2 相关试剂 ProteinRuler II(12-120 kDa)购自北京全式金生物技术有限公司;可溶性单组分TMB底物溶液、HRP-DAB底物显色试剂盒购自天根生物科技(北京)有限公司;硝酸纤维素膜(NC膜)购自Whatman公司;对照用商品化链球菌蛋白G(SPG)购自杭州纽龙生物科技有限公司。检测结合力的四种酶标抗体:牛抗小鼠IgG-HRP购自Santa Cruz Biotechnology;山羊抗小鼠IgG-HRP购自北京康为世纪生物科技有限公司;小鼠抗兔IgG-HRP购自Proteintech;兔抗鸡IgG-HRP购自上海中科英沐生物科技有限公司。
1.3 重组蛋白G的构建 从GenBank中查出已公布的编码SPG的C区,找出C1、C2、C3区和D区,并将C1、C2区替换为C3区,得到C3DC3DC3的基因序列,检测基因序列中是否含有大肠杆菌使用频率低的(<10%)稀有密码子,将其替换为编码同一氨基酸的大肠杆菌偏爱密码子,替换后在其3'端添加TAA终止序列,合成设计重组蛋白G的基因片段。根据质粒多克隆位点分别设计含BamH1(GGATCC)和EcoR1(GAATTC)两个酶切位点的引物。上游引物:5'-GCGGATCCACTTACAAACTGA-3',下游引物:5'-GCGAATTCTTATTCAGTTACCG-3'。PCR扩增目的片段,反应条件:94℃预变性5 min;92℃变性30 s,55℃退火30 s,72℃延伸90 s,共30个循环;循环结束后72℃延伸10 min。将PCR扩增的目的基因用双酶切连接法克隆至原核表达载体pGEX-2T,转化感受态细胞DH5α后挑菌抽取质粒进行双酶切鉴定和测序鉴定。
1.4 重组质粒的转化和表达 将鉴定正确的重组质粒转化大肠杆菌BL21感受态细胞,挑取单个菌落鉴定后,接种于含50 μg/mL氨苄青霉素LB液体培养基中振荡培养至OD600为0.6时,加入终浓度为1 mmol/L的IPTG进行诱导表达。
1.5 表达产物的可溶性分析 将诱导后的菌液12 000×g离心30 min,收集沉淀,用1×PBS重悬,反复冻融3次后,冰浴超声破碎20 min后离心,收集上清,沉淀用8 mol/L尿素重悬,离心后收集上清。
1.6 重组蛋白G的纯化 使用GST亲和层析柱对表达的重组蛋白进行纯化,收集各段洗脱液样品。
1.7 Western blot检测重组蛋白G与IgG的结合活性将纯化后的带有GST标签的重组蛋白G(rSPG)进行SDS-PAGE电泳之后,电转移至NC膜,进行Western blot。用1∶2000稀释的辣根过氧化物酶标记的山羊抗小鼠IgG作为抗体,HRP-DAB底物显色溶液进行显色。
1.8 ELISA法测定重组蛋白G与不同物种IgG亲和常数 用BCA法测定rSPG的浓度,并用商品化的标准蛋白G(SPG)作为对照。用包被液将蛋白从10 μg/mL 开始进行倍比稀释,共8个稀释度,以100 μL/孔包被96孔板上,每个浓度设3个重复,4℃过夜;PBST洗涤后,用5%脱脂奶粉的PBST溶液(150 μL/)孔,37℃封闭2 h;PBST洗涤,将山羊抗鼠、牛抗鼠、牛抗兔、兔抗鸡这4种二抗,分别按1∶500、1∶1000、1∶2000、1∶4000进行倍比稀释,每孔加入100 μL,37℃孵育2 h;PBST洗涤后,TMB显色,室温反应15 min,2 mol/L H2SO4终止,读取OD450值。用Graphpad Prism 5软件进行拟合曲线,并带入公式:K=(n-1)/(n[Ab]T'-[Ab]T),求出亲和常数K值。
2 结果
2.1 重组蛋白G的原核表达质粒构建 链球菌蛋白G的C区基因序列含有C1、C2、C3三个同源区(图2A),将C1、C2区的基因序列替换为C3区,重构后的蛋白G序列如图2B所示。DNAStar分析表明该基因编码195个氨基酸,理论分子量为21.22 kDa,蛋白质等电点为4.63。构建重组蛋白G的原核表达质粒,并进行PCR鉴定和双酶切鉴定(图3),测序结果显示与设计序列一致,目的基因大小约为600 bp。

图2 重构的链球菌蛋白G C区序列Fig.2 Reconstruction of the C domain sequences of streptococcal protein G(SPG)
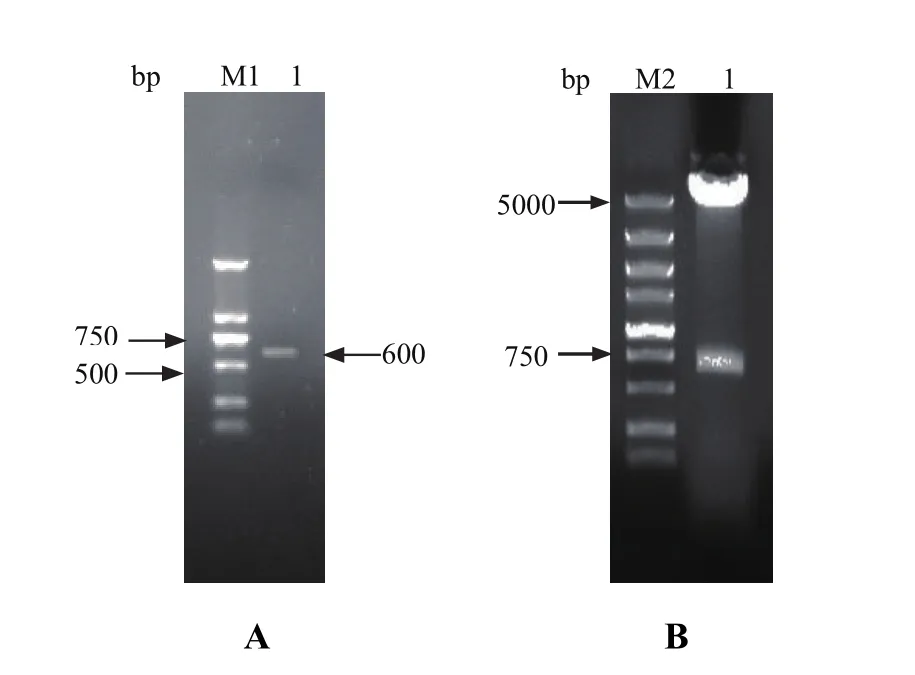
图3 原核表达质粒pGEX-2T-rSPG的鉴定Fig.3 Identifi ed the recombinant plasmid pGEX-2T-rSPG
2.2 重组蛋白G的诱导表达和可溶性鉴定 SDSPAGE分析显示,pGEX-2T-G重组质粒在大肠杆菌BL21中成功表达,诱导6 h后表达量达到最高并趋于稳定。带有GST标签后的重组蛋白G含有422个氨基酸,理论分子量为47.51 kDa,SDS-PAGE显示rSPG分子量约为48 kDa,与预期结果相符,该重组蛋白为水溶性蛋白,属于可溶性表达,未形成包涵体(图4)。

图4 SDS-PAGE分析pGEX-2T-rSPG表达情况Fig.4 SDS-PAGE analysis of the expression of pGEX-2T-rSPG in E.coil
2.3 重组蛋白G的纯化 重组蛋白带有GST标签,采用GST亲和层析柱纯化表达产物,经SDS-PAGE分析,获得较纯的目的蛋白rSPG(图5)。
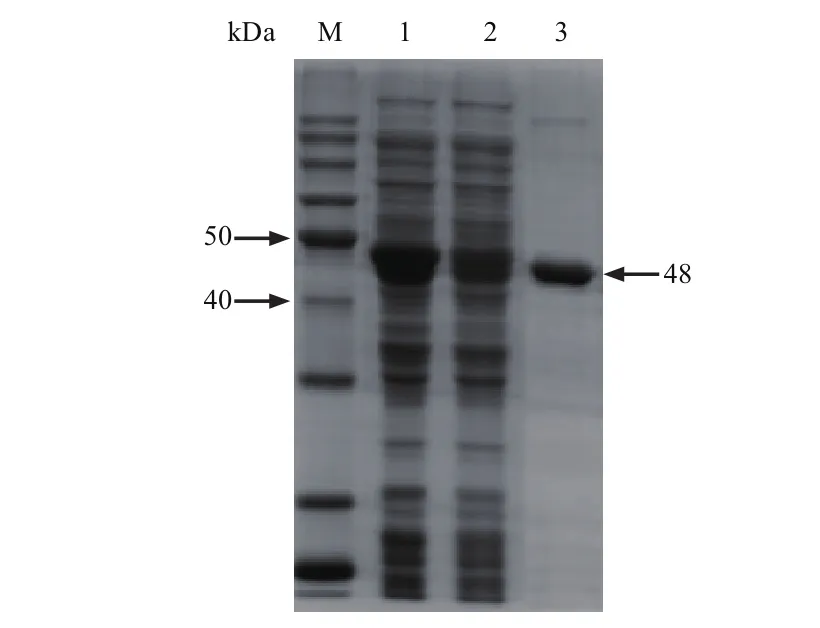
图5 重组蛋白G SDS-PAGE分析Fig.5 SDS-PAGE anlaysis of the purifi cation of rSPG
2.4 重组蛋白G与IgG结合活力测定 Western blot检测rSPG与1∶2000稀释的抗体反应活性,可以观察到在48 kDa呈现出识别条带,证明rSPG具有与IgG结合的能力(图6)。

图6 重组蛋白G的Western blot分析Fig.6 Western blot analysis of the purifi ed rSPG
2.5 与不同物种IgG亲和常数测定 将纯化后的rSPG和作为对照的商品化蛋白G(SPG)测定浓度后,用不同浓度的rSPG和SPG分别包被平板用做抗原,将倍比稀释的不同浓度的抗体加入平板中与抗原相结合。以测得的OD450值为纵坐标,以抗原浓度的对数值为横坐标进行曲线拟合,结果如图7所示。根据拟合的曲线带入公式分别计算亲和常数K,将得到几个不同的K值并取其平均数,得到了rSPG和SPG的亲和常数值,结果见表1。
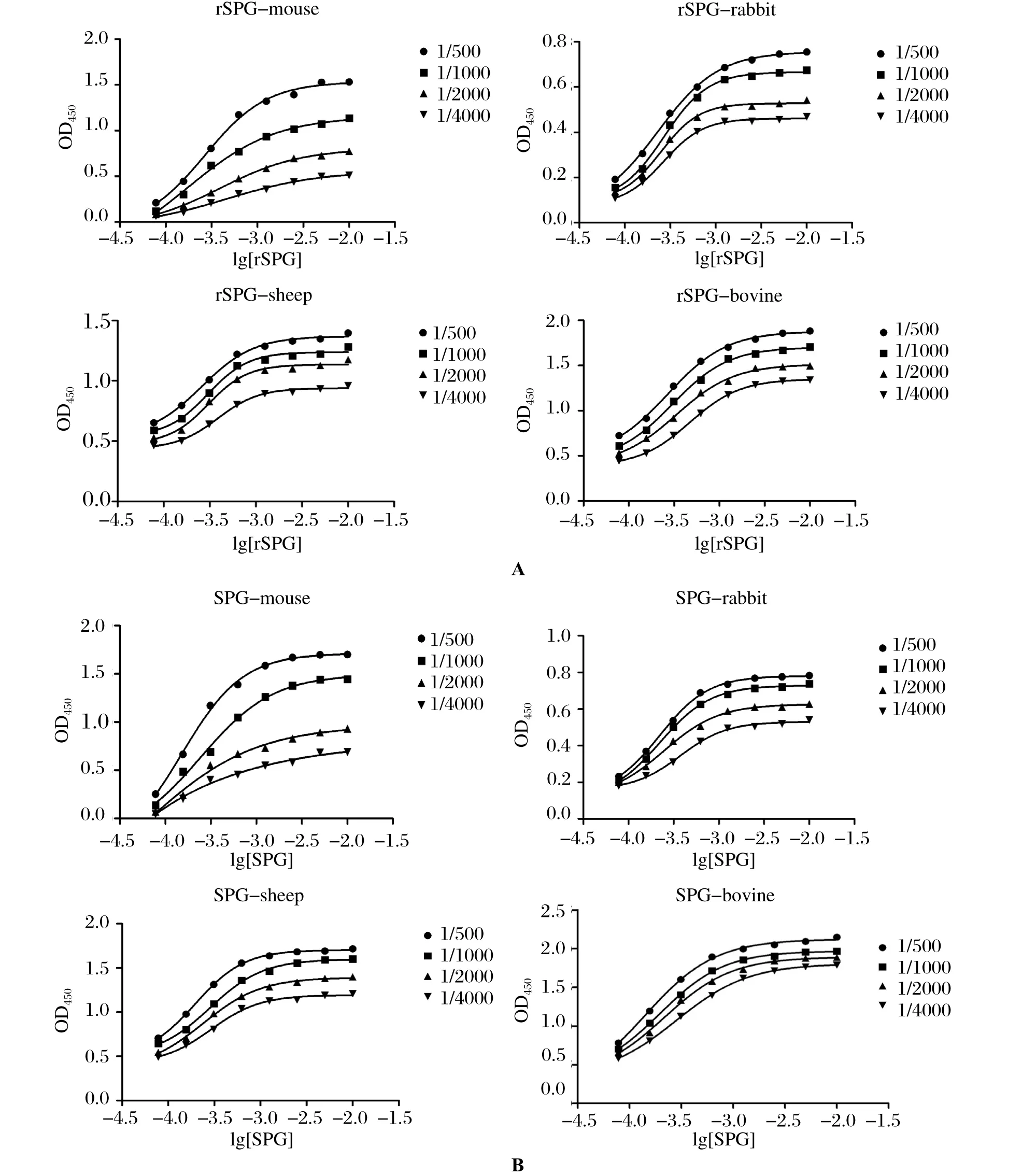
图7 重组蛋白G与不同物种IgG亲和常数测定Fig.7 Determination of affi nity constant of rSPG with IgG from different species

表1 两种链球菌蛋白G的亲和常数Table 1 Affi nity constants of the rSPG and SPG
3 讨论
SPG有与多种动物IgG结合的特性,且与SPA相比有更强的结合能力和更广泛的结合谱,并且不会和IgM、IgD或IgA结合,因此SPG展现出了更强的应用价值。SPG含有与IgG的Fab段以及人血清白蛋白(HSA)结合的A、B区,与抗体IgG的Fab片段结合可影响抗体与抗原的正常结合,与HSA结合可能造成检测的假阳性,因此,本研究将SPG的C区进行重构,以减少非特异性的结合或交叉反应。在重构时,仅保留SPG与IgG的Fc端特异性结合的C区,考虑到C3区与Fc端的结合力高于C1、C2区,所以将C1、C2区用C3区替换,获得一个含C3DC3DC3结构域的重组基因。检测结果显示,这种重构方式提高了重组蛋白G与不同物种IgG的结合能力。
根据Li等[5]的观点,使用频率低于10% 的密码子被定义为稀有密码子,若外源基因中含有大量的稀有密码子,会造成蛋白低表达甚至不表达,故对SPG的C区片段含有的20个稀有密码子进行了优化。经过优化后,重组蛋白在大肠杆菌中高含量表达,且重组蛋白以可溶性蛋白存在于细菌中,占细菌总蛋白的20%。
在目前的研究中,亲和标签已经成为了蛋白纯化的一个重要的工具,本研究选用了谷胱甘肽S-转移酶标签(GST-tag)。有大量的实验表明,外源蛋白在大肠杆菌表达体系中过量的表达常会以包涵体形式存在,而GST标签可以在一定程度上增大重组蛋白的可溶性,有助于后续的蛋白纯化[6]。除此之外,在本研究中,因为目的蛋白分子量较小,GST标签还可以加大分子量,调节重组蛋白的等电点,有利于进行其他后续的实验。
亲和常数可以表示分子间相互作用的强度,是对分子之间相互作用最本质的描述。某两个蛋白相互作用的亲和常数越大,说明这两个蛋白的亲和力越大。高亲和力的抗体对于定量检测及导向诊治有帮助,而低亲和力的抗体用于免疫纯化较合适。亲和力的大小可以通过亲和常数Ka(或反应的平衡常数)来表示,即:
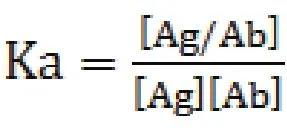
表示抗原抗体复合物的浓度,[Ag]表示抗原的浓度,[Ab]表示抗体的浓度。本研究首先通过Western blot检测证实rSPG能与抗体IgG结合。然后通过ELISA法代入公式得到rSPG、商品化蛋白G(SPG)与IgG的亲和常数,结果显示与SPG相比,rSPG与牛和山羊的IgG抗体结合能力更强,有显著统计学意义(P<0.05)。另外,rSPG与兔、鼠IgG的亲和力也高于商品化蛋白G。
链球菌蛋白G由于具有广泛的与不同物种抗体IgG特异性结合的特性,目前在应用方面已经显示出了巨大的潜力,主要应用于免疫学和免疫化学方面。在ELISA方面,SPG可替代二抗,具有特异性强、敏感性高、用量少的特点,并且可以很好的替代SPA[7]。裴福全等[8]使用辣根过氧化酶标记的链球菌蛋白G作为快速ELISA的酶标二抗,检测人血清中的华支睾吸虫特异性抗体,显示出了高度的特异性和敏感性。在亲合层析时,SPG还可以与Sepharose结合,组装成亲合层析柱,用于分离纯化各种IgG;同时,用SPG制备固相抗体用于放射分析,显示出SPG是一种良好的固相抗体制备介质[9]。在胶体金免疫层析方面,Bendayan等[10]将SPG与胶体金结合,再复合多种单克隆或多克隆抗体,用来定位各种抗原位点,结果显示,金标SPG对各种受试哺乳动物的抗体都能稳定结合。因此,SPG-胶体金是细胞免疫化学上一种更好的多功能高分辨率探针。此外,Fowler等[11]将特异性的抗体锚定于硫醇盐化的重组SPG支架上,作为电化学免疫感受器的一部分,用来高效捕获被分析物,也取得了良好的效果。
本研究成功获得了重组链球菌蛋白G,不但保留了链球菌蛋白G能与IgG特异性结合的特性,而且在此基础上又提高了其与IgG的结合力,是一个很好的标记抗体的工具,可以在其他相关的实验中得到广泛应用。
[1]Bjorck L, Kronvall G. Purification and some properties of streptococcal protein G,a novel IgG-binding reagent[J]. J Immunol, 1984, 133(2)∶ 969-974.
[2]曹之舫. 链球菌蛋白 G—一种优于葡萄球菌蛋白A的IgG结合物[J]. 国外医学微生物学分册, 1989, 12(5)∶ 213-215, 225.
[3]Sjobring U, Bjorck L, Kastern W, et al. Streptococcal Protein G, gene structure and protein binding properties[J]. J Biol Chem, 1991, 266(1)∶ 399-405.
[4]Kobatake E, Nishimori Y, Ikariyama Y, et al. Application of a fusion protein, metapyrocatechase/protein A, to an enzyme immunoassay[J]. Anal Biochem, 1990, 186(1)∶14-18.
[5]Li A, Kato Z, Ohnishi H, et al. Optimized gene synthesis and high expression of human interleukin-18[J]. Protein Expr Purif, 2003, 32(1)∶ 110-118.
[6]陈爱春, 彭伟, 汪生鹏. 亲和标签在重组蛋白表达纯化中的应用[J]. 中国生物工程杂志, 2012, 32(12)∶ 93-103.
[7]靳晓红, 初晓翠, 孙长柱. 链球菌G蛋白的特性及应用前景[J]. 上海免疫学杂志, 1997, 17(2)∶ 121-125.
[8]裴福全, 崔惠儿, 方悦怡, 等. 链球菌蛋白G-ELISA用于华支睾吸虫病诊断的方法初探[J]. 华南预防医学, 2007,33(6)∶ 37, 42.
[9]高云朝, 吴洪芳, 秦成生. 链球菌蛋白G在固相放射免疫分析中的应用[J]. 中华微生物学和免疫学杂志, 2000,20(6)∶ 601.
[10]Bendayan M, Garzon S. Protein G-gold complex∶comparative evaluation with protein A-gold for highresolution immunocytochemistry[J]. J Histochem Cytochem, 1988, 36(6)∶ 597-607.
[11]Fowler J M, Stuart M C, Wong D K. Comparative study of thiolated Protein G scaffolds and signal antibody conjugates in the development of electrochemical immunosensors[J]. Biosens Bioelectron, 2007, 23(5)∶633-639.
RECONSTRUCTION, EXPRESSION AND IDENTIFICATION OF A STREPTOCOCCAL PROTEIN G DOMAIN
XU Rui1, ZHAO Deng-yun1, HONG Yang1, LU Ke1, LI Hao1, LIN Jiao-jiao1,2, FENG Jin-tao1,XU Yu-mei3, ZHU Chuan-gang1
(1. Natural Laboratory of Animal Schistosomiasis Control, Key Laboratory for Animal Parasitology, Ministry of Agriculture, Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China; 2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China; 3. Shanghai Xuhui Central Hospital, Shanghai 200031, China)
Streptococcal protein G can bind to Fc domain of IgG of many species. This function has been widely applied in immunological experiments. In the present study, the genetic fragment coding for streptococcal protein G (SPG) was subcloned into pGEX-2T and then GST-taggged fusion protein was expressed in Escherichia coli BL21 cells. The recombinant SPG (rSPG) showed the ability to bind with IgG in Western blot and even higher affi nity for IgG of four animal species (cattle, goats, rabbits and mice)in ELISA than commercially available SPG. The results demonstrated that the rSPG was an excellent tool for the usage in IgG related studies.
Streptococcal protein G; reconstruction; affi nity
S852.616
A
1674-6422(2015)05-0046-07
2015-07-15
许瑞,女,硕士研究生,预防兽医学专业
朱传刚,E-mail: zcg@shvri.ac.cn

