副猪嗜血杆菌外膜蛋白PlpD基因的原核表达及免疫保护性分析
刘秋菊,王 湘,李芸芳,黎满香
(湖南农业大学动物医学院,长沙 410128)
副猪嗜血杆菌外膜蛋白PlpD基因的原核表达及免疫保护性分析
刘秋菊,王 湘,李芸芳,黎满香
(湖南农业大学动物医学院,长沙 410128)
为研究副猪嗜血杆菌PlpD基因的免疫保护性,根据GenBank上已公布的PlpD基因序列设计该基因的特异性引物,以本实验室保存的副猪嗜血杆菌5型菌株为模板,PCR扩增目的片段,构建重组质粒pET28-PlpD,并将其转至表达菌BL21(DE3)中进行诱导表达。SDS-PAGE电泳检测显示,在温度为16℃时使用终浓度为1 mmol/L IPTG诱导12 h,目的蛋白可溶性表达量最高,Western blot结果表明该目的蛋白具有较好的反应原性。将获得的融合蛋白PlpD进行纯化后制备成亚单位疫苗,经腹腔注射免疫小鼠,3免后用高于副猪嗜血杆菌的致死剂量1.5×109CFU进行攻毒,结果显示PlpD基因对小鼠具有一定的免疫保护性。
副猪嗜血杆菌;PlpD基因;克隆;表达;免疫保护
副猪嗜血杆菌(Haemophilus parasuis, Hps)是一种革兰氏阴性菌,可引起以纤维性多浆膜炎和关节炎为特征的格氏病[1]。Hps在猪群中很常见,它是仔猪上呼吸道的一个早期寄居菌,通过伴随分娩时与母猪的接触而获得[2],是构成猪正常呼吸菌群的成员之一[3]。在健康状态下,Hps的定居与免疫之间会达成一个平衡,当这种平衡打破后可引起格氏病的发生[4]。
Kielstein等[5]研究证明Hps血清型至少可分为15种,我国最为流行的血清型为4型(24.2%)和血清5型(19.2%),除此之外,还有大约25%的分离株无法分型[6]。Cerda-Cuellar等[7]研究发现在同一猪场中所分离的Hps菌株多样性及周转量都很高。Hps菌株的多血清型及多样性给该病的防治带来了很大的困难,并且不同血清型,甚至同一种血清型的交叉保护也是多变的,因而更难控制该病的流行[8]。因此,研制出一种能够针对多数血清型或者主要流行血清型的Hps疫苗将对该病的防治具有重要意义。
外膜蛋白(outer membrane protein,Omp)是Hps的重要毒力因子之一,在其致病过程中发挥着重要作用[9]。本研究通过设计引物,对外膜蛋白PlpD进行了原核表达,分析了该蛋白的反应原性及免疫保护性,为之后对PlpD蛋白的研究奠定了基础。
1 材料与方法
1.1 材料
1.1.1 菌株、主要试剂和试验动物 Hps血清5型菌株由湖南农业大学动物医学院传染病实验室分离鉴定后保存[10];大肠杆菌BL21(DE3)、DH5α、pET-28a(+)原核表达载体及Hps血清由湖南农业大学动物医学院传染病实验室保存;实验动物为昆明品系SPF级雌性小鼠,购于湖南斯莱克景达实验动物有限公司;pfu高保真酶、DNA Marker、中分子量预染蛋白Marker、限制性内切酶SalⅠ以及EcoRⅠ均购自宝物工程有限公司;PCR产物纯化试剂盒、质粒提取试剂盒购自OMEGA公司。
1.2 方法
1.2.1 Hps-PlpD基因引物的设计 根据GenBank中Hps血清5型SH0165菌株序列(登录号:CP001321.1),使用Lasergene软件中的Protean功能挑选出PlpD外膜蛋白并设计针对该蛋白基因的上下游引物,分别在上游引物引入EcoRⅠ位点,下游引物引入SalⅠ位点。PlpD FP∶ GTGAATTCATGAGTA AGGTGTCCGATGAGGGTA; PlpD RP∶ CTGTCGAC TTTATTTAGCTGGATTATATGAAGGAGTTTG。下划线部分为酶切位点。引物由华大基因有限公司合成。
1.2.2 目的基因的PCR扩增 以实验室保存的Hps血清5型菌株为模板,使用高保真酶进行PCR扩增,扩增条件:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,32个循环;72℃延伸10 min。预期扩增片段长度为774 bp。PCR扩增产物用琼脂糖凝胶电泳进行检测。
1.2.3 pET28-PlpD重组质粒的构建及阳性转化子的挑取 将PCR产物用清洁试剂盒纯化回收,回收产物与表达载体pET-28a(+)均用EcoRⅠ和SalⅠ双酶切,酶切后再次清洁回收,产物用T4连接酶于22℃水浴中连接30 min,随后转入大肠杆菌感受态DH5α,用Hps PlpD基因的特异性引物筛选阳性转化子。
1.2.4 pET28-PlpD重组质粒的双酶切鉴定及序列测定 将PCR鉴定为阳性的菌落用含有30μg/mL卡那霉素的LB液体培养基小量增菌10 mL并提取质粒,用EcoRⅠ和SalⅠ对提取的质粒进行双酶切鉴定,酶切产物用1%琼脂糖凝胶电泳检测。鉴定为阳性的质粒送华大基因有限公司进行测序及序列分析,将序列测定正确的重组质粒命名为pET28-PlpD。
1.2.5 PlpD基因的蛋白诱导表达 将重组质粒pET28-PlpD转入大肠杆菌感受态BL21(DE3),挑阳性转化子用Hps PlpD基因的特异性引物进行PCR鉴定。鉴定为阳性的菌落接种于含30μg/mL卡那霉素的LB液体培养基中,37℃摇床以250 r/min培养过夜。菌液按1∶100的比例大量增菌培养至OD600达0.6左右时,加终浓度1mmol/L的IPTG,37℃摇床中180 r/min诱导5 h。同时设置未转入质粒的BL21(DE3)作为阴性对照。
1.2.6 pET28-PlpD表达蛋白的SDS-PAGE电泳及Western blot检测 诱导完成后离心收集细菌,用1/20初始菌液体积的1×PBS重悬,然后置于冰水混合物上进行超声裂解,4℃、10 800×g离心5 min,分别收集上清和沉淀。沉淀用等量的1×PBS重悬,用2×SDS蛋白上样Buffer处理样品,最后将处理好的上清、沉淀以及阴性对照样品进行SDS-PAGE电泳检测。最后用Western blot方法检测蛋白的反应原性。
1.2.7 PlpD重组蛋白纯化 将细菌超声裂解后低温离心,取上清利用镍离子柱亲和层析方法对蛋白进行纯化,上样后用3倍介质体积的30 mmol/L咪唑洗涤吸附的杂蛋白,再用3倍介质体积的500 mmol/L咪唑将目的蛋白洗脱下来,最后进行SDS-PAGE电泳检测。
1.2.8 PlpD重组蛋白免疫保护性分析 测定纯化后PlpD重组蛋白的浓度,加入氢氧化铝佐剂配制疫苗,采用皮下注射的方式以50 μg/只的剂量免疫6只4周龄左右的雌性昆明小鼠,每隔15 d免疫1次,共免疫3次,并设置两个对照组,分别注射等剂量的生理盐水及商品化疫苗。3免后d3对小鼠进行攻毒,以高于Hps致死剂量1.5×109CFU腹腔注射小鼠,观察并记录1周内小鼠的健康状况。
2 结果
2.1 PCR扩增PlpD基因 以保存的Hps血清5型菌株为模板,使用高保真酶进行PCR扩增,扩增完后用1%琼脂糖凝胶电泳进行检测,最终得到1条与预期目的片段大小相符的特异性条带,约为774 bp(图1)。

图1 PlpD基因PCR扩增产物电泳结果Fig.1 PCR product of PlpD gene
2.2 pET28-PlpD重组质粒测序及酶切鉴定 pET28-
PlpD重组质粒用EcoR I和Sal I双酶切,将酶切产物进行1%琼脂糖凝胶电泳检测,得到两条大小与预期相符的片段(图2),结果表明重组质粒构建成功。pET28-PlpD重组质粒测序的结果与GenBank中发表的Hps血清5型序列的同源性高达98%以上。

图2 pET28-PlpD重组质粒的酶切鉴定Fig.2 Identification of recombinant plasmid pET28-PlpD by enzyme digestion
2.3 PlpD重组蛋白的SDS-PAGE鉴定及Western blot分析 重组表达菌经SDS-PAGE电泳显示,有特异性目的蛋白的表达,大小约为29 kDa,与预期一致。在16℃诱导12 h时,目的蛋白实现了高效可溶性表达。Western blot结果显示,该目的蛋白能与Hps的阳性血清发生特异性反应,具有一定的反应原性(图3)。
2.4 PlpD重组蛋白纯化 使用镍离子柱亲和层析的方法对重组蛋白进行纯化,获得较纯的目的条带(图4)。
2.5 PlpD重组蛋白免疫保护性分析 对3免后的小鼠以高于Hps的致死剂量攻毒后6 h,小鼠均开始呈现临床症状,表现出扎堆、精神萎靡。随着病程的延长逐渐表现为颤栗、食欲不振,无饮欲,眼角分泌物增多,呼吸频率加快并且呈现出典型的腹式呼吸,随后呼吸频率逐渐减慢、减弱。最后实验组中4只小鼠出现强烈的全身抽搐、痉挛并陆续死亡,2只小鼠于攻毒后36 h开始恢复正常并存活下来,两个对照组中小鼠全部死亡(表1)。

图3 PlpD重组蛋白SDS-PAGE电泳和Western blot分析Fig.3 SDS-PAGE and Western blot analysis of the recombinant PlpD protein
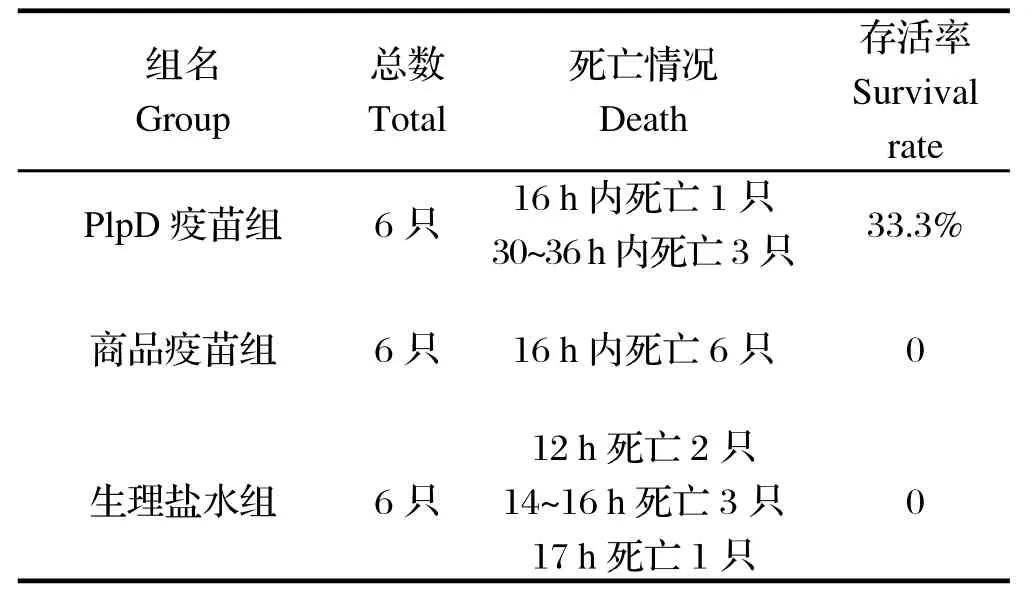
表1 小鼠保护性试验结果Table 1 The immune protective effect of recombinant PlpD protein against Hps for mice
3 讨论
以Hps为病原的格氏病在我国流行较为广泛,给养猪业带来很大的损失。由于Hps血清型多,菌株之间毒力差异大等特点,目前并没有适应面较广的疫苗对其进行有效防控。为此,本研究对该细菌的一种潜在的具有抗原保护性的外膜蛋白进行了克隆和表达,并对其抗原反应性进行初步分析,以期能为新型疫苗的研究和开发提供依据。

图4 PlpD重组蛋白纯化的SDS-PAGE电泳分析Fig.4 SDS-PAGE analysis of purifi ed PlpD recombinant protein
本研究使用PCR方法扩增得到PlpD基因的目的片段,并将其插入到pET-28 a(+)中,构建重组质粒,最终将其转入表达菌BL21(DE3)中进行诱导表达并分析其抗原反应性及免疫保护性。最初,将PlpD全长基因进行克隆和表达,结果未能获得目的蛋白。随后对该蛋白使用在线软件SinaIP 4.1 Server(http∶//www.cbs.dtu.dk/services-/SignalP/)预测其疏水区域以及信号肽区域,结果发现目的蛋白虽没有信号肽区域,但是在PlpD蛋白氨基酸序列N端有一段长为24个氨基酸的疏水区域,这可能是该蛋白无法表达的原因。通过设计引物,将编码该疏水区域的24个氨基酸基因序列去掉,重新构建新的pET28-PlpD重组质粒,转入表达菌BL21(DE 3)中再次进行诱导表达,最终获得大小约为29 kDa的目的蛋白片段。
在对重组PlpD蛋白进行诱导表达时,该重组蛋白在37℃诱导时以包涵体形式表达。通过对诱导温度、诱导时间以及IPTG浓度进行摸索发现,当温度低于25℃时,可以获得该重组蛋白的可溶性表达形式,其中IPTG浓度改变对其影响不大,最终确定重组PlpD蛋白的最佳诱导表达条件为16℃诱导12 h,在此条件下,目的蛋白实现了高效可溶性表达。
以高于Hps的致死剂量1.5×109CFU对3组昆明小鼠进行攻毒,其中PlpD重组蛋白免疫小组中,攻毒后16 h时死亡1只小鼠,30~36 h内死亡3只,2只发病后逐渐康复;商品化疫苗组16 h内小鼠全部死亡;注射生理盐水组12 h内死亡2只,14~16 h死亡3只,17 h死亡1只。商品化疫苗组全部死亡的可能原因有如下几点,其一,该商品化疫苗使用的是油性佐剂,皮下注射小鼠后会在局部形成包块,在一定程度上影响了小鼠的生长,因此该组小鼠的平均体重始终低于其他小组,致使小鼠的自身免疫力下降;其二,该商品化疫苗所使用的菌株为不同的亚型;其三,本研究中所攻毒的剂量过高,该商品化疫苗免疫后对小鼠产生的保护力不够。
由结果可知,注射PlpD重组蛋白免疫小组相对于另外两组发病时间及死亡时间均较晚,存活率为33.3%,可见,Hps的外膜蛋白PlpD具有一定的抗原保护性,但在本研究中未与其他外膜蛋白的保护性进行比较,PlpD重组蛋白对不同Hps血清型交叉保护性也有待进一步研究。
本研究成功构建了PlpD基因的原核表达质粒,并通过对表达条件的优化使得重组PlpD蛋白获得高效可溶性表达,Western blot检测显示该重组蛋白具有良好的反应原性,小鼠的保护性试验证明该重组蛋白具有一定的免疫保护性。
[1]刘俊琦, 余兴龙, 蒋大良, 等. 副猪嗜血杆菌Neu基因的克隆表达及表达产物的免疫原性[J]. 中国兽医科学, 2010,40(8)∶ 822-826.
[2]Amano H, Shibata M, Kajio N, et al. Pathologic observations of pigs intranasally inoculated with serovar 1, 4 and 5 of Haemophilus parasuis using immunoperoxidase method[J]. J Vet Med Sci, 1994,56(4)∶ 639-644.
[3]Oliveira S, Pijoan C. Haemophilus parasuis∶ new trends on diagnosis, epidemiology and control[J]. Vet Microbiol,2004, 99(1)∶ 1-12.
[4]Riley M G, Russell E G, Callinan R B. Haemophilus parasuis infection in swine[J]. J Am Vet Med Assoc,1977, 171(7)∶ 649-651.
[5]Kielstein P, Rosner H, M üller W. Typing of heat-stable soluble haemophilus parasuis antigen by means of agargel precipitation and the dot-blot procedure[J]. Zentralbl Veterinarmed B, 1991, 38(4)∶ 315-320.
[6]蔡旭旺, 刘正飞, 陈焕春, 等. 副猪嗜血杆菌的分离培养和血清型鉴定[J]. 华中农业大学学报, 2005, 24(1)∶ 55-58.
[7]Cerdà-Cuéllar M, Naranjo J F, Verge A, et al. Sow vaccination modulates the colonization of piglets by Haemophilus parasuis[J]. Vet Microbiol, 2010, 145(3)∶315-320.
[8]朱晓明, 邹垚, 陈攀, 等. 副猪嗜血杆菌不同血清型稳定表达蛋白的筛选及间接ELISA检测方法的建立[J]. 中国兽医科学, 2015, (1)∶ 12.
[9]朱必凤, 杨旭夫, 彭凌, 等. 副猪嗜血杆菌外膜蛋白表型分析[J]. 畜牧兽医学报, 2012, 43(3)∶ 496-502.
[10]朱小宁, 余兴龙, 李润成, 等. 副猪嗜血杆菌的分离与鉴定及其16S rRNA生物信息学分析[J]. 湖南农业大学学报∶ 自然科学版, 2009, 35(5)∶ 517-520.
PROKARYOTIC EXPRESSION AND IMMUNE PROTECTION OF OUTER MEMBRANE PROTEIN PLPD OF HAEMOPHILUS PARASUIS
LIU Qiu-ju, WANG Xiang, LI Yun-fang, LI Man-xiang
(College of Veterinary Medicine, Hunan Agricultural University, Changsha 410128, China)
In order to study the immune protection of PlpD of Haemophilus parasuis(Hps), specifi c primers were designed according to the published information and the genomic sequence of serotype type 5 of Hps kept in our laboratory was used as template for PCR amplifi cation. Subsequently, the recombinant expression plasmid was constructed and transformed into E. coli BL21(DE3) for expression of PlpD protein. After induction with 1mmol/L IPTG for 12 h at 16℃, the recombinant PlpD protein was expressed abundantly as detected in SDS-PAGE. Western blot analysis showed that the expressed protein had good immunoreactivity. The recombinant PlpD was purifi ed for preparation of subunit vaccine that was used to intraperitoneally immunize mice three times. The immunized mice were then challenged with 1.5×109CFU of Hps and some degree of protection was observed.
Haemophilus parasuis; PlpD gene; cloning; expression; immunoreactivity
S852.61
A
1674-6422(2015)05-0053-05
2015-07-15
湖南省科技计划项目(2015NK3017)
刘秋菊,女,硕士研究生,预防兽医学专业
黎满香,E-mail:manxiangl@163.com

