负载型Pt-Ni双金属催化剂上甘油氢解反应性能
怀 强,江 涛,曹发海
华东理工大学化工学院,上海 200237
随着环境立法的日益严格,人们正在寻找一种能替代化石燃料的能源,生物柴油中不含硫、氮等杂原子,又具有较高的十六烷值,是理想的柴油燃料替代物。目前,生物柴油主要是由甘油三酸酯通过酯交换得到脂肪酸甲脂,反应过程中副产较多的甘油。因此,甘油通过催化转化,尤其是将甘油氢解转化为高附加值化学品已经引起了学术界的广泛关注[1-4]。
甘油分子结构中含有两个C-C 键和三个C-O 键,氢解过程中会引起C-C 键或C-O 键的断裂。C-O键断裂后的主要产物为1,2-丙二醇(1,2-PDO)和1,3-丙二醇(1,3-PDO);C-C 键断裂后的主要产物为乙二醇(EG)和甲醇。
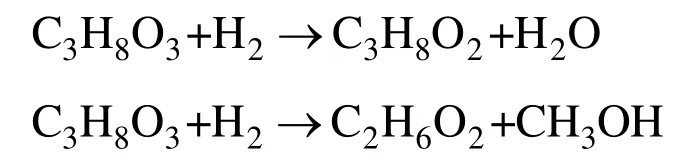
目前,研究者更多的关注经由C-O 键的断裂生产1,2-丙二醇和1,3-丙二醇[5-11]。如果能以甘油为原料进行氢解,高选择性的制备乙二醇,无疑会形成一条新的乙二醇制备路线。Ji 等[12-14]使用Ni 促进的W2C 催化剂,在搅拌釜式反应器中进行了纤维素氢解制乙二醇的研究。Ueda 等[15]采用Pt 改性的Ni/γ-Al2O3作为甘油氢解制乙二醇的催化剂,在搅拌釜式反应器中考察了反应性能。Yin 等[16]在釜式反应器中,采用Raney Ni 催化剂进行甘油氢解。Wu 等[17]发现在共沉淀法制备的Pd/Fe2O3催化剂上,乙二醇和甘油能高选择性的通过C-C 键的断裂而得到甲醇,并认为Pd-Fe 合金簇以及金属与载体之间的相互作用能够调控对C-C 键的高效断裂。
本研究采用等体积浸渍法制备γ-Al2O3负载的Pt-Ni 双金属催化剂,考察该催化剂上甘油氢解反应的性能与催化剂结构特征的相互关系,探讨不同Pt、Ni 负载量的催化剂对甘油氢解的影响。
1 实验部分
1.1 催化剂的制备与表征
采用等体积浸渍法制备γ-Al2O3负载的Pt-Ni 双金属催化剂。移取一定量浓度为0.1 g/mL 的氯铂酸溶液,加入放有一定量硝酸镍的小烧杯中,搅拌,待硝酸镍充分溶解后,在搅拌下将γ-Al2O3载体加入其中,搅拌均匀,静置浸渍24 h 后,在383 K 真空条件下干燥12 h,再在773 K 空气气氛中焙烧3 h。催化剂制成后,过筛,取粒径80~100 目的催化剂待反应使用。不同含量的Pt-Ni/γ-Al2O3催化剂用符号aPtbNi 表示,其中a和b分别表示Pt-Ni/γ-Al2O3中Pt 和Ni 的质量分数。
采用X 射线粉末衍射仪(XRD,D8 Advance)测试分析催化剂的晶体物相种类,辐射源是Cu 靶,陶瓷X 光管,功率为2.2 kW,对催化剂样品的扫描速率为10 (°)/min。采用Quanta chrome 物理吸附仪测定催化剂的比表面积和孔结构特性(BET)。样品经过493 K 和小于0.1 MPa 真空脱气12 h 处理后,在液氮温度下进行氮气吸附-脱附测定。采用透射电子显微镜(TEM,JEM-2100)观察催化剂的金属分散度、金属粒子大小。加速电压为80~200 KV,放大倍数为50~150 万倍。H2程序升温还原(H2-TPR)测试在内径为7 mm 的石英管中进行,取样品80 mg,使用10%的H2/Ar 作还原气,流速为90 mL/min,以15 K/min 升至1 073 K,联分析软件检测。使用ESCALAB 250Xi 型能谱仪进行催化剂的X 射线光电子能谱分析(XPS),确定催化剂中各元素的价态。
1.2 催化剂的性能评价
催化剂的性能评价在固定床反应器中进行。固定床不锈钢管反应器长360 mm,内径16 mm,催化剂用量2.0 g。反应前,先通入氢气(氢气流量150 mL/min),并以2 K/min 的速率从室温升至723 K,将催化剂在常压下恒温还原5 h。还原结束后冷却至473 K 并恒温保持下去,调整氢气流量为200 mL/min,系统压力为3.0 MPa,此时启动平流泵开始进料(料液为20%的甘油水溶液,流量为0.05 mL/min),料液自上而下注入反应器。此时开始计时,10 h 后,待系统稳定后从储液罐放出反应液。此后,每隔1~2 h 取样分析,直到前后两次的取样分析结果没有明显变化为止。
液相产物采用配备PEG-20M 型毛细管色谱柱(30 m×0.32 mm×0.5 μm)的GC900C(FID)气相色谱分析。反应尾气采用带有TCD 检测器的气相色谱仪进行分析,柱中填料为TDX-01 担体,载气为He。
甘油转化率表示为:反应消耗甘油的质量与原料液中甘油质量的比值;产物的选择性表示为:转化为目标产物的甘油质量与反应所消耗甘油总质量的比值。
2 结果与讨论
2.1 不同催化剂对甘油氢解反应产物分布的影响
在前面所述的催化剂性能考评实验条件下,不同Pt、Ni 负载量催化剂上的甘油转化率和产物的选择性如表1所示。实验结果表明,1%Pt/γ-Al2O3催化剂会催化甘油水溶液发生重整反应,生成H2(表1中未列出),经检测,在473 K,氢气压力3.0 MPa 的条件下,甘油催化重整所产生的氢气的选择性为78.2%,与文献[18]中使用0.9%Pt/γ-Al2O3进行甘油水溶液重整反应所得氢气60%~80%的选择性相吻合。对于10%Ni/γ-Al2O3催化甘油氢解的反应,乙二醇和1,2-丙二醇的选择性分别为10.1%和80.3%,与van Ryneveld 等[19]使用Ni/γ-Al2O3催化剂,在503 K,6.0 MPa 氢气压力下氢解甘油,1,2-丙二醇79.9%的选择性很接近,而文献中乙二醇的选择性为3.1%,低于本研究中的10.1%。
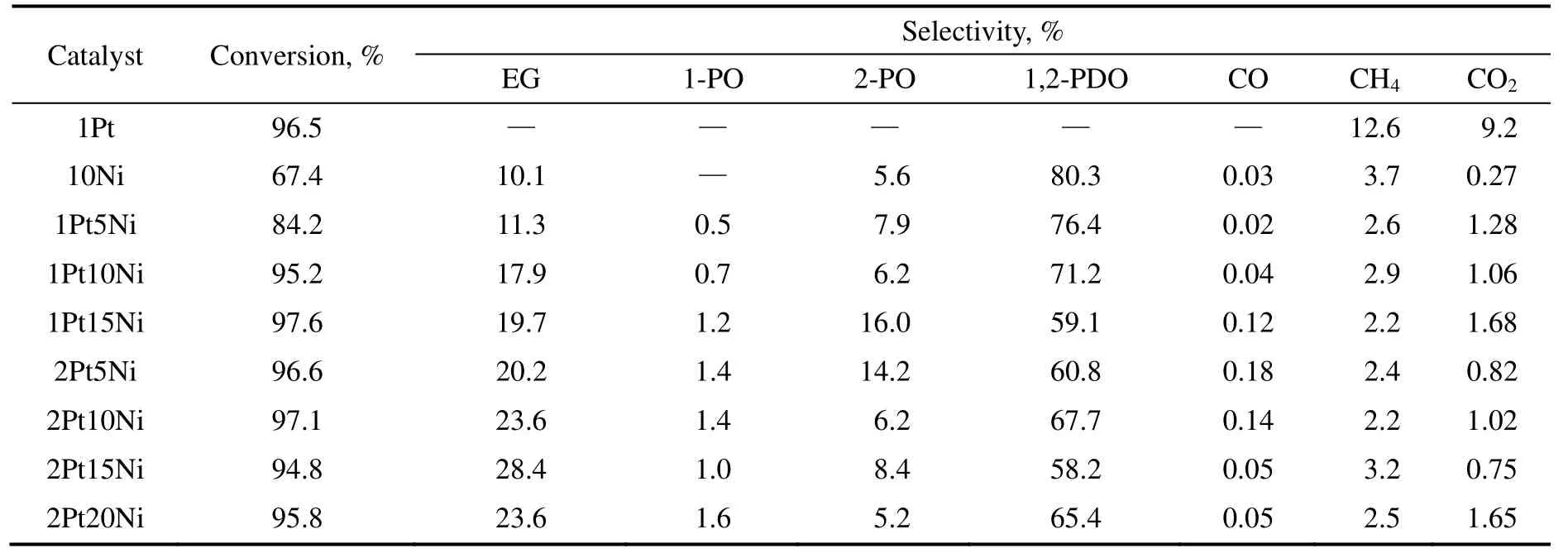
表1 不同催化剂对甘油氢解反应产物分布的影响Table 1 Effect of different catalysts on the product distributions of the glycerol hydrogenolysis
对于γ-Al2O3负载的Pt-Ni 双金属催化剂而言,随着催化剂中Pt、Ni 含量的增加,即从1Pt5Ni 催化剂到2Pt15Ni 催化剂,甘油的转化率从84.2%增加到97.6%,乙二醇的选择性从10.1%增加到28.4%,这说明Pt-Ni 双金属催化剂的催化氢解作用随着Pt、Ni 含量的增加而增强,催化剂断裂C-C 键的能力也逐渐增强。本研究中甘油的转化率达到97.6%,远高于Ueda 等[15]用少量的Pt 促进Ni/γ-Al2O3催化剂氢解甘油时16%的转化率,但是本研究中乙二醇选择性的最大值为28.4%,低于文献中的48%。而对于1Pt5Ni、1Pt10Ni、1Pt15Ni 三种催化剂来说,随着Ni 含量的增加,产物中异丙醇的含量也随着增加,达到16.0%的最高点之后,又随着Pt 含量的增加而降低,这可能是由于随着Pt 含量的增加,催化剂对C-C 键的断裂能力增加,而对C-O 键的断裂能力降低所致。对于2Pt20Ni 催化剂来说,随着催化剂中Ni 含量的继续增加,乙二醇的选择性较2Pt15Ni 催化剂有所降低。本研究中2Pt10Ni 催化剂和2Pt15Ni 催化剂是对乙二醇选择性较高的催化剂,后续的实验研究选择该两种催化剂进行表征。
此外,不论对于单金属催化剂还是双金属催化剂,甘油氢解反应都会产生一些气体产物,包括CO、CH4、CO2,这是由于甘油的过度裂解所导致的,可以通过控制反应条件来抑制。
2.2 反应条件对反应产物分布的影响
热力学分析表明[20],甘油氢解是吸热反应,高温对甘油裂解有促进作用,同时较高的系统压力也会对反应有利。但温度过高,会生成较多一氧化碳、二氧化碳和甲烷。本研究选择2Pt15Ni 催化剂,考察2Pt15Ni 催化剂的甘油氢解催化性能,确定反应条件对产物分布的影响。
2.2.1 反应温度
当氢气压力为3.0 MPa,料液为质量分数20%的甘油水溶液,进料流量为0.05 mL/min,氢气流量为200 mL/min,不同反应温度下的实验结果如表2所示。
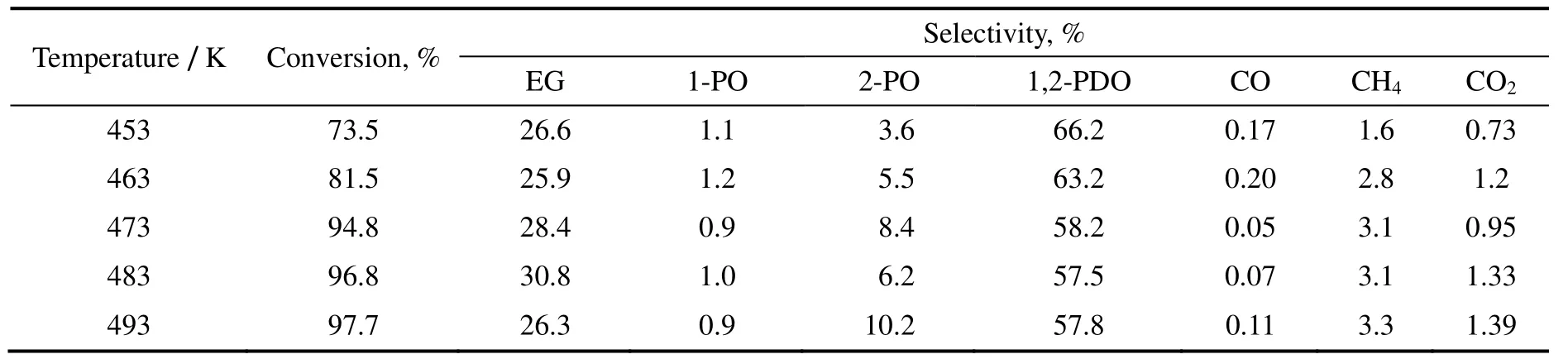
表2 反应温度对甘油氢解产物分布的影响Table 2 Effect of reaction temperature on the product distributions of glycerol hydrogenolysis
温度对甘油氢解反应活性和产物分布影响作用明显。由表2可知,在一定压力下,随着温度上升,甘油转化率从73.5%上升到97.7%;1,2-丙二醇的选择性则从66.2%逐步下降至51.8%,而乙二醇的选择性则呈现先上升后下降的趋势,即从26.6%上升到最大值30.8%,继而又下降到26.3%。这表明温度的上升有利于提高甘油的转化率,抑制1,2-丙二醇生成,故473 K 可看作是生成乙二醇的适宜温度。
2.2.2 反应压力
当反应温度为473 K,料液为20%的甘油水溶液,进料流量为0.05 mL/min,氢气流量为200 mL/min,不同压力下的甘油氢解反应转化率和产物的选择性如表3所示。由表3可知,压力的升高促进了丙二醇的生成,在一定温度下,随着压力的上升,甘油转化率从94.8%上升到97.5%;1,2-丙二醇的选择性则从52.2%上升至62.0%,而乙二醇选择性变化不明显。
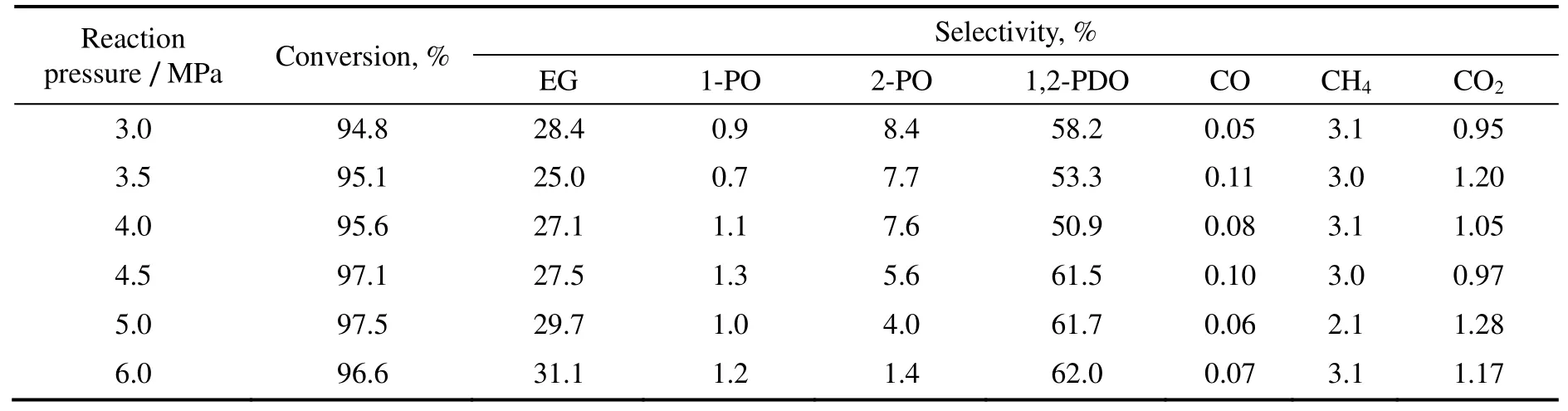
表3 反应压力对甘油氢解产物分布的影响Table 3 Effect of reaction pressure on the catalytic activities of Pt-Ni catalysts
2.3 催化剂的表征
2.3.1 X 射线衍射
γ-Al2O3载体和Pt-Ni 双金属催化剂的XRD 表征结果如图1所示。对于2%Pt-10%Ni/γ-Al2O3的XRD图谱,在衍射角2θ为26.500 °处,出现了Al3Ni 的衍射峰;在2θ为36.518 °处,出现了NiAl3O4(镍铝尖晶石)的衍射峰;在2θ为35.753 °处,出现了Ni0.25Pt3O4(PtNi 合金簇)的衍射峰,这表明Pt 和Ni 在焙烧过程中形成了合金;在2θ为44.493 °处,出现了金属Ni 的衍射峰。对于2%Pt-15%Ni/γ-Al2O3的XRD 图谱,在衍射角2θ为37.249 °和43.289 °处出现了NiO 的衍射峰;在2θ为62.901 °处,出现了Ni1.14Pt2.86O6(PtNi 合金簇)的衍射峰;在2θ为78.958 °处,出现了PtO 的衍射峰。
在Pt-Ni 双金属催化剂的XRD 图谱中,镍铝尖晶石的形成以及Pt、Ni 的相互作用形成的PtNi 合金簇的存在促进了催化剂对甘油的吸附-氢解作用,其独特的PtNi 金属簇结构特征可有效促进甘油分子中C-C 键的断裂,使得生成的乙二醇比单金属催化剂有明显的提高。
2.3.2 N2物理吸附
对2%Pt-10%Ni/γ-Al2O3的催化剂和2%Pt-15%Ni/γ-Al2O3的催化剂做了氮气物理吸附,催化剂的比表面积、孔容以及孔径分布,吸附等温线以及孔径分布曲线如图2所示。
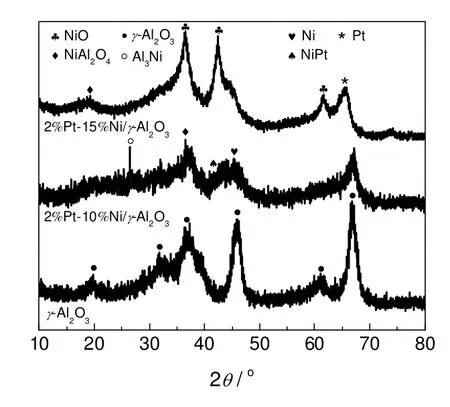
图1 γ-Al2O3 载体和催化剂的XRD 图谱Fig.1 XRD patterns of γ-Al2O3 and different Pt-Ni catalysts
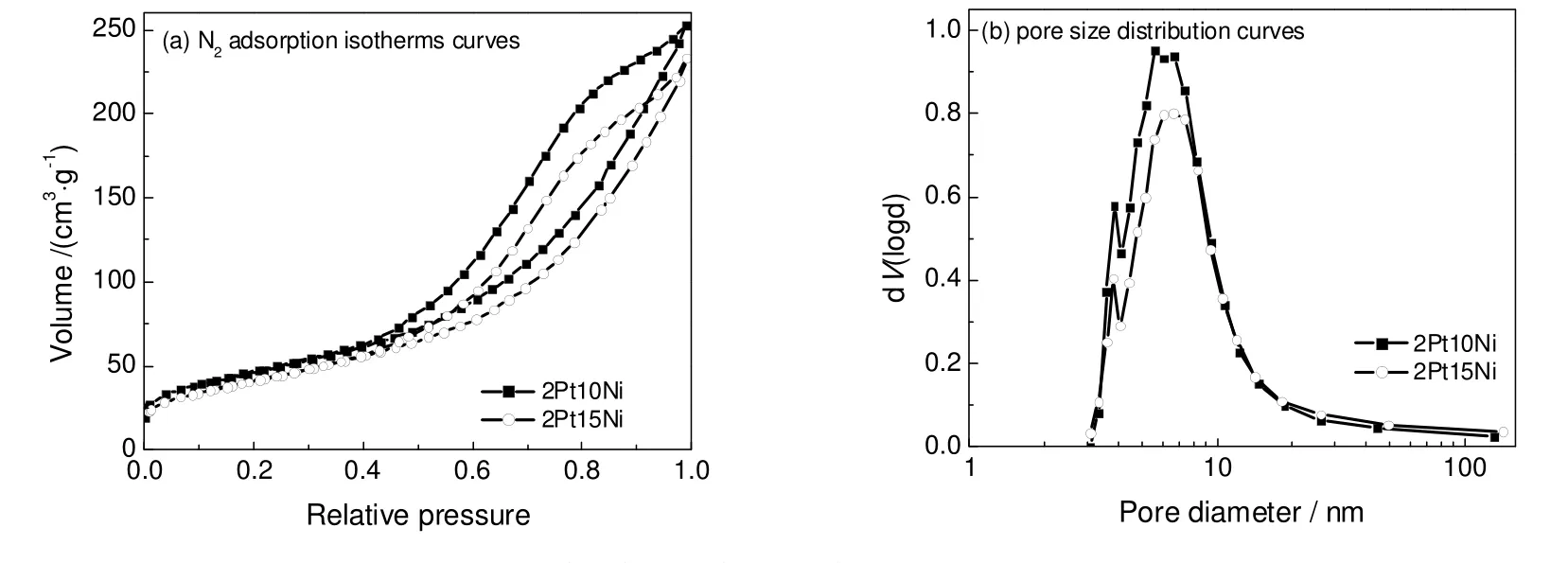
图2 催化剂的液氮吸附等温线和孔径分布Fig.2 N2 adsorption isotherms curves and pore size distribution curves of different Pt-Ni catalysts
各催化剂的吸附脱附曲线为典型的IV 等温线,在相对压力(P/P0)为0.5~1.0 时有明显的回滞环,这表明催化剂样品具有典型中孔材料(2~50 nm)的特性。表4中列出了γ-Al2O3、2%Pt-10%Ni/γ-Al2O3催化剂以及2%Pt-15%Ni/γ-Al2O3催化剂物理结构参数。从表4中可以看出,Pt 和Ni 的添加使得催化剂的比表面积和孔容大幅度下降,而对催化剂的平均孔径影响不大。

表4 催化剂物理结构Table 4 Textural property of γ-Al2O3 and different Pt-Ni catalysts
2.3.3 透射电镜
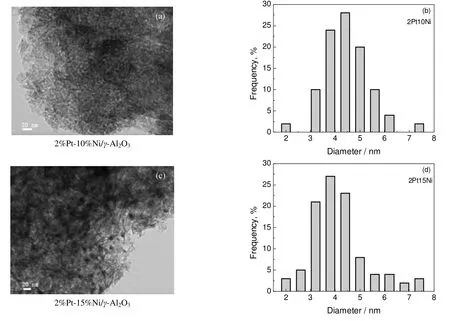
图3 催化剂的T EM照 片以及Pt原子粒径分布Fig.3 TEM microphotographs of and metal particle size distribution on catalysts
图3是催化剂的TEM 照片以及催化剂表面Pt 原子粒径分布图。可以看出,催化剂中的Pt 原子均匀地分布在γ-Al2O3载体表面。催化剂2%Pt-10%Ni/γ-Al2O3和2%Pt-15%Ni/γ-Al2O3表面上Pt 原子的平均粒径为4.76 nm 和3.87 nm,该两种催化剂表面上Pt 原子的平均粒径均小于Zhou 等[21]所制备的Pt-Ni 催化剂的平均粒径(4.8 nm),这说明本研究所制备的催化剂中,活性金属Pt 的粒度更细,传质扩散阻力更小,故本研究制备出的Pt-Ni 双金属催化剂具有很好催化活性。
2.3.4 氢气程序升温还原
根据文献可知,NiO 的还原温度为1 003 K 左右[22],而本研究中的Pt-Ni 双金属催化剂的还原峰的中心为720 K(见图4),比NiO 单独存在时的还原温度要低的多。这是由于Pt、Ni 金属之间的相互作用形成了PtNi 合金簇,发生氢气的溢流效应[23],进而出现了催化剂的还原峰向低温偏移的现象。还可以看到2%Pt-15%Ni/γ-Al2O3催化剂的还原峰峰面积明显大于2%Pt-10%Ni/γ-Al2O3催化剂的还原峰面积,其原因可能是催化剂中Ni 含量的增加增强了Pt、Ni 之间的相互作用,导致催化剂中Pt-Ni 合金簇被还原的几率增大,进而使得甘油催化氢解产物中乙二醇含量增加。
2.3.5 X 射线光电子能谱分析
为了研究催化剂中Pt 和Ni 的状态,对其进行XPS 表征。2%Pt-10%Ni/γ-Al2O3催化剂和2%Pt-15%Ni/γ-Al2O3催化剂的XPS 曲线,经XPS 分峰软件XPSpeak41 进行处理之后,得到如图5所示的结果。其中(b)(d)中两个peak 表示Ni 元素以两种不同的价态存在于催化剂中,但以Ni2+为主。
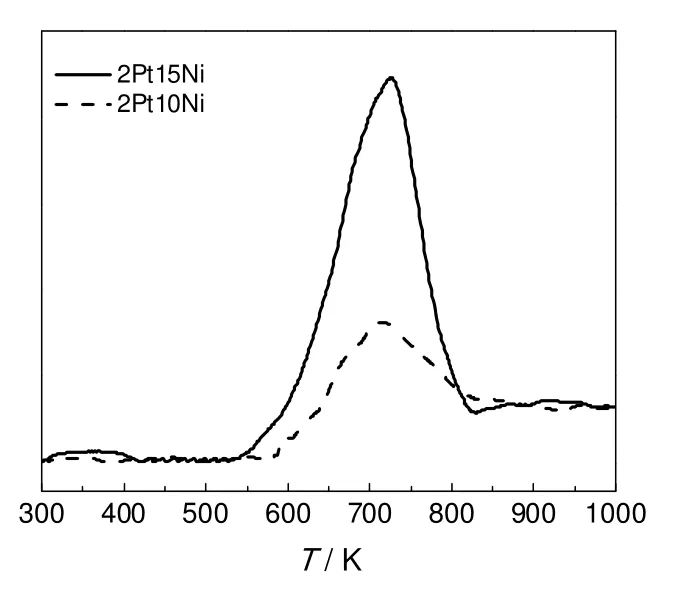
图4 催化剂的H2-TPR 图谱Fig.4 H2-TPR profiles of different Pt-Ni catalysts
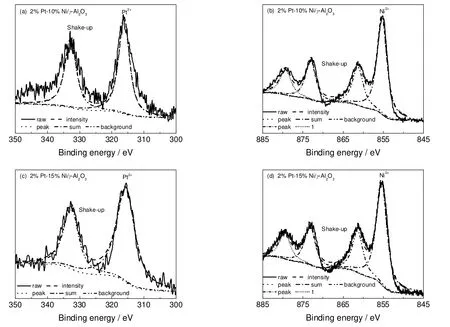
图5 催化剂中Pt 和Ni 的XPS 图谱Fig.5 X-ray photoelectron spectra of catalysts
催化剂中各元素的结合能如表5所示。

表5 Pt-Ni 催化剂中各元素的结合能(eV)Table 5 Binding energy values of different Pt-Ni catalysts (eV)
Bakar 等[24,25]指出,金属结合能的降低,是由于两种金属形成了合金。由表 5 可知,2%Pt-10%Ni/γ-Al2O3催化剂和2%Pt-15%Ni/γ-Al2O3催化剂表面Pt(4d5/2)的结合能分别为314.42 eV 和314.17 eV,这低于文献[26]中报道的Pt(4d5/2)的结合能(315.0 eV);同样,该两种催化剂表面Ni(2p3/2)的结合能分别为855.13 eV 和855.58 eV,也低于文献[26]中报道的Ni(2p3/2)的结合能(856.50 eV),这表明催化剂中的Pt 和Ni 形成了PtNi 合金簇,并且这与催化剂的XRD 测试结果(形成Ni0.25Pt3O4与Ni1.14Pt2.86O6合金簇)相吻合。上述结果表明,催化剂表面的Pt、Ni 形成了PtNi 合金簇,这可能是甘油氢解产物中乙二醇含量增多的重要原因。
3 结 论
在固定床反应器中,使用负载型Pt-Ni 双金属催化剂对甘油氢解反应性能进行研究,反应温度为473 K,氢气压力3.0 MPa,甘油水溶液进料流量为0.05 mL/min,氢气流量为200 mL/min 的条件下,甘油转化率达到94.8%,乙二醇选择性的最大值为28.4%,1,2-丙二醇的选择性为58.2%。催化剂表征结果表明,在Pt-Ni 双金属催化剂中,Pt、Ni 之间的相互作用以及PtNi 合金簇的形成是可能促进甘油氢解过程中C-C 键的断裂,生成乙二醇的重要原因。
[1]Tudorache M, Ghemes G, Nae A, et al.Biocatalytic designs for the conversion of renewable glycerol into glycerol carbonate as a value-added product [J].Central European Journal of Chemistry, 2014, 12(12):1262-1270.
[2]Yu L, Yuan J, Zhang Q, et al.Propylene from renewable resources:catalytic conversion of glycerol into propylene [J].Chem Sus Chem,2014, 7(3):743-747.
[3]Pagliaro M, Ciriminna R, Kimura H, et al.From glycerol to value-added products [J].Angewandte Chemie International Edition, 2007,46(24):4434-4440.
[4]Behr A, Eilting J, Irawadi K, et al.Improved utilisation of renewable resources:new important derivatives of glycerol [J].Green Chemistry, 2008, 10(1):13-30.
[5]Miyazawa T, Koso S, Kunimori K, et al.Glycerol hydrogenolysis to 1,2-propanediol catalyzed by a heat-resistant ion-exchange resin combined with Ru/C [J].Applied Catalysis A:General, 2007, 329:30-35.
[6]Huang L, Zhu Y, Zheng H, et al.Direct conversion of glycerol into 1,3-propanediol over Cu-H4SiW12O40/SiO2 in vapor phase[J].Catalysis letters, 2009, 131(1-2):312-320.
[7]D'Hondt E, de Vyver S V, Sels B F, et al.Catalytic glycerol conversion into 1,2-propanediol in absence of added hydrogen [J].Chemical Communications, 2008, (45):6011-6012.
[8]Martin A, Armbruster U, Gandarias I, et al.Glycerol hydrogenolysis into propanediols using in situ generated hydrogen-a critical review [J].European Journal of Lipid Science and Technology, 2013, 115(1):9-27.
[9]Dasari M A, Kiatsimkul P P, Sutterlin W R, et al.Low-pressure hydrogenolysis of glycerol to propylene glycol [J].Applied Catalysis A:General, 2005, 281(1-2):225-231.
[10]ten Dam J, Djanashvili K, Kapteijn F, et al.Pt/Al2O3catalyzed 1,3-propanediol formation from glycerol using tungsten additives [J].Chem Cat Chem, 2013, 5(2):497-505.
[11]Kusunoki Y, Miyazawa T, Kunimori K, et al.Highly active metal-acid bifunctional catalyst system for hydrogenolysis of glycerol under mild reaction conditions [J].Catalysis Communications, 2005, 6(10):645-649.
[12]Ji N, Zheng M Y, Wang A Q, et al.Nickel-promoted tungsten carbide catalysts for cellulose conversion:effect of preparation methods [J].Chem Sus Chem, 2012, 5(5):939-944.
[13]Ji N, Zhang T, Zheng M Y, et al.Direct catalytic conversion of cellulose into ethylene glycol using Nickel-promoted tungsten carbide catalysts [J].Angewandte Chemie, 2008, 47(44):8510-8513.
[14]Ji N, Zhang T, Zheng M Y, et al.Catalytic conversion of cellulose into ethylene glycol over supported carbide catalysts [J].Catalysis Today, 2009, 147(2):77-85.
[15]Ueda N, Nakagawa Y, Tomishige K.Conversion of glycerol to ethylene glycol over Pt-modified Ni catalyst [J].Chemistry Letters, 2010,39(5):506-507.
[16]Yin A Y, Guo X Y, Dai W L, et al.The synthesis of propylene glycol and ethylene glycol from glycerol using Raney Ni as a versatile catalyst [J].Green Chemistry, 2009, 11(10):1514-1516.
[17]Wu C T, Yu K M K, Liao F L, et al.A non-syn-gas catalytic route to methanol production [J].Nature Communications, 2012, 3:1050.
[18]Luo N J, Fu X W, Cao F H, et al.Glycerol aqueous phase reforming for hydrogen generation over Pt catalyst-effect of catalyst composition and reaction conditions [J].Fuel, 2008, 87(17-18):3483-3489.
[19]van Ryneveld E, Mahomed A S, van Heerden P S, et al.A catalytic route to lower alcohols from glycerol using Ni-supported catalysts [J].Green Chemistry, 2011, 13(7):1819-1827.
[20]Jiang T, Ren M X, Chen S S, et al.Kinetics of hydrogenolysis of glycerol to ethylene glycol over Raney Ni catalyst [C]// Advanced Materials Research, 2014, 906:103-111.
[21]Zhou X W, Zhang R H, Zhou Z Y, et al.Preparation of PtNi hollow nanospheres for the electrocatalytic oxidation of methanol [J].Journal of Power Sources, 2011, 196(14):5844-5848.
[22]Mihet M, Lazar M D.Effect of Pd and Rh promotion on Ni/Al2O3for NO reduction by hydrogen for stationary applications [J].Chemical Engineering Journal, 2014, 251:310-318.
[23]Liang G F, He L M, Arai M, et al.The Pt-enriched PtNi alloy surface and its excellent catalytic performance in hydrolytic hydrogenation of cellulose [J].Chem Sus Chem, 2014, 7(5):1415-1421.
[24]Abu Bakar N H H, Bettahar M M, Abu Bakar M, et al.PtNi catalysts prepared via borohydride reduction for hydrogenation of benzene [J].Journal of Catalysis, 2009, 265(1):63-71.
[25]Abu Bakar N H H, Bettahar M M, Abu Bakar M, et al.Silica supported Pt/Ni alloys prepared via co-precipitation method [J].Journal of Molecular Catalysis A:Chemical, 2009, 308(1-2):87-95.
[26]Iriondo A, Cambra J F, Barrio V L, et al.Glycerol liquid phase conversion over monometallic and bimetallic catalysts:effect of metal,support type and reaction temperatures [J].Applied Catalysis B:Environmental, 2011, 106(1-2):83-93.

