氧化铝上乙醇脱水制乙烯的动力学
王 菊,钟思青,张成芳,金照生
1.中国石油化工股份有限公司上海石油化工研究院,上海 201208;2.华东理工大学大型工业反应器工程,教育部工程研究中心,上海 200237
50年代前绝大部分的乙烯是由乙醇脱水生产而来的。随着石油化工的发展,大量廉价石油促使烃类热裂解生产乙烯,以其经济上的优势取代了乙醇脱水法生产乙烯。但随着生物技术的快速发展以及非粮食基生物质乙醇制备技术的突破,使得乙醇来源日趋广泛,乙醇法制乙烯工艺又得到了重视。
20世纪对乙醇脱水反应的机理已进行了大量的研究[1-11],目前关于乙醇制乙烯的研究主要集中在催化剂的研制[12]和工艺研究[13]两大方面,而针对特定催化剂上反应动力学研究又是工艺研究的基础。至今得到广泛应用的是Hassan 提出了乙醇在固体酸碱催化剂上反应的催化机理[14],认为乙醇首先吸附在催化剂表面的酸碱中心上并形成吸附态化合物,然后吸附态中间产物脱水生成最终产物并恢复酸碱中心。由于所用催化剂的物理性质和化学性质的不同,对机理和动力学研究就很难达成一致,主要存在两类争议:(1)乙醇脱水机理是连串反应机理、平行反应机理和平行-连串反应机理;(2)反应机理模型是吸附于催化剂上的两个邻近乙醇分子之间进行的L-H 模型和一个气相乙醇分子和一个催化剂上处于吸附态的乙醇分子之间进行的R-E 模型。本工作采用自研发的氧化铝作为催化剂,进行乙醇脱水反应性能的研究,依据平行-连串反应机理建立包括副产物C4 的所选催化剂反应体系的本征动力学模型,为催化剂的工业应用和反应装置的工业放大提供数据参考。
1 实验部分
1.1 实验装置
实验装置如图1所示,采用∅10 mm 不锈钢-管制成的固定床积分反应器,内插∅1 mm 的热电偶套管。反应器和预热器由电热丝加热,温度控制误差不超过±1 ℃。预热炉出口处至反应器进口处和反应器出口处至气相色谱进口处流路用加热带保温防止蒸汽冷凝。分析纯的乙醇按照一定的水醇比(质量比)混合后,通过SZB-2 双柱塞微量计量泵进料。空白实验发现,反应器本身及里面装填的惰性物料石英砂对反应没有催化作用。
1.2 内外扩散的排除
为排除外扩散影响,采用不同催化剂的使用量,改变空速进行实验。实验表明,当反应在常压操作,反应温度为340 ℃的条件反应下,空速大于0.1 mL/(h·g),外扩散影响不存在。
内扩散排除实验:保持空速恒定为0.5 mL/(h·g),常压操作,反应温度为340 ℃的条件下,改变氧化铝催化剂的颗粒度,测得乙醇转化率随催化剂粒度变化的曲线,实验发现当催化剂粒度大于60 目后,乙醇转化率受氧化铝催化剂的粒度影响很小。实验选用粒度为60~80 目的氧化铝催化剂,称取2 g 放入固定床反应器管中。通入氮气550 ℃活化2 h,最后降至所需反应温度。

图1 实验流程示意Fig.1 Experiment flow scheme
2 结果与讨论
2.1 动力学模型建立
根据对所选催化剂上的乙醇脱水制乙烯反应性能研究,乙醇脱水制乙烯可能存在下述的反应:
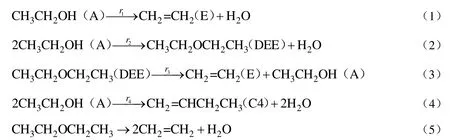
结合实验数据分析和反应体系的热力学分析[15],选择反应(1)、(2)、(3)和(4)为乙醇脱水反应体系的四个主要反应,所选催化剂上的乙醇脱水反应呈现的规律更应符合平行-连串机理。
实验发现,系统中的水分压对反应是有影响的,为简化系统和优化计算参数速率,这里假设这些反应都是不可逆反应。采用幂指数速率方程形式,建立了如下半理论半经验的速率方程式:

各主要反应物及产物的净生成速率如下:

同时反应体系中各物质的速率也可表示为单位质量催化剂上某一物质的摩尔流量的变化:
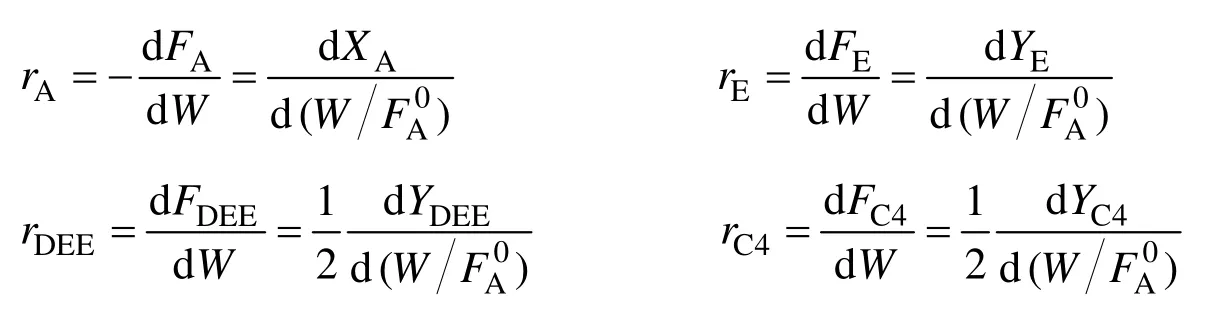
式中ri为反应速率,mol/(h·g);Pi为分压,MPa;Fi为摩尔流率,mol/h;为进口乙醇原料的总摩尔流量,mol/h;W为催化剂装填量,g;XA为乙醇转化率;Yi为收率。
联立上述方程,可优化求解出各反应速率常数k1~4和反应级数n1~8。
2.2 模型参数计算
反应级数的初值按照一定的经验选取,四个反应的速率常数的初值参考文献[16]。利用MATLAB软件,采用四五阶Runge-Kutta 法对上述微分速率方程组求解,可得到不同反应条件下的乙醇转化率、乙烯收率、乙醚收率和C4 收率。同时以G为目标函数,采用Marquardt 算法对参数进行优化,可求得目标函数达到最小值时的相应的动力学参数。
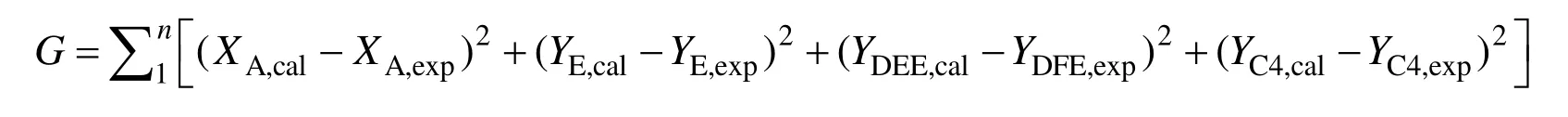
通过对参数初值的不断调整,全局优化求出合适的反应级数。然后把得到的反应级数作为已知参数,对每个温度下的模型优化求出不同温度下的反应速率常数,结果见表1。
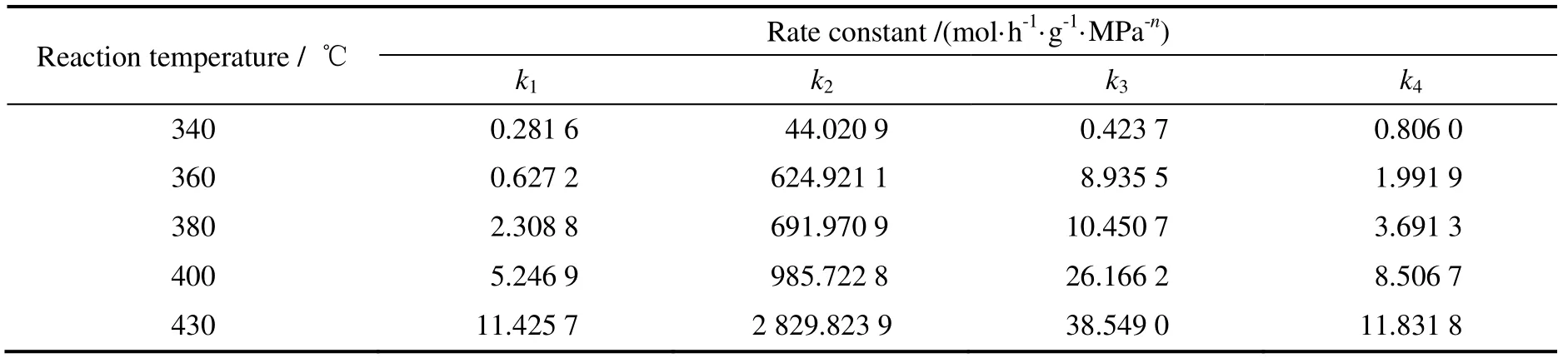
表1 不同温度下的反应速率常数Table 1 Rate constants at different temperatures
按照Arrhenius 方程:k=k0exp(-Ea/RT),对所得的速率常数以lnk与T-1作图,如图2所示。通过对图2中的数据点进行线性最小二乘法拟合,可得到各个反应的表观指前因子k0和活化能Ea。
对所得到的模型中的指前因子、活化能和反应级数的小数点的个数进行修正,最终得到乙醇在所选氧化铝催化剂上脱水反应的本征动力学模型,如下所示:
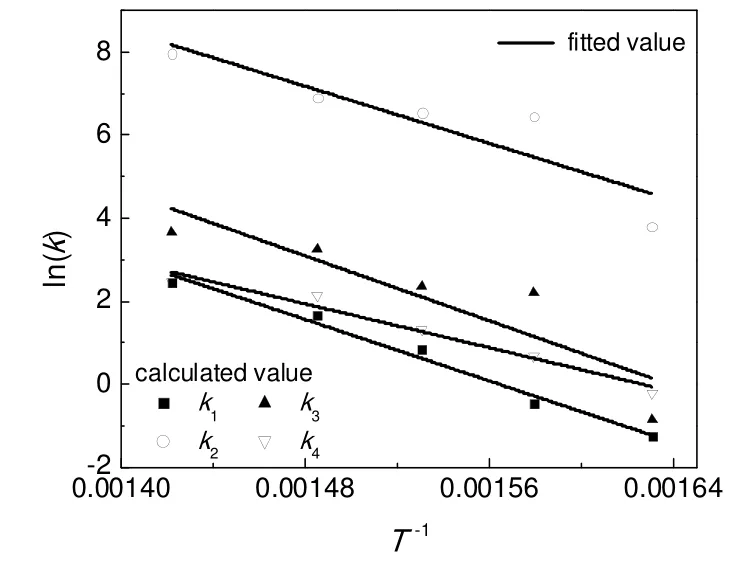
图2 lnk 与T-1 直线拟合Fig.2 Line polyfit scheme of lnk vs T-1
2.3 动力学模型的统计检验
将上述优化所得的动力学参数代入相应的速率方程,可计算不同反应条件下的关键组分乙醇的转化率和乙烯收率,计算值与实验值比较见图3。
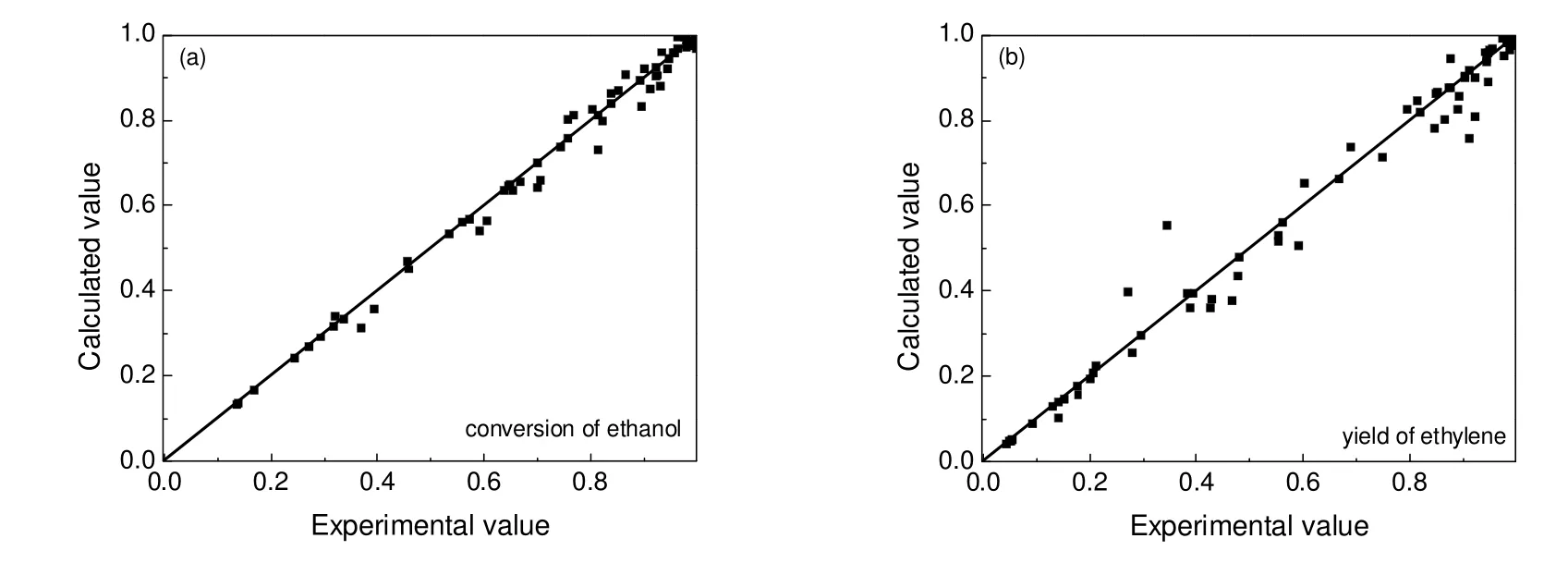
图3 乙醇转化率及乙烯收率的残差分析Fig.3 Residual analysis of conversion of ethanol and yield of ethylene
从图3可以看出,除少数几个点的误差比较大,大多数都均匀分布在对角线附近,平均误差在10%以内,说明此模型及参数所得到计算值与实验值吻合。
根据统计理论,对模型的适定性进行了检验,检验结果见表2。

表2 动力学模型的统计检验Table 2 Statistical test of kinetic model
统计结果表明:ρ2>0.9,F>>10FT。所以模型在该水平上是合适的。
3 结 论
对选用的氧化铝催化剂上乙醇催化脱水制乙烯的反应本征动力学特性进行了较为全面的实验研究,建立了描述反应生成物的半经验幂指数型的本征动力学模型。通过对乙醇催化脱水制乙烯的反应动力学的研究,得到了以下的结论。
a)乙醇催化脱水制乙烯的反应体系是复杂的复合反应体系,总体上属于平行反应体系带有连串生成乙醚的反应体系,即乙醇分子内直接脱水生成乙烯,同时发生乙醇分子间脱水生成乙醚,再由乙醚发生歧化反应生成乙烯。
b)生成乙烯的反应的活化能Ea1(154 kJ/mol)和Ea3(162.6 kJ/mol)高于生成乙醚(142.9 kJ/mol)和C4(109.9 kJ/mol)的活化能,说明要想提高目的产物乙烯收率,该催化剂下宜采用适当提高反应温度。
c)乙醇生成乙烯的反应级数小于生成混合C4 和乙醚的反应级数,说明生成乙烯反应的速率受乙醇浓度的影响相对于副产物乙醚和C4 要小,乙醇浓度低更有利于乙烯选择性的提高,乙醇进料宜采用多股陆续加入加料方式。
[1]Rho S B.The conversion of ethanol to ethylene using a gas-phase catalytic reaction, including the effects of cyclic operation [J].International Chemical Engineering, 1984, 24 (3):567-577.
[2]Balandin A A, Balandin G V, Popov E I, et al.Use of radiocarbon for the investigation of the mechanism of the dehydration of ethanol over alumina [J].Russian Chemical Bulletin, 1958, 7 (2):218-220.
[3]Arai H, Take J I, Saito Y, et al.Ethanol dehydration on alumina catalysts:I.the thermal adsorption of surface compounds [J].Journal of Catalysis, 1967, 9 (2):146-153.
[4]Knözinger H, Bühl H, Ress E.The dehydration of alcohols over alumina virtue dependence of reaction direction on the substrate structure [J].Journal of Catalysis, 1968, 12 (2):121-128.
[5]Padmanabhan V R, Eastburn F J.Mechanism of ether from alcohols over alumina catalyst [J].Journal of Catalysis, 1972, 24 (1):88-91.
[6]Morávek V, Kraus M.Transient behavior of the system ethanol-diethyl ether-water-alumina [J].Journal of Catalysis, 1984, 87(2):452-460.
[7]Saito Y, Niiyama H.Reaction mechanism of ethanol dehydration on/in heterotopy compounds:analysis of transient behavior based on pseudo-liquid catalysis model [J].Journal of Catalysis, 1987, 106(2):329-336.
[8]Shinohara Y, Satozono H, Nakajima T, et al.Study of the interaction of ethanol with the broensted and Lewis acid sites on metal oxide surfaces using the DV-Xa method [J].Journal of Chemical Software, 1997, 4(2):41.
[9]Shinohara Yuji, Nakajima T, Suzuki S, et al.A computational chemical investigation of the dehydration and dehydrogenation of ethanol on oxide catalysts [J].Journal of Chemical Software, 1997, 4 (3):89.
[10]Shi B C, Dabbagh H A, Davis B H.Catalytic dehydration of alcohols, kinetic isotope effect for the dehydration oft-butanol [J].Topics in Catalysis, 2002, 18(3-4):59-265.
[11]Golay S, Doepper R, Renken A.Reactor performance enhancement under periodic operation for the ethanol dehydration overγ-alumina,a reaction with a stop-effect [J].Chemical Engineering Science, 1999, 54(20):4469-4474.
[12]索红波, 苏国东, 胡 燚, 等.工业氧化铝催化剂上乙醇脱水动力学 [J].化学反应工程与工艺,2009, 25(5):458-462.Suo Hongbo, Su Guodong, Hu Yi, et al.Kinetics of ethanol dehydration over industrial catalystγ-Al2O3[J].Chemical Reaction Engineering and Technology, 2009, 25(5):458-462.
[13]余英哲.乙醇脱水制乙烯γ-Al2O3催化剂的分子模拟和实验研究 [D].天津, 天津大学, 2012.
[14]El-Salaam K M A, Hassan E A.Active surface centers in a heterogeneous CdO catalyst for ethanol decomposition [J].Surface Technology, 1982, 16(2):121-128.
[15]王 菊, 钟思青, 谢在库, 等.乙醇脱水制烯烃过程分析 [J].天然气化工(C1 化学与化工), 2008, 33(5):27-32.Wang Ju, Zhong Siqing, Xie Zaiku, et al.Analysis for the process of ethanol dehydration to olefins [J].Natural Gas Chemical Industry,2008, 33(5):27-32.
[16]Kochar N K, Merims R, Padia A S.Ethylene from ethanol [J].Chemical Engineering Progress, 1981, 77(6):66-70.

