MACC1基因下调对胃腺癌细胞的生长抑制作用
罗毅,刘路培,于路
MACC1基因下调对胃腺癌细胞的生长抑制作用
罗毅,刘路培,于路
目的研究下调MACC1表达对胃腺癌细胞株MGC-803生长作用的影响。方法设计并合成RNAi干扰片段,脂质体介导MACC1-siRNA1(MACC1-siRNA1组)和MACC1-siRNA2(MACC1-siRNA2组)转染MGC-803细胞,同时设非特异性干扰片段为对照组。应用qRT-PCR检测转染后各组MACC1的mRNA表达,噻唑蓝比色实验、平板克隆形成实验和流式细胞周期实验检测RNAi转染后MGC-803细胞增殖能力的变化,Western blot检测转染后MACC1、P21、CDK4、CCND1和c-myc蛋白的表达,并进行比较分析。结果与对照组相比,MACC1-siRNA1组和MACC1-siRNA2组MACC1表达在mRNA及蛋白水平下降,细胞的增殖速度变慢,单克隆形成数量减少,细胞周期中G1期细胞的比例显著升高,P21的表达增加,MACC1、CDK4、CCND1和c-myc的表达减少。结论下调MACC1能使MGC-803细胞的细胞周期进程受阻,抑制细胞的增殖,MACC1可以作为治疗胃癌的有效靶点。
胃肿瘤;腺癌;细胞增殖;细胞周期;RNA干扰;MACC1基因;MGC-803细胞
胃癌是消化系统常见的恶性肿瘤,外科手术是其主要的治疗手段,术后辅以药物化疗或放疗等。虽然经过正规和系统治疗,但效果并不满意,仅有30%~50%的患者得到根治性切除,大多数患者死于局部进展、早期转移或复发[1]。MACC1是近年来研究较多的一个基因,有研究显示MACC1在胃癌中过表达,并且与胃癌的病理分期和预后具有密切的联系,可作为预测胃癌转移以及预后的指标[2-3]。虽然目前国内外已经有大量的关于MACC1基因与胃癌转移相关的研究,但是与胃癌生长调控作用方面的研究甚少。本研究旨在观察MACC1对MGC-803细胞的生长调控作用,探究其在胃癌发生、发展过程中的作用机制。
1 材料与方法
1.1 材料MGC-803细胞株购自中国科学院细胞库;RPMI 1640培养基、胎牛血清购自Hyclone公司;逆转录试剂盒和SYBR Premix Ex TaqTM荧光定量PCR试剂盒为TaKaRa公司产品;二甲基四氮唑蓝(MTT)、碘化丙啶(PI)和二甲基亚砜(DMSO)为Sigma公司产品;Lipofectamine2000、Trizol试剂购自美国Invitrogen公司;PMSF及RIPA蛋白裂解液为碧云天公司产品;MACC1、P21、CDK4、CCND1和c-myc单克隆抗体购自Epitomics公司;聚偏二氟乙烯(PVDF)膜购自美国Milli⁃pore公司;增强型化学发光检测试剂盒(ECL)、β-actin单克隆抗体、辣根过氧化物酶(HRP)标记的二抗购自北京康为世纪公司;凝胶成像系统为美国Bio-Rad公司产品;Mx3000PTM Real Time PCR仪为Stratagene公司产品;倒置相差显微镜为Olympus公司产品。
1.2 方法
1.2.1 瞬时转染设计及合成针对MACC1基因的siRNA干扰片段。MACC1-siRNA1组:5′-GCCACACATGCTTAAC⁃CATGA-3′;MACC1-siRNA2组:5′-GGAAGCAGGTGAAG⁃TAGTTCA-3′。转染前24 h接种MGC-803细胞于直径60 mm皿中,在细胞密度达50%~70%汇合度时,将培基换成无血清培基。将稀释好的干扰片段与LipofectamineTM2000脂质体轻柔混匀,室温孵育20 min,形成转染复合物;然后将上述混合物加到细胞培养基中,轻轻混匀,在5%CO2、37℃培养箱中培养,6~8 h后更换完全培养基。48 h后检测干扰效率。以非特异性干扰片段(Negative control,5′-GCCAGCT⁃TAGCACTGACTC-3′,不针对任何已知人mRNA)为对照组。
1.2.2 实时荧光定量PCR检测干扰效率转染48 h后收集各组细胞,TRIzol法提取RNA,检测RNA浓度和纯度后,按照TaKaRa逆转录试剂盒说明合成cDNA,然后按照SYBR Premix Ex TaqTM试剂盒说明进行Real-Time PCR检测,以βactin为内参。MACC1引物:上游5′-GGCTGTGATGCTAC⁃GAGATA-3′,下游5′-ACACCAGGACAATGCCTACT-3′;βactin引物上游5′-TGGCACCCAGCACAATGAA-3′,下游5′-CTAAGTCATAGTCCGCCTAGA-3′。总反应体系20 μL,反应条件:94℃预变性30 s;94℃10 s,55℃10 s,72℃8 s,40个循环;95℃1 min,55℃30 s,95℃30 s,绘制熔解曲线。各组均设复孔3个,实验重复3次。结果判定采用2-ΔΔCT法:△CT= CT目的基因-CT内参,△△CT=△CT处理组-△CT对照组,处理组的相对表达值=2-△△CT,对照组的相对表达量=1。
1.2.3 MTT法检测细胞增殖取MACC1-siRNA1,MACC1-siRNA2和对照组细胞,转染后24 h,将细胞消化下来,以每孔4×103个细胞接种于96孔板中,每孔体积200 μL,每组5个复孔,同时设空白对照(仅加培养基),分别培养1、2、3、4和5 d,每孔加入5 g/L的MTT 20 μL,37℃继续培养4 h后弃掉孔内培养基,加入DMSO 150 μL,室温孵育10 min,微振荡器振荡10 min,使结晶物充分溶解,以空白对照孔调零,酶标仪上490 nm测定各孔光密度(OD)值,以相对应OD比值表示细胞增殖能力大小。各组取5个孔平均值,重复3次,绘制生长曲线。
1.2.4 平板克隆实验取MACC1-siRNA1,MACC1-siRNA2和对照组细胞,转染后24 h,0.25%胰酶消化制成细胞悬液,细胞板计数,接种200个细胞到6孔培养板中,每种细胞接种2孔,轻轻晃动培养板,使细胞分散均匀,37℃、5%CO2培养箱中培养2周。出现肉眼可见的细胞克隆,甲醇固定15 min,弃甲醇后空气干燥;用Giemsa应用染液染色5 min,流水缓慢洗去染液,空气干燥后显微镜下计数形成的克隆数(≥50个细胞为1个克隆)。实验重复3次。
1.2.5 流式细胞术检测细胞周期收取MACC1-siRNA1、MACC1-siRNA2和对照组细胞,转染后48 h,消化细胞制成细胞悬液,各组细胞密度约为1×106个/mL,用预冷PBS洗涤细胞2次,加入预冷70%乙醇混匀,4℃固定过夜,用冷PBS离心洗涤1次,加入400 μL PBS,RNase A至终浓度0.5 g/L,碘化丙啶(PI,10 mg/L)染色20~30 min;避光放置15 min,上机检测。全部数据经FACSCalibur流式细胞仪和CELLQuest软件获取。
1.2.6 Western blot检测蛋白表达转染72 h后收集MACC1-siRNA1、MACC1-siRNA2和对照组细胞,用细胞裂解液提取待测细胞的总蛋白,BCA法进行蛋白定量,配制10%SDS-PAGE分离胶和5%SDS-PAGE浓缩胶,每孔加入等量待测蛋白进行SDS-聚丙烯酰胺凝胶电泳,浓缩胶恒压80 V 30 min,分离胶恒压100 V 90 min。采用湿转法进行转膜,根据蛋白Marker所指示的条带位置,将目的蛋白所在范围的膜裁剪下来,同时裁剪β-actin蛋白条带作为内参照。含5%BSA的TBST封闭液室温孵育1 h。用封闭液稀释一抗,MACC1、P21、CDK4、CCND1和c-myc兔抗人单克隆抗体(1∶500稀释)和β-actin鼠抗人单克隆抗体(1∶1 000稀释),室温孵育2 h,4℃孵育过夜。次日取出膜,室温下TBST洗膜;用辣根过氧化物酶(HRP)标记的抗兔、抗鼠二抗(1∶1 000稀释),室温孵育1 h,TBST洗膜。按照ECL检测试剂盒说明书进行检测,凝胶成像系统检测蛋白条带的表达情况。
1.3 统计学方法采用SPSS 16.0统计软件进行分析,计量资料用均数±标准差表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 实时荧光定量PCR结果对照组、MACC1-siRNA1组和MACC1-siRNA2组细胞MACC1相对表达量分别为1.003±0.085、0.117±0.012和0.098±0.008,差异有统计学意义(F=116.02,P<0.001)。
2.2 MTT结果与对照组细胞相比,沉默MACC1后的MACC1-siRNA1组和MACC1-siRNA2组细胞增殖速度明显减慢,见图1。
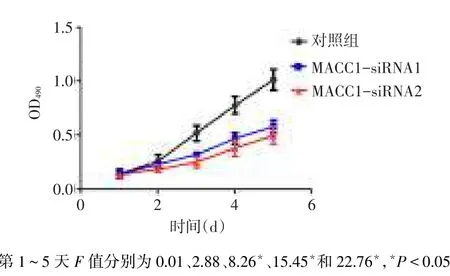
Fig.1Cell growth curves of all three groups图1 各组细胞的生长曲线
2.3 平板克隆结果各组细胞均能形成克隆菌落,对照组、MACC1-siRNA1组和MACC1-siRNA2组克隆数分别为106.64±12.22、48.50±10.13和32.62± 6.09,差异有统计学意义(F=42.57,P<0.01),与对照组相比,MACC1-siRNA1组和MACC1-siRNA2组形成的克隆数明显减少(均P<0.05),见图2。
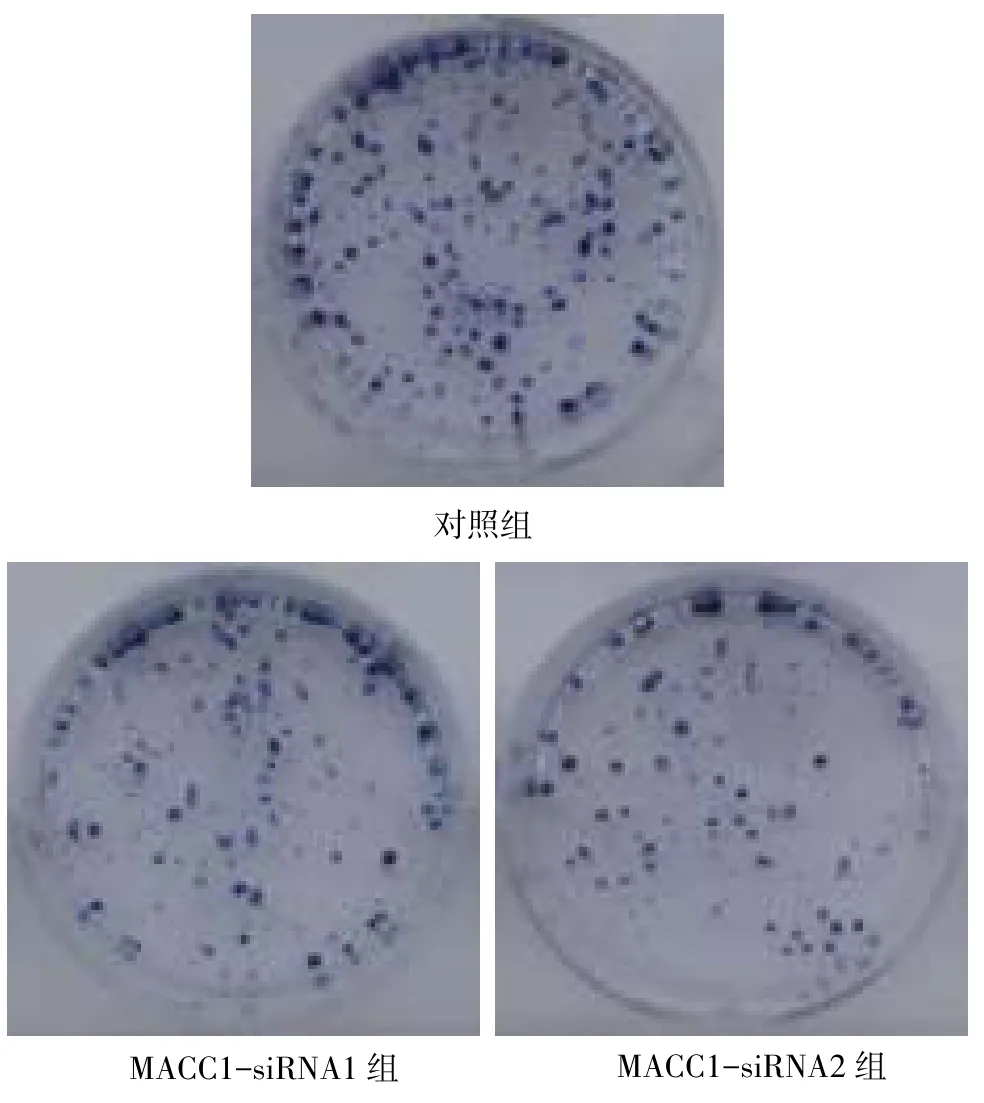
Fig.2Colony formation ability of all three groups图2 各组细胞平板克隆形成实验
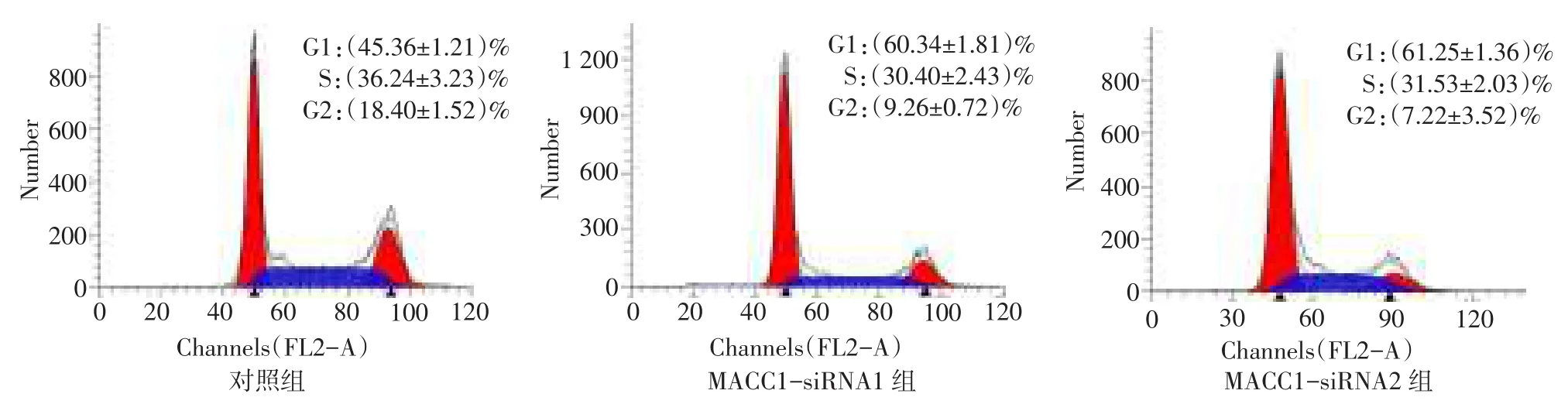
Fig.3Cell cycles of negative control,MACC1-siRNA1 and MACC1-siRNA2 detected by flow cytometry图3 流式细胞术检测3组细胞周期分布
2.4 细胞周期结果与对照组处于G1期细胞百分率(45.36±1.21)%相比,MACC1-siRNA1组和MACC1-siRNA2组的G1期细胞百分率分别为(60.34±1.81)%和(61.25±1.36)%,G1期百分率显著增高,差异有统计学意义(F=108.70,P<0.001),见图3。
2.5 Western blot检测蛋白表达量结果与对照组相比,MACC1-siRNA1组和MACC1-siRNA2组MGC-803细胞中MACC1、CDK4、CCND1和c-myc表达量减少,P21表达量增加,见图4。
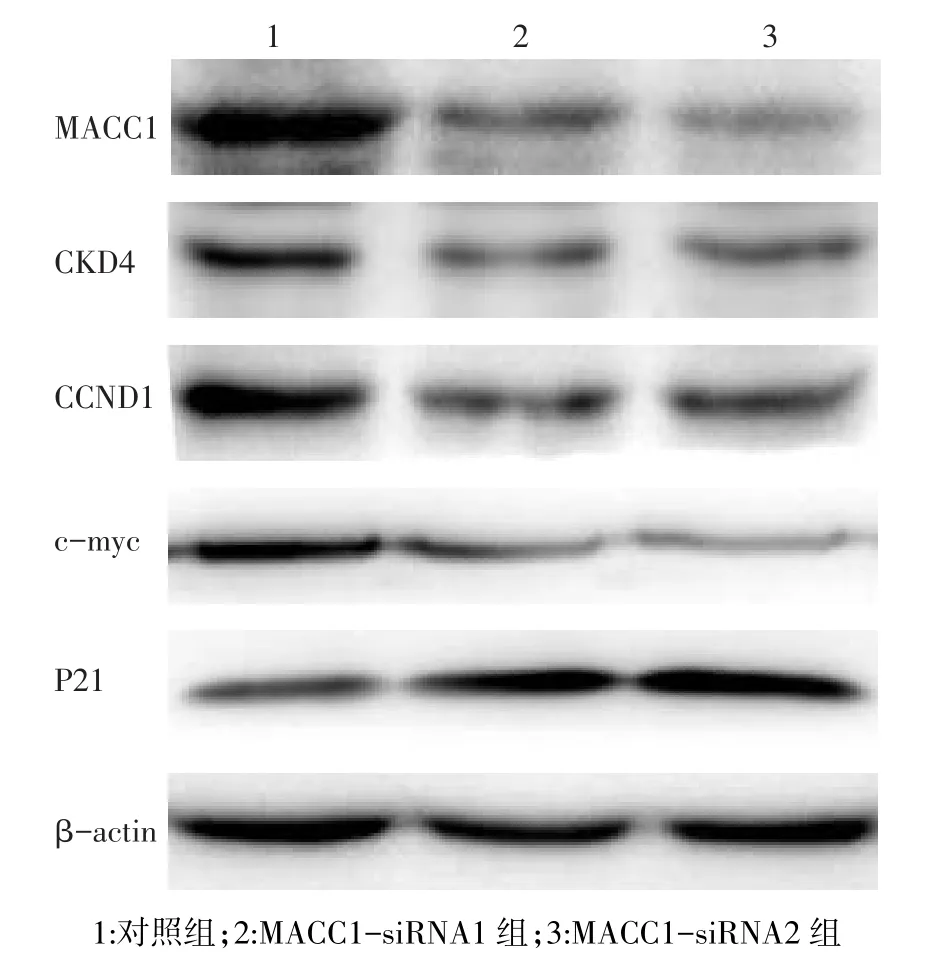
Fig.4Protein expression of MACC1,CDK4,CCND1,c-myc and P21 after MACC1 silencing detected by Western blot analysis图4 Western blot检测转染后MACC1、CDK4、CCND1、c-myc和P21的表达
3 讨论
MACC1是由Stein等[4-5]通过差异显示聚合酶链反应技术在结肠癌中获得的调控结肠癌生长和转移的新基因,定位于人类7号染色体(7p21.1),含有7个外显子和6个内含子,其cDNA含2 559个核苷酸序列,编码由852个氨基酸残基组成的蛋白质,MACC1明显增加了肠癌细胞的增殖、侵犯及扩散,在小鼠模型中,肿瘤细胞的生长和转移能力亦明显增强。在肺癌[6]、肝癌[7]、胰腺癌[8]、卵巢癌[9]、乳腺癌[10]等恶性肿瘤中也发现,MACC1可影响癌症患者的预后或术后复发,可促进肿瘤细胞的增殖和侵袭。Zhang等[11]发现,MACC1在卵巢癌组织中高表达,MACC1基因沉默后,卵巢癌细胞的增殖、转移及侵袭能力明显降低;尚超等[12]通过qRT-PCR技术检测肾癌组织发现已发生转移的患者癌组织中MACC1的表达量为未转移癌组织中的2.45倍,抑制肾癌细胞Caki-1的MACC1的表达后,细胞的侵袭能力明显下降;Muendlein等[13]另外研究发现MACC1的表达与原发灶、淋巴结转移、远处转移显著相关,提示MACC1可作为乳腺癌患者生存预后的指标,其表达状态可用来评估新型抗乳腺癌治疗的有效性。Wang等[14-15]采用免疫组化技术检测97例胃癌组织及癌旁正常组织中MACC1蛋白的表达,并分析其与临床病理资料的关系,结果发现MACC1蛋白的异常高表达与分化程度、腹膜转移、淋巴转移、临床分期密切相关,MACC1可以作为预测腹膜转移、淋巴转移,评价胃癌进展的有效指标,为胃癌患者的临床诊疗提供依据。随后进一步发现,MACC1是胃癌的癌基因,可影响胃癌的术后复发,促进胃癌细胞的侵袭和迁移,并可能是通过诱导上皮间质转化(EMT)的途径而影响胃癌的恶性生物学行为。然而关于MACC1在胃癌生长调控的作用及其机制尚少见报道。本研究运用RNAi沉默MGC-803细胞中MACC1基因表达,通过噻唑蓝比色(MTT)实验、平板克隆形成实验和流式细胞术检测细胞周期实验证实,下调MACC1基因的表达后,MGC-803细胞的体外增殖能力明显变慢,同时MGC-803细胞中与细胞周期相关因子CDK4、CCND1和c-myc表达量减少,P21的表达量增加,提示沉默MACC1基因的表达能够明显抑制胃癌细胞的增殖能力,且对细胞增殖能力的抑制主要是通过其对细胞周期进程的调控而实现的。
综上所述,MACC1作为一种新发现的癌基因,不仅可影响EMT的发生,增强胃癌细胞的侵袭和迁移能力,而且通过对细胞周期进程的调控,影响细胞的分裂增殖过程,增强胃癌细胞的增殖能力。MACC1可以作为治疗胃癌的有效靶点,其具体的机制有待进一步研究。
[1]Wang H,Pawlik TM,Duncan MD,et al.Inpatient survival after gas⁃trectomy for gastric cancer in the 21st century[J].J Surg Res,2014,190(1):72-78.doi:10.1016/j.jss.2014.03.015.
[2]Shirahata A,Sakata M,Kitamura Y,et al.MACC 1 as a marker for peritoneal-disseminated gastric carcinoma[J].Anticancer Res,2010,30(9):3441-3444.
[3]Yao JB,Da MX,Guo TK,et al.Expression and clinical implications of MACC1 in gastric cancer tissues[J].Chinese Journal of Cancer Prevention and Treatment,2013,20(6):444-447,452.[姚继彬,达明绪,郭天康,等.胃癌组织MACC1表达及其临床意义分析[J].中华肿瘤防防治杂志,2013,20(6):444-447,452].
[4]Stein U.MACC1-a novel target for solid cancers[J].Expert Opin Ther Targets,2013,17(9):1039-1052.doi:10.1517/14728222.2013.815727.
[5]Stein U,Walther W,Arlt F,et al.MACC1,a newly identified key regulator of HGF-MET signaling,predicts colon cancer metastasis[J].Nat Med,2009,15(1):59-67.doi:10.1038/nm.1889.
[6]Chundong G,Uramoto H,Onitsuka T,et al.Molecular diagnosis of MACC1 status in lung adenocarcinoma by immunohistochemical analysis[J].Anticancer Res,2011,31(4):1141-1145.
[7]Shirahata A,Fan W,Sakuraba K,et al.MACC 1 as a marker for vas⁃cular invasive hepatocellular carcinoma[J].Anticancer Res,2011,31(3):777-780.
[8]Wang G,Kang MX,Lu WJ,et al.MACC1:A potential molecule as⁃sociated with pancreatic cancer metastasis and chemoresistance[J]. Oncol Lett,2012,4(4):783-791.doi:10.3892/ol.2012.784.
[9]Zhang RT,Shi HR,Huang HL,et al.Expressions of MACC1,HGF,and C-met protein in epithelial ovarian cancer and their signifi⁃cance[J].Nan Fang Yi Ke Da Xue Xue Bao,2011,31(9):1551-1555.
[10]Huang Y,Zhang H,Cai J,et al.Overexpression of MACC1 and Its significance in human Breast Cancer Progression[J].Cell Biosci,2013,3(1):16.doi:10.1186/2045-3701-3-16.
[11]Zhang R,Shi H,Chen Z,et al.Effects of metastasis-associated in colon cancer 1 inhibition by small hairpin RNA on ovarian carcino⁃ma OVCAR-3 cells[J].J Exp Clin Cancer Res,2011,30:83.doi:10.1186/1756-9966-30-83.
[12]Shang C,Zhang H,Song YS.Regulation between MACC1 and c-MET in proliferative process of renal carcinoma[J].Chinese Journal of Cancer Prevention and Treatment,2011,18(14):1065-1067,1087.[尚超,张辉,宋永胜.肾癌细胞增殖过程MACC1和c-MET调控机制的探讨[J].中华肿瘤防治杂志,2011,18(14):1065-1067,1087].
[13]Muendlein A,Hubalek M,Geller-Rhomberg S,et al.Significant survival impact of MACC1 polymorphisms in HER2 positive breast cancer patients[J].Eur J Cancer,2014,50(12):2134-2141.doi:10.1016/j.ejca.2014.05.007.
[14]Wang L,Wu Y,Lin L,et al.Metastasis-associated in colon cancer-1 upregulation predicts a poor prognosis of gastric cancer,and pro⁃motes tumor cell proliferation and invasion[J].Int J Cancer,2013,133(6):1419-1430.doi:10.1002/ijc.28140.
[15]Wang NN,Xie JM,Zheng DY,et al.Establishment of BGC-823/ pBaBb-puro-MACC1 gastric cancer cell line stably expressing MACC1 and its tumor-related gene expression profiles[J].Journal of Southern Medical University,2012,32(3):312-316.[王妮娜,谢剑明,郑大勇,等.稳定表达MACC1的胃癌BGC-823/pBaBbpuro-MACC1细胞株的建立及其肿瘤相关基因的研究基因[J].南方医科大学学报,2012,32(3):312-316].doi:CNKI:44-1627/R. 20120307.1708.024.
(2014-06-18收稿2014-12-04修回)
(本文编辑魏杰)
Effect of MACC1 down-regulation on proliferation of gastric adenocarcinoma cell line
LUO Yi,LIU Lupei,YU Lu
Department of Emergency,Liuzhou People′s Hospital Affiliated to Guangxi University of Technology,Guangxi 545006,China
ObjectiveTo study the effects of MACC1 down-regulation on the growth of gastric adenocarcinoma cells.MethodssiRNA(MACC1-siRNA1 and MACC1-siRNA2)that can transiently silenced MACC1 was designed,syn⁃thesized and transfected into MGC-803 cells by lipofectamine 2000.Non-specific siRNA was transfected to be used as nega⁃tive control.The efficiency of MACC1 depletion was determined by Real-time quantitative PCR.MTT,colony formation and flow cytometry assay were performed to examine cell proliferation.The expressions of MACC1,P21,CDK4,CCND1 and cmyc were determined by Western blot.ResultsCompared with cells in negative control group,transiently silencing MACC1 decreased the expression of MACC1 in MGC-803 cells shown by Real-time PCR.MACC1 downregulation drastical⁃ly changed the proliferation,colony formation and cell cycle of gastric adenocarcinoma cells in vitro(P<0.05).The expres⁃sions of MACC1,CDK4,CCND1 and c-myc proteins in cells of MACC1 silence group were much lower while P21 expres⁃sion level was much higher than those in negative control.ConclusionDown-regulation of MACC1 result in blocking cell cycle,inhibiting proliferation of MGC-803 cells.So it may serve as a promising target in the treatment of gastric cancer.
stomach neoplasms;adenocarcinoma;cell proliferation;cell cycle;RNA interference;MACC1;MGC-803 cell
R735.2
A
10.11958/j.issn.0253-9896.2015.08.007
广西科技大学附属柳州市人民医院急症科(邮编545006)
罗毅(1978),男,副主任医师,硕士,主要从事胃肠道肿瘤发病机制研究

