香菇多糖联合化疗治疗老年结直肠癌患者的临床疗效及安全性研究*
张瑜 倪婷婷 李亚 张汉群 李馨 薛英波
结直肠癌是老年人最常罹患的恶性肿瘤之一,占老年肿瘤的20%左右[1-2]。老年结直肠癌起病隐匿、早期症状不典型,确诊时大都处于中晚期,失去手术机会,化疗是其主要治疗措施。但是,老年患者常常合并多种并发症、体质弱、化疗耐受性差,如何制定实施合理、有效、耐受性佳的治疗方案迄今临床上尚无统一标准。香菇多糖是恶性肿瘤辅助治疗重要的免疫调节药物,可显著改善机体免疫功能[3-4]。本研究采用香菇多糖联合含氟尿嘧啶类化疗方案治疗老年结直肠癌,探讨其对老年结直肠癌患者化疗疗效、耐受性及安全性的影响。
1 资料与方法
1.1 一般资料 选取2012年1月-2014年1月本院肿瘤科收治的经组织病理学诊断的结直肠癌老年患者148例。纳入标准:(1)年龄≥60岁;(2)经结肠镜活检后病理诊断为结肠癌者;(3)因肿瘤分期或临床状况不能手术者。排除标准:(1)病理检查提示肿瘤组织学类型非腺癌者;(2)因重要脏器功能不全不能耐受化疗者;(3)合并免疫系统疾病史者;(4)不能按计划治疗、复查及随访者。将患者按随机数字表法分为两组,治疗组采用含氟尿嘧啶类化疗方案的同时给予香菇多糖,对照组仅给予含氟尿嘧啶类化疗方案。本研究的148例患者,依照排除标准排除病例13例,未按计划完成治疗或失访者共7例,实际纳入病例128例。其中,男71例,女57例;年龄60~82岁,中位年龄70岁;治疗前基线KPS评分60~80分,中位数70分;结肠癌61例,直肠癌67例;病理分型:乳头状腺癌53例,管状腺癌45例,黏液腺癌30例。其中治疗组63例、对照组65例。两组患者的性别、年龄、肿瘤分期、病理分型、治疗前KPS评分比较差异均无统计学意义(P>0.05),具有可比性。
1.2 治疗方案 治疗组与对照组均采用XELOX(奥沙利铂+卡培他滨)或FOLFOX4(奥沙利铂+亚叶酸钙+5-氟尿嘧啶)化疗方案,21 d为1周期,给予6~9周期或至疾病进展,化疗期间给予对症支持治疗。治疗组化疗期间给予香菇多糖1 mg,每周2次,连用3周为1周期,配合化疗周期,连续治疗6~9周期。所有患者治疗期间均未使用其他生物反应调节剂或对免疫功能有影响的药物或疗法。中位化疗周期5周期(范围:3~9周期)。
1.3 化疗毒副作用 两组患者均于化疗后评价毒副作用(不良事件),根据WHO抗癌药毒副反应分级标准分为0~IV度,比较两组患者用药后的毒副反应。本研究不良事件观察项目包括:血常规(白细胞、血小板)、肝肾功能[谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素氮、肌酐]、胃肠道反应(食欲减退、恶心、呕吐、腹泻)、手足综合征及周围神经毒性(肢体末端感觉障碍和/或感觉异常,伴或不伴痛性痉挛)。
1.4 免疫功能测定 所有患者均于第1次化疗前1周、化疗计划结束后3周,分别采取外周静脉血5 mL,送检贵州省人民医院中心实验室,采用流式细胞仪分析检测T细胞亚群(CD3+、CD4+、CD8+)和NK细胞。
1.5 生活质量评定 以卡式评分(Karnofsky performance status, KPS)为基础的评价标准:下降:KPS评分减少≥10分;稳定:KPS评分无明显变化;好转:KPS评分增加≥10 分, 并维持4周以上。有效=好转+稳定。
1.6 疗效评价标准 根据影像学复查结果,按照实体瘤评价标准(Response evaluation criteria in solid tumors,RECIST):部分缓解( partial response,PR)、疾病稳定( stable disease,SD)、疾病进展(disease progression,PD)。患者化疗6~9个周期内每次评价疗效均为PR者归为PR组;至少有一次为SD,且无PD者归为SD组;评价疗效出现PD者归为PD组;治疗期间PR或SD,随访时出现PD者为再次PD组。有效率(RR)=CR+PR。疾病控制率(DCR)=CR+PR+SD。
1.7 随访 随访时间自化疗结束开始之日算起,要求患者每3个月门诊复查,并由指定医生完成评价、记录,截止时间2014年6月,失访4例,随访时间5~16个月,中位随访时间9.7个月。
1.8 统计学处理 所有数据资料均使用SPSS 14.0软件处理,计量资料以(±s)表示,比较采用t检验,计数资料比较采用 字2检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 治疗前后两组免疫功能的比较 治疗前,两组的免疫功能指标比较差异无统计学意义(P>0.05)。治疗组治疗后CD4+/CD8+、CD4+、CD3+、NK细胞较治疗前明显升高,差异有统计学意义(P<0.05),CD8+较治疗前无明显变化。对照组治疗后CD4+/CD8+、CD4+、CD3+、NK细胞较治疗前有所下降,CD8+升高,见表1。
2.2 两组生活质量改变的比较 治疗组的有效率为81.0%(51/63),对照组有效率为61.5%(40/65),差异有统计学意义(P<0.05),见表2。
2.3 两组疗效的比较 治疗组化疗后RR、DCR分别为63.1%、93.7%,对照组化疗后RR、DCR分别为58.5%、92.3%,两组比较差异均无统计学意义(P>0.05),见表3。
2.4 两组化疗毒副作用的比较 两组均未发生IV度不良反应及治疗相关性死亡,两组不良反应以血液学毒性、消化道反应、神经毒性为主。骨髓抑制发生率治疗组65.1%(41/63),对照组95.4%(62/65),差异具有统计学意义(P<0.05),其中Ⅱ~Ⅲ度白细胞减少发生率:治疗组36.5%(23/63),对照组47.7%(31/65),差异有统计学意义(P<0.05),两组均未发生Ⅲ~Ⅳ度血小板降低。消化道反应主要表现为恶心、呕吐,发生率治疗组69.8%(44/63),对照组84.6%(55/65),其中Ⅱ~Ⅲ度发生率治疗组17.5%(11/63),对照组27.7%(18/65),差异有统计学意义(P<0.05)。神经系统损害主要表现为外周神经感觉异常或迟钝,遇冷刺激后加重,发生率分别为30.2%和46.2%,差异有统计学意义(P<0.05)。其余不良反应如腹泻、肝肾功能异常、手足综合征发生率较低,两组比较差异均无统计学意义(P>0.05),见表4。
表1 治疗前后两组免疫功能的比较(±s)
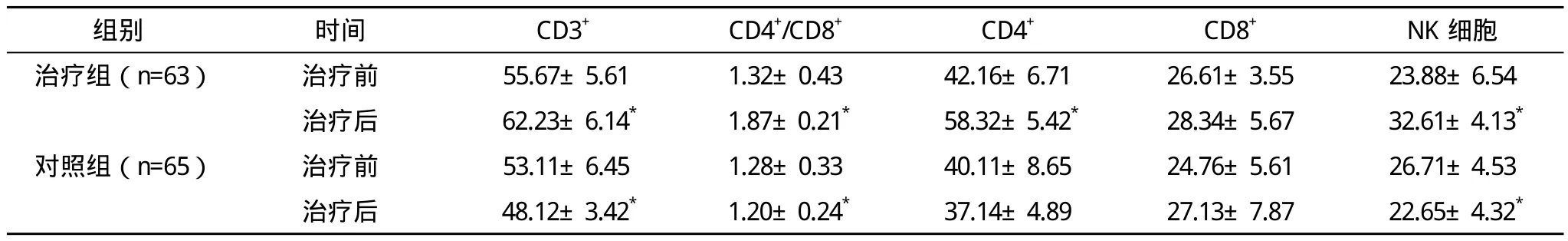
表1 治疗前后两组免疫功能的比较(±s)
*与本组治疗前比较,P<0.05
组别 时间 CD3+ CD4+/CD8+ CD4+ CD8+ NK细胞治疗组(n=63) 治疗前 55.67±5.61 1.32±0.43 42.16±6.71 26.61±3.55 23.88±6.54治疗后 62.23±6.14* 1.87±0.21* 58.32±5.42* 28.34±5.67 32.61±4.13*对照组(n=65) 治疗前 53.11±6.45 1.28±0.33 40.11±8.65 24.76±5.61 26.71±4.53治疗后 48.12±3.42* 1.20±0.24* 37.14±4.89 27.13±7.87 22.65±4.32*

表2 两组生活质量改善的比较

表3 两组治疗疗效的比较

表4 两组不良反应的比较 例
3 讨论
结直肠癌约占全世界新发肿瘤的10%,为女性第三、男性第四的常见恶性肿瘤[5]。近年来,我国结直肠癌的发病率和死亡率呈持续上升趋势,发病率和死亡率在恶性肿瘤发病和死亡谱中位居第3~6位[1-2,5]。其中,老年患者约占新发结直肠癌人群的20%[1-2]。老年结直肠癌患者常常因为肿瘤分期较晚或合并多种复杂基础疾病而失去手术根治机会,是临床上比较特殊的人群,以氟尿嘧啶类药物为基础的化疗是其主要治疗方式。但是,联合化疗增加细胞毒性,损伤机体免疫力系统,同时引起造血功能异常及胃肠道反应,使老年患者的生活质量受到显著影响,耐受性降低,从而降低治疗的依从性。临床工作中,在考虑化疗方案治疗疗效的同时,还应注意降低治疗毒副反应,提高治疗耐受性。
生物治疗是近年来肿瘤治疗的研究热点,香菇多糖是从香菇子实体中提取纯化的一种新型生物反应调节剂,具有免疫调节功能及抗肿瘤活性[3-4,6-8]。体内外试验均证实,香菇多糖通过激活免疫系统,促进淋巴细胞增殖与分化,促进细胞毒T细胞的产生并提高CTL细胞杀伤力、增强NK细胞识别癌变细胞,提高抗原递呈功能,提高机体依赖性细胞毒作用[9-10]。本研究中,采用香菇多糖联合一线氟尿嘧啶化疗方案治疗老年结直肠癌患者,与常规化疗方案相比,尽管两组患者的疾病控制率无明显统计学差异,但联合香菇多糖治疗组患者骨髓抑制、消化道反应、神经毒性等不良反应发生率显著低于对照组(P<0.05),化疗后生活质量高于对照组(P<0.05),化疗后免疫功能改善高于对照组,这可能是由于香菇多糖可通过增加细胞及免疫反应刺激淋巴细胞、巨噬细胞、中性粒细胞恢复,改善机体免疫力进而提高治疗耐受性[11-16]。
综上,在老年结直肠癌患者中,尤其是免疫功能低下的人群,应用联合化疗方案同时给予香菇多糖,可以缓解化疗毒副反应、改善免疫功能、提高患者的化疗耐受性,提高生活质量,值得临床推广应用,但其是否可以改善肿瘤患者的远期生存尚待进一步研究。
[1]马建堂.2010 年第六次全国人口普查主要数据公报(第1号)[EB/OL].[2011-04-28].
[2]陈琼,刘志才,程兰平,等. 2003-2007 年中国结直肠癌发病与死亡分析 [J].中国肿瘤,2012,21(3) :179-182.
[3] Ina K, Kataoka T, Ando T. The use of lentinan for treating gastric cancer[J]. Anticancer Agents Med Chem, 2013,13(5): 681-688.
[4] Wang J L, Bi Z, Zou J W, et al. Combination therapy with lentinan improves outcomes in patients with esophageal carcinoma [J]. Mol Med Rep, 2012, 5(3):745-748.
[5] Akio Ooyama, Toshinori Oka. Anti-angiogenic effect of 5-Fluorouracil-based drugs against human colon cancer xenografts [J].Cancer Letters, 2008,25(5):23-24.
[6] Higashi D, Seki K, Ishibashi Y, et al. The effect of lentinan combination therapy for unresectable advanced gastric cancer[J].Anticancer Res, 2012,32(6): 2365-2368.
[7] Hazama S, Watanabe S, Ohashi M, et al. Efficacy of orally administered superfine dispersed lentinan (beta-1, 3-glucan) for the treatment of advanced colorectal cancer[J]. Anticancer Res,2009, 29(7): 2611-2617.
[8] Yoshino S, Watanabe S, Imano M, et al. Improvement of QOL and prognosis by treatment of superfine dispersed lentinan in patients with advanced gastric cancer[J]. Hepato Gastroen Terology, 2010, 57(97): 172-177.
[9] Hou X J, Chen W. Optimization of extraction process of crude polysaccharides from wild edible BaChu mushroom by response surface methodology [J]. Carbohyd Polym, 2008, 72(1): 67-74.
[10] Drandarska I, Kussovski V, Nikolaeva S, et al. Combined immunomodulating effects of BCG and Lentinan after intranasal application in guinea pigs [J]. Int Immunophar Macol, 2005, 5(4):795-803.
[11] Ina K, Furuta R, Kataoka T, et al. Lentinan prolonged survival in patients with gastric cancer receiving S-1-based chemotherapy[J].World J Clin Oncol, 2011, 2(10): 339-343.
[12] Higashi D, Seki K, Ishibashi Y, et al. The effect of Lentinan combination therapy for unresectable advanced gastric cancer[J].Anticancer Res, 2012, 32(6): 2365-2368.
[13]唐滟,张兵,谢军.同步放化疗治疗术后复发性直肠癌的近期疗效观察[J].中国医学创新,2012,9(5):30-31.
[14]李尚东,席量,张勇.高龄梗阻性结直肠癌的外科治疗[J].中国医学创新,2012,9(17):90-91.
[15]王国方,唐敏.两种化疗方案治疗Dukes B,C期直肠癌术后的临床效果评价[J].中国医学创新,2012,9(18):8-9.
[16]张静,裴毅.LGT不同表达对结直肠癌术后FOLFOX方案巩固化疗的远期生存的分析[J].中国医学创新,2012,9(23):6-8.

