足月妊娠羊水过少患者羊膜和胎盘的组织病理学及组织化学变化
石凡华
羊水是胎儿生长发育所必需的内环境,羊水质量与否严重影响胎儿的发育。妊娠末期发生的羊水过少,大大增加了胎儿宫内窘迫、新生儿窒息和死亡的发生率和剖宫产率[1-2]。发病率较高,发病机制不明确。羊水过少可发生于妊娠不同时期,一般认为与某些病理性妊娠有关,资料报道检出率有升高的趋势[3-5],引起了人们的广泛关注,是科学研究的热门课题。虽然对羊水过少发生机制的研究很多,但在组织病理学和组织化学方面的研究尚很少,本研究采用常规组织学技术和特殊的组织化学技术,对羊膜和胎盘组织进行形态学及形态计量学研究,旨在为羊水过少的发病机制研究提供形态学依据。
1 资料与方法
1.1 一般资料 选择近年在泰山医学院附属医院产科和泰安市妇幼保健院产科足月分娩产妇,其中羊水过少15例(羊水过少组),正常妊娠15例(对照组)。应用羊水指数(AFI)法[6],羊水量产前超声检测提示AFI≤8.0 cm,破膜时羊水量少于300 mL确定为羊水过少。两组产妇均为选择性剖宫产,并排除内科合并症、其他产科并发症及胎儿畸形,无药物服用史,无缩宫素引产史及母体脱水等因素。
1.2 标本采集与处理 每例标本取羊膜1.5 cm×1.5 cm各两块;胎盘取中央和边缘部(距胎盘边缘约1 cm)1.0 cm×1.0 cm×全厚各两块。所取标本迅速用生理盐水冲洗,放入10%福尔马林固定6~12 h后,羊膜修至约1.0 cm×1.0 cm,胎盘组织约0.6 cm×0.6 cm×全厚,后者继续固定24 h左右。常规组织学技术处理,石蜡切片,连续切片厚5 μm,隔5片取相邻2片(每例共取6片)分别进行常规(HE)染色和组织化学阿利新蓝-糖原(AB-PAS)染色,在Nikon高清晰彩色病理图像分析系统下,对标本进行观察和计量分析。
1.3 统计学处理 使用统计学软件SPSS 11.0对数据进行分析,均数的比较采用两独立样本t检验的方法,P<0.05为差异有统计学意义。
2 结果
2.1 羊膜 低倍镜下两组均可辨5层结构,即上皮层、基底膜、致密层、纤维母细胞层及海绵层(是羊膜厚度的主要组成部分)。由于前两层(羊膜细胞和基膜)与相邻层连接疏松,故多与深层分离。对照组羊膜上皮细胞多呈立方形(6例)和低柱状(9例),排列整齐紧密,界限清楚,平均高度为5.5 μm,胞质呈弱嗜酸性均质状;核大椭圆形或圆形。在AB-PAS染色的标本上,羊膜上皮细胞AB反应呈阴性、PAS反应阳性,胞质呈淡红色,多数胞质内可见细小的PAS强阳性颗粒,基膜厚薄均匀,因基膜内多糖含量较多,PAS反应呈强阳性,基膜清晰可辨(图1)。羊水过少组的羊膜细胞形态差别较大,从扁平形(2例)、立方形(4例)低柱状(8例)至宽大的高柱状(6例,其中2例复层鳞状化生)不等,以高低不同的柱状为主,平均高度约为8.7 μm。高柱状细胞胞质呈泡沫状,核相对较小。基膜厚薄不均甚至有不连续的现象,复层鳞状化生者表层细胞宽大,胞质内充满大小不等的空泡(图2)。扁平形的羊膜细胞,多数已纤维化,胞质极少,胞核固缩深染(图3)。
2.2 胎盘组织 绒毛多被横断,绒毛间隙较大,间隙内可见数量不等的母血细胞。在绒毛表面上皮中,细胞滋养层不连续、细胞较少,以合体滋养细胞为主。合体细胞界限不清,合胞体结节(syncytail knot)多见。在AB-PAS染色的标本上,两组绒毛组织AB染色均呈阴性反应,间质呈弱阳性反应。对照组在不同染色的标本上,胎盘中央及边缘部结构无明显差异,故不需分别描述。绒毛血管显著扩张,每一绒毛通常含有4~6个血管断面,位于绒毛周边的毛细血管与绒毛壁形成血管合体膜(vasculosyncytial membrane),薄而均匀(图4)。胎盘绒毛膜板内有密集而粗大的PAS阳性颗粒,滋养细胞胞质内PAS阳性颗粒细密。羊水过少组绒毛间隙与绒毛结构与对照组相似,但合体结节明显增多、深染(图5)。绒毛中轴血管扩张,间质水肿(图6),血管断面数与对照组无明显差异。滋养细胞胞质内PAS阳性颗粒少见,可见基膜增厚及厚薄不均的现象。镜下对合体结节进行计数,计数方法是高倍镜(×400)下每例胎盘随机计数10个不重复视野内绒毛数及合体结节个数;计数绒毛中轴毛细血管断面总数及形成血管合体膜的血管数;同时测量血管合体膜的厚度,测试方法是在PAS染色标本上,油镜下(×1000)每张切片随机观察不重叠的视野,测量血管合体膜厚度,每例标本至少测量10个血管合体膜,计算出合体膜的平均厚度,结果见表1。
表1 胎盘绒毛合体结节及间质血管比较(±s)
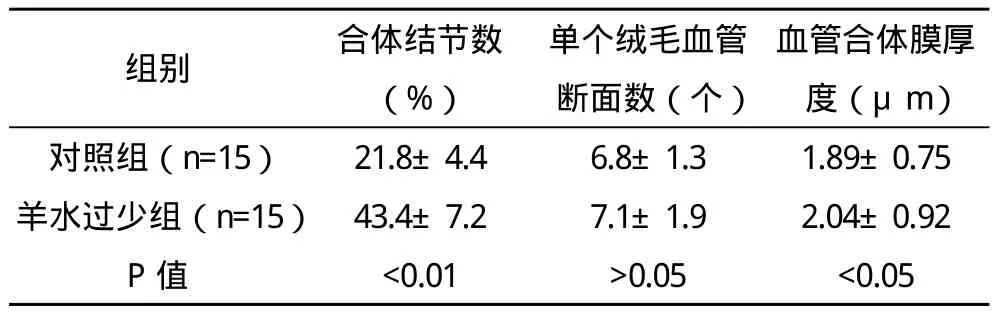
表1 胎盘绒毛合体结节及间质血管比较(±s)
血管合体膜厚度(μm)对照组(n=15) 21.8±4.4 6.8±1.3 1.89±0.75羊水过少组(n=15) 43.4±7.2 7.1±1.9 2.04±0.92 P值 <0.01 >0.05 <0.05组别 合体结节数(%)单个绒毛血管断面数(个)
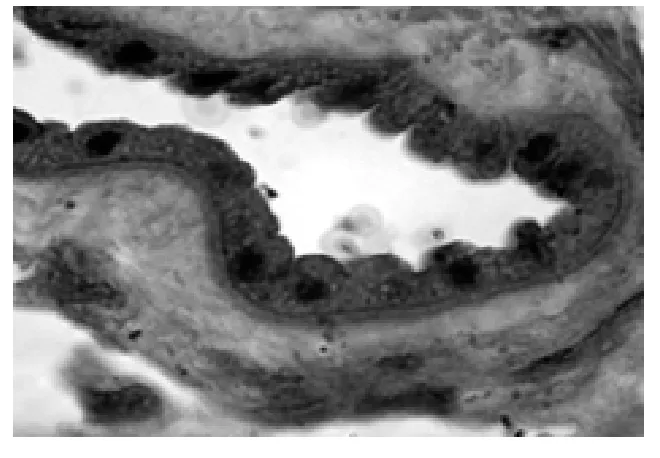
图1 正常羊膜上皮(×1000)
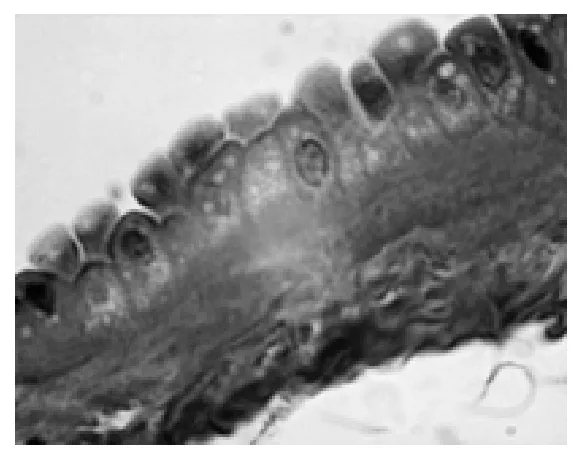
图2 羊水过少羊膜(×1000)
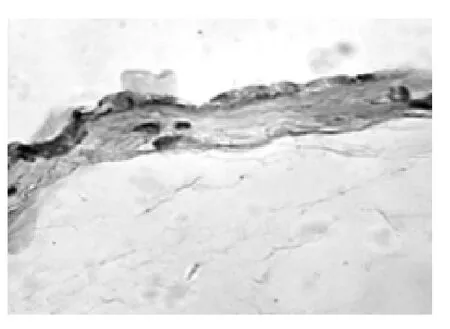
图3 羊水过少羊膜(×400)
3 讨论

图4 正常胎盘绒毛(×400)
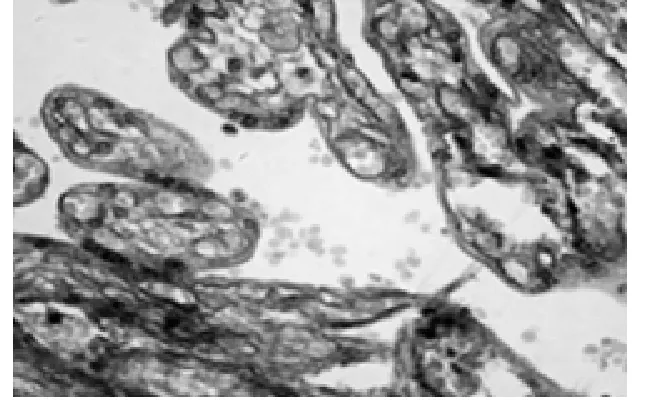
图5 羊水过少绒毛(×400)
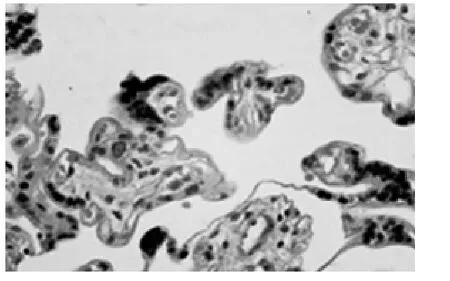
图6 羊水过少绒毛(×400)
人羊膜表面光滑,上皮细胞数量约2亿左右,细胞表面有密集的微绒毛,整张羊膜展开可达2 m2。该上皮有活跃的物质转运功能,参与羊水的形成和传递,还能合成、分泌和形成基底膜和细胞外间质成分,并可分泌多种促生长因子、抗凋亡因子等[7-8]。一直以来,对不同病理性妊娠的研究,多集中于胎盘,而忽略了对孕晚期羊膜的研究。孕早期羊膜细胞多为扁平形,类似于毛细血管内皮,具有良好的透析和分泌功能,是分泌羊水功能最旺盛的时期。本实验观察到正常足月妊娠羊膜细胞大部分变为立方形和低柱状,而羊水过少组羊膜细胞则以低柱状和高柱状为主且胞质内充满空泡。虽然有报道指出羊膜上皮可复层鳞状变,但未见先关图片,本实验观察到羊膜上皮有明显的复层鳞状化生现象,图片清晰结构典型,实为难得(见图2)。虽然有2例细胞为扁平形,但细胞结构致密纤维化,已处于固缩死亡状态,是细胞遭受缺氧引起的重度退变,非但失去了液体传递功能及分泌功能,而且形成了一层致密的屏障,阻碍了羊膜对羊水平衡功能。对照组羊膜细胞特别是立方形细胞内有细小的糖原颗粒,但在羊水过少组已很难看到,多被空泡代替,这种空泡多为线粒体及其他细胞器肿胀变性的表现,特别是线粒体的变化,会严重影响细胞的能量代谢。羊膜的特殊位置及结构注定能量获取艰难,糖原是细胞进行功能活动的能量来源,羊水过少患者细胞老化空泡变,糖原匮乏,也可能是羊水分泌减少的原因之一。
胎盘是母胎营养成分和激素信号的来源,因此,胎盘的正常结构对胎儿的发育是至关重要的。孕晚期胎盘绒毛表面主要被覆合体细胞,合体细胞无核部与毛细血管之间的血管合体膜,是母胎进行物质交换的必由之路。合体细胞聚集,局部增厚形成合体结节,使结节外只留薄层胞质,血管合体膜变薄,有利于妊娠晚期母胎之间的物质交换。随孕龄增加合体结节增加,一定量的合胞体结节是胎盘成熟的标志[9-10]。Loukeris镜下对不同孕期含合体结节的绒毛进行了统计,结果显示20~25周为5.2%~9.l%,26~33周为10.8%~14.7%,36周为22.5%,37~40周为28%[11]。有学者认为0~10%者为低结节,10%~30%者为平均结节,30%以上者为高结节,并认为42周以后高结节显著上升[12]。本研究结果对照组为21%,羊水过少组为45%,两组比较有差异有统计学意义(P<0.01)。因此,过多的合胞体结节,则是胎盘老化、退化凋亡过度等病理变化的结果,是胎盘、胎儿遭受缺氧的一个指征。本实验还显示羊水过少组血管合体膜厚度增加,与对照组比较差异有统计学意义(P<0.05),这种结果与合胞体结节的升高、胎盘老化是相辅相成的。过多的合体结节和血管合体膜增厚导致羊水过少形成的机理,笔者认为与下列因素有关:(1)合体细胞核聚集、深染是细胞转录失活、细胞凋亡的不可逆表现,大量合体细胞的不作为,大大降低了胎盘的转运及分泌功能;(2)结节处厚度增加、结构致密,占据了血管合体膜的面积,合体结节增多常伴有胎盘宫内异常灌注,胎盘本身处于低氧或缺氧状态,细胞缺氧氧化应激反应过度激活,进一步加重绒毛上皮的损伤[13-14];(3)血管合体膜增厚增大了交换距离,降低了物质和气体的交换速率,所有变化均指向一个病理生理结局,胎盘缺氧、血灌流不足循环能力下降,导致胎儿宫内慢性缺氧,血流必然重新分配,肾血流量减少,尿量减少,最终使羊水减少。
羊膜和胎盘绒毛的这些组织病理学改变为羊水过少发生找到了形态学依据,笔者认为形态学变化与羊水减少互为因果,形成了恶性循环。关于羊膜细胞、胎盘绒毛上皮损伤的程度与羊水过少程度之间的相关性,值得进一步研究。
[1] Ohana O, Holcberg G, Sergienko R, et al.Risk factors for intrauterine fetal death (1988-2009)[J].J Matern Fetal Neonatal Med,2011,24(9):1079-1083.
[2]苏桂兰.过期妊娠羊水过少对围生结局的影响[J].中国医学创新,2012,9(23):45-46.
[3]谢惠,尹春艳.羊水过少的病因学分析[J].医学综述,2013,19(5):884-886.
[4] Smith R, Maiti K, Aitken R J.Unexplained antepartum stillbirth:a consequence of placental aging?[J].Placenta,2013,34(4):310-313.
[5]覃友爱,董林红,吴爱民.羊水过少发生率升高相关因素分析[J].中国妇幼保健,2008,23(12):1862-1864.
[6] Petrozella L N, Dashe J S, Mclntire D D, et al.Clinical significance of borderline amniotic fluid index and oligohydramnios in preterm pregnancy[J].Obstet Gynecol,2011,117(2 Pt 1):338-342.
[7]马晓峰,董乐乐.人羊膜的研究进展[J].中国医药指南,2013,11(26):51-52.
[8] Litwiniuk M, Grzela T.Amniotic membrane:new concepts for an old dressing[J].Wound Repair Regen,2014,22(4):451-456.
[9]成令忠,钟翠平,蔡文琴.现代组织学[M].上海:上海科学技术文献出版社,2003:1047-1054.
[10] Sankar K D, Bhanu P S, Kiran S, et al.Vasculosyncytial membrane in relation to syncytial knots complicates the placenta in preeclampsia:a histomorphometrical study[J].Cell Biol,2012,45(2):86-91.
[11] Loukeris K, Sela R, Baergen R N.Syncytial knots as a reflection of placental maturity:reference values for 20 to 40 weeks gestational age[J].Pediatr Dev Pathol,2010,13(4):305-309.
[12]赵一平,陈谓芬.ICP围产儿死亡与胎盘病变的关系[J].现代妇产科进展,2000,22(2):126-127.
[13] Rajakumar A, Cerdeira A S, Rana S, et al.Transcriptionally active syncytial aggregates in the maternal circulation may contribute to circulating soluble fms-like tyrosine kinase 1 in preeclampsia[J].Hypertension,2012,59(2):256-264.
[14] Fogarty N M, Ferguson-Smith A C, Burton G J.Syncytial knots(Tenney-Parker changes) in the human placenta:evidence of loss of transcriptional activity and oxidative damage[J].Am J Pathol,2013,183(1):144-152.

