食管鳞癌中RhoE与EGFR表达及相关性的研究*
王豪杰 施巩宁 赵辉 梁冰 车建波 王一
我省是食管癌的高发区,研究表明,EGFR和 RhoE均作用于Ras信号通路,并且两者在肿瘤的发生发展中可能分别扮演者癌基因和抑癌基因的角色。有研究发现,在食管鳞状细胞癌体外癌细胞中,RhoE基因的上调可以细胞周期阻滞于G0/G1期,降低癌细胞的侵袭性,促进癌细胞的凋亡[1]。本研究通过RT-PCR方法检测食管鳞状细胞癌中RhoE与EGFR的表达情况,并结合临床其他资料运用统计学方法进行分析,分析两者之间的相关性及其与食管鳞癌的恶性程度及转移情况的关系。为食管鳞状细胞癌的诊断及预后提供新的依据,并为食管鳞状细胞癌的治疗提供新的方向。
1 材料与方法
1.1 材料 本组59例,取材2011年1月-2012年1月本院胸心外科手术切除的食管鳞癌标本为癌症组,同一患者癌旁>5 cm的正常组织为对照组,其中男35例,女24例,年龄48~79岁,平均(53.85±6.36)岁;按照2003版国际抗癌联盟UICC标准分期:I期1例,Ⅱ期28例,Ⅲ期27例,Ⅳ期3例;分化程度按高、中、低分化分别为12、34、13例;有淋巴结转移18例,无淋巴结转移41例。大体分型:髓质型31例、蕈伞型8例、溃疡型8例、缩窄型6例。所有病例术前均未行化疗、放疗、免疫或生物治疗,并且均有完整临床资料以及病理诊断。
1.2 主要试剂 DAB显色剂、TrizolRNA提取液试剂盒、目的基因引物、β-actin基因引物购自上海生基生物科技有限公司,DNA Marker购自广州东盛生物科技有限公司。
1.3 方法
1.3.1 逆转录-聚合酶链反应(reversetranscription PCR,RT-PCR)
1.3.1.1 RNA的提取 标本研磨后,用TaKaRa公司的Trizol试剂和氯仿提取RNA,经异丙醇沉淀,75%乙醇洗涤,室温干燥后加30 μL的DEPC进行沉淀。取2 μL进行1%琼脂糖凝胶测定,另取2 μL稀释50倍后紫外测OD 260的吸光度,其余进行cDNA合成。
1.3.1.2 cDNA合成 根据M-MLV第一链cDNA合成试剂盒(上海生工生物工程技术服务有限公司)使用说明:上述提取的 RNA 4 μL(约 1 μg),Oligo(dT)(5 μM)1 μL,RNase free dH2O 至 6 μL,70 ℃保温10 min,冰上急冷2 min,离心数秒使模版RNA/引物的变性溶液聚集与EP管底部。在上述EP管中再加入2μL 5×M-MLV Buffer,0.5 μL dNTP mix(各 10 mM),0.25 μL RNase Inhibitor(40 U/μL),0.5 μL RTase M-MLV(RNaseH-) 加 RNase free dH2O 至 10 μL,42 ℃,1 h。70 ℃,保温15 min后冰上冷却,得到的cDNA保存-20 ℃,并直接用于下一步PCR扩增。
1.3.1.3 目的条带扩增 参照试剂盒上的说明,按照表1数据配制PCR反应液。加入后,充分混匀,按表2条件进行PCR扩增。
1.3.1.4 琼脂糖凝胶电泳和图像分析 取10 μL PCR扩增产物、2 μL上样缓冲液、1 μL Syber-green混匀,向2.0%琼脂糖凝胶孔中点样,设定电泳条件:电压120 V,电流50 mA,电泳后取出凝胶,在紫外灯下观察并进行扫描及拍照,目的基因及β-actin扩增产物在紫外灯下的荧光条带与Maker比较后,显示扩增产物大小与预期相符。分别为RhoE 169 bp;EGFR 341 bp;β-actin 660 bp;见图1、2。用UVIbland凝胶图像处理软件对扩增产物RhoE、EGFR和β-actin的表达强度进行分析,并计算各个基因的表达相对系数(即目的基因表达强度/β-actin的表达强度)。
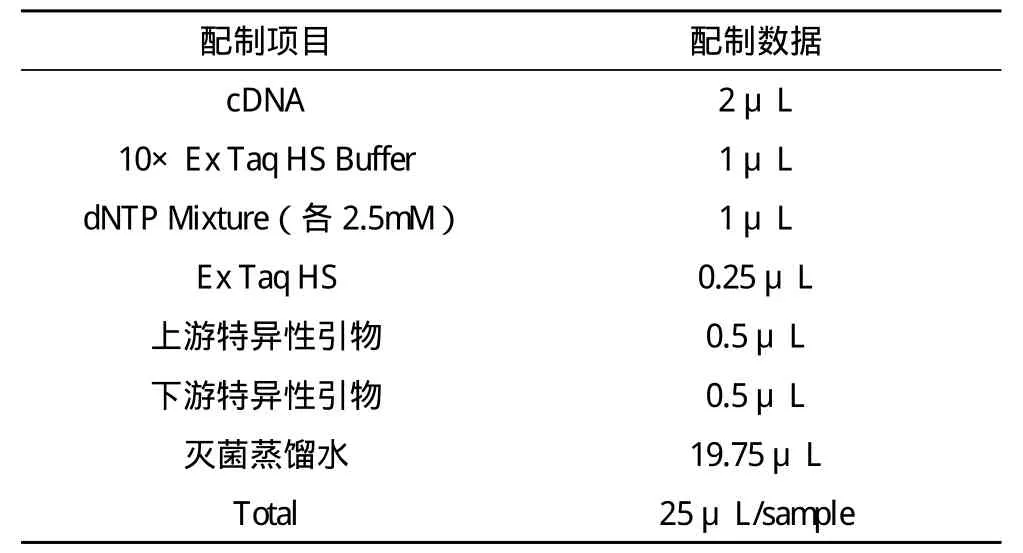
表1 PCR反应液配制数据
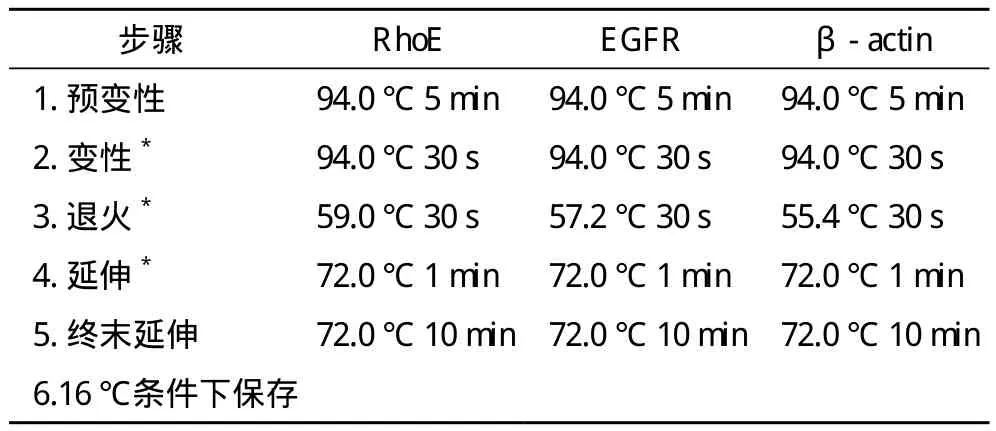
表2 PCR扩增反应条件
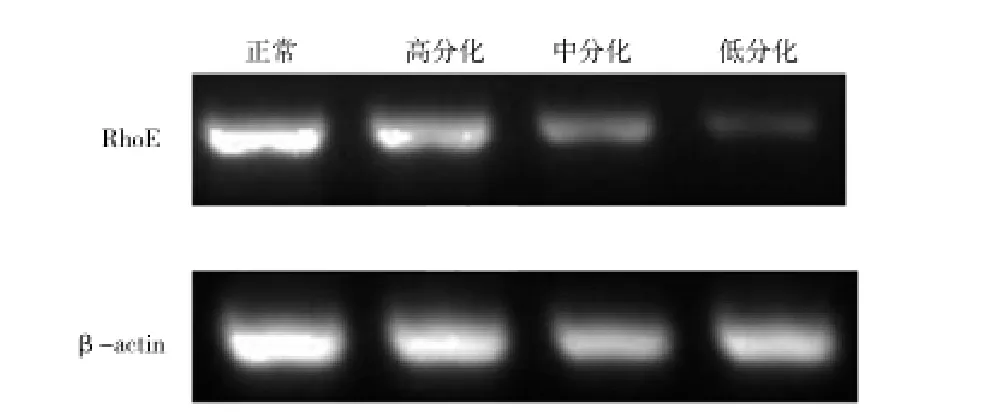
图1 RhoE mRNA在正常食管组织及不同分化程度的食管鳞癌组织中的表达水平
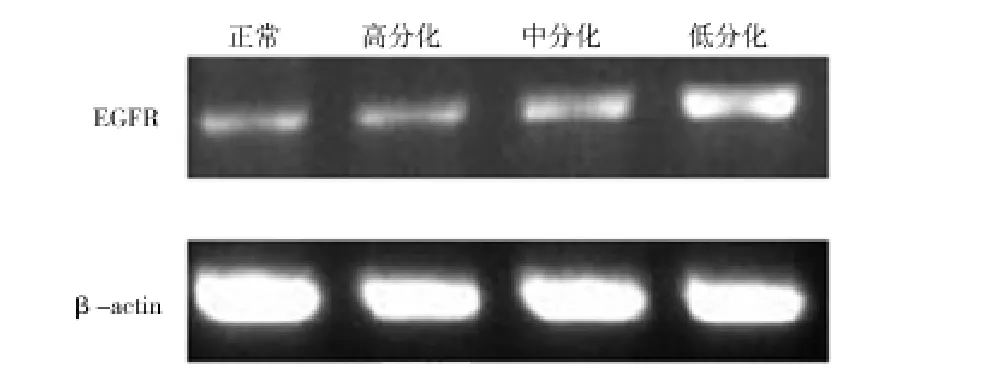
图2 EGFR mRNA在正常食管组织及不同分化程度的食管鳞癌组织中的表达水平
1.4 统计学处理 运用SPSS 17.0对所得数据进行分析,计量资料以(±s)表示,比较使用t(或t')检验,对于三者或者三者以上之间的比较则应用单因素方差分析以及非参数检验等统计学方法进行分析,以P<0.05认为差异有统计学意义。
2 结果
2.1 RhoE与EGFR在食管癌组织及正常组织中的表达 RT-PCR结果显示,食管癌组织中RhoE蛋白呈低表达,EGFR蛋白呈高表达,见表3。
2.2 RhoE与EGFR基因的表达与食管鳞癌的临床病理指标之间的关系 RhoE与EGFR表达水平的高低与食管鳞癌的分化程度、浸润与否、淋巴转移以及病理分期都有着密切的关系(P<0.001),但是与肿瘤的位置、大小和分型无关(P>0.05),见表4。
表3 食管癌组织与对照组RhoE表达情况(±s)
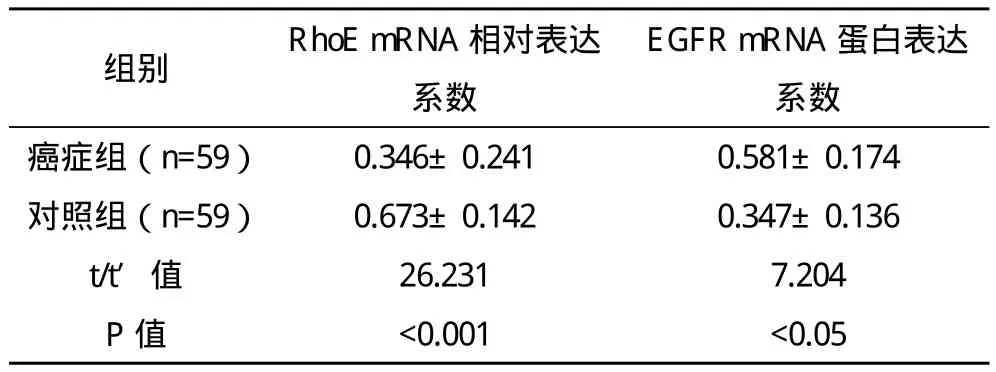
表3 食管癌组织与对照组RhoE表达情况(±s)
EGFR mRNA蛋白表达系数癌症组(n=59) 0.346±0.241 0.581±0.174对照组(n=59) 0.673±0.142 0.347±0.136 t/t′值 26.231 7.204 P值 <0.001 <0.05组别 RhoE mRNA相对表达系数
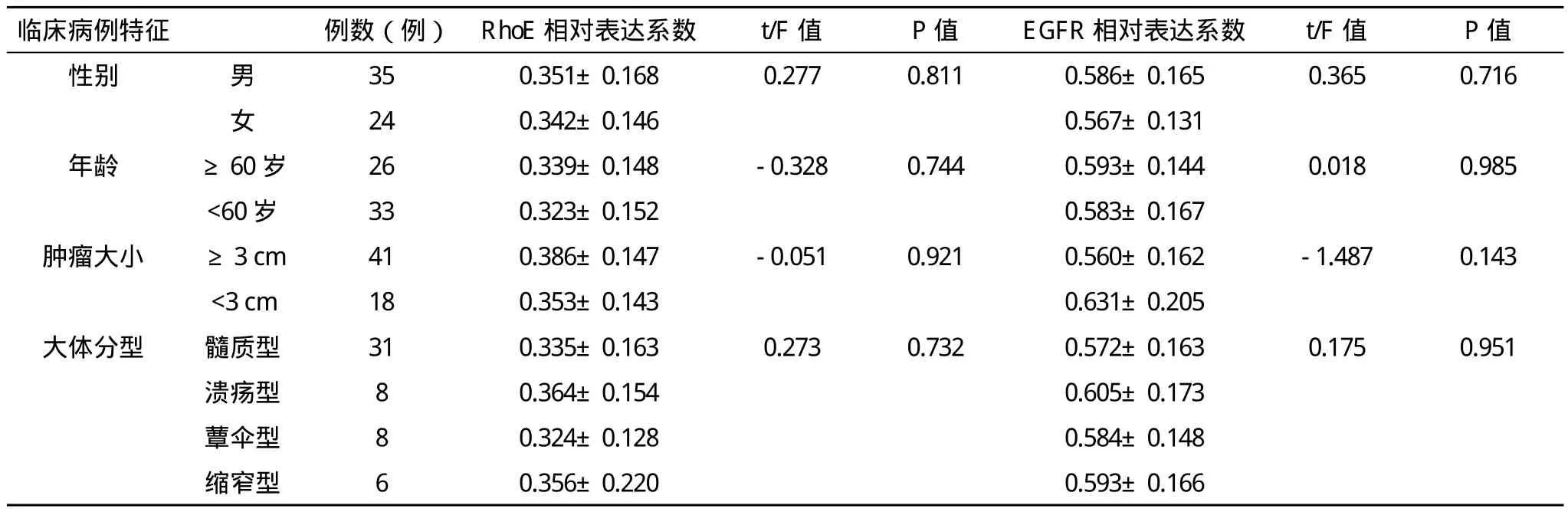
表4 食管鳞癌的病理特征及RhoE、EGFR表达情况
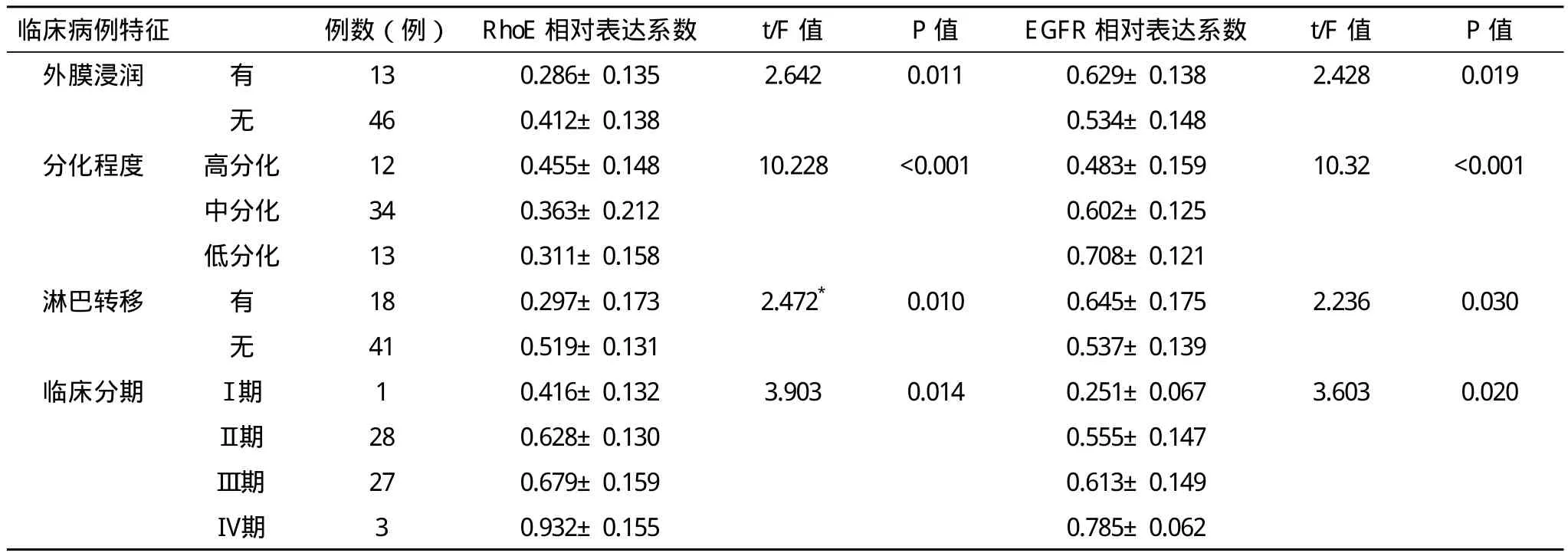
续表4
2.3 食管鳞癌组织中RhoE与EGFR表达的相关性运用Spearman秩相关分析对食管鳞癌组织中RhoE与EGFR mRNA的相对表达系数进行分析,结果显示r=-0.812,P<0.01,提示两者在食管癌组织中的表达呈负相关。
3 讨论
RhoE又称Rnd3,属于一种小分子G蛋白[2];它独特的结构及特点决定了它许多特异的功能。RhoE在很多肿瘤中都存在异常表达,并呈现出一定的特异性[3]。研究表明RhoE可以通过抑制Ras→Raf→MEK→ERK信号通路的传导而抑制细胞周期的进展。Zhao等[1]发现,食管鳞癌体外癌细胞中RhoE基因表达的上调,可以抑制细胞的增值、降低癌细胞的侵袭性、促进细胞的凋亡。
EGFR属于Ⅰ型跨膜酪氨酸激酶生长因子受体,EGFR的经典信号传导通路有:PI3K/PDK1/AKT通路、Ras/Raf/MAPK通路、STATs通路、PLCγ/CaMK/PKC通路。EGFR的核内信号通路属于非经典的信号传导通路,此通路启动后,可以使细胞周期的进程加速[4]。现有研究发现,多种恶性肿瘤细胞的增值、侵袭及转移与EGFR表达水平上调密切相关[5]。
由上述各研究结果可以看出,EGFR和RhoE均作用于Ras传导通路,但两者所起的作用不同,甚至在某些方面是恰恰相反的,目前尚没有研究证明两者之间有无联系以及有着怎样的联系。根据本实验的研究数据不难发现,在食管鳞状细胞癌中,RhoE可能是一个候选的抑癌基因,并反馈抑制EGFR的高表达。因此笔者考虑在进一步的实验中拟通过基因沉默及过表达的方法人为的提高或降低RhoE的表达水平,同时检测EGFR的表达水平,并进一步行动物实验构建食管鳞癌动物模型。如果实验成功,将能够为延缓食管癌的发展、提高患者的生存率、充分评估预后生存以及为食管癌的临床治疗提供新的思路和方法。
[1]Zhao H, Yang J, Fan T.RhoE functions as a tumor suppressor in esophageal squamous cell carcinoma and modulates the PTEN/PI3K/Akt signaling pathway [J].Tumour Biol,2012,33(5):1363-1374.
[2] Foster R, Hu K Q, Lu Y, et al. Identification of a novel human Rho protein with unusual properties; GTPase deficiency and in vivo famesylation[J].Mol Cell Biol,1996, 16 (6): 2689-2699.
[3] Belgiovine C, Frapolli R, Bonezzi K, et al. Reduced expression of the ROCK inhibitor Rnd3 is associated with increased invasiveness and metastatic potential in mesenchymal tumor cells [J].PLoS One,2010,5(11): 141-154.
[4] Hsu J M, Chen C T, Chou C K, et al. Crosstalk between Arg 1175 methylation and Tyr 1173 phosphorylation negatively modulates EGFR-mediated ERK activation[J]. Nat Cell Biol,2011,13(2):174-181.
[5] Al Olayan A, Al Hussaini H, Jazieh A R. The roles of epidermal growth factor receptor (EGFR) inhibitors in the management of lung cancer [J]. J Infect Public Health,2012,5(1):50-60.

