内镜黏膜下剥离术治疗胃食管连接部病变的临床研究▲
覃山羽 姜海行 赵华莹 覃凤燕 李晓敏 阳玉贵
(广西医科大学第一附属医院消化内科,南宁市 530021)
胃食管连接部(gastroesophagealjunction,GEJ)恶性肿瘤的发病率自20世纪70年代起持续升高,以往对GEJ肿瘤行传统的根治性手术是首选方法,但是手术治疗的创伤大,患者恢复慢,术后生活质量低。近年来,随着内镜技术的发展,使内镜下手术治疗GEJ癌前病变和早癌成为可能。近年来,国内外已有运用内镜下黏膜切除术 (endoscopicmucosalresection,EMR)和 ESD(endoscopic submocosal dissection,ESD)治疗 EGJ癌前病变和早癌的报道[1,2]。本研究对2010年10月至2014年9月在我科经ESD治疗的20例GEJ患者临床资料进行分析,旨在探讨ESD治疗GEJ病变的疗效、安全性及应用价值,现报告如下。
1 资料与方法
1.1 临床资料 本研究共纳入20例病例,其中男性16例,女性4例。年龄21~70岁,平均年龄39.4岁。有14例患者内镜检查前有腹胀、腹痛、腹泻、腹部不适等非特异性消化道症状;6例无症状患者,病变为体检时偶然发现。所有病灶均经胃镜检查发现为贲门隆起型病变,病灶长径1.0 ~4.5 cm,平均长径 1.76 cm。内镜下表现为Ⅰ型14个,Ⅱa型4个,Ⅱc型2个。所有患者在术前均行EUS检查以判断病变起源及浸润深度,其中14例起源于黏膜层,1例起源于黏膜肌层,1例起源于黏膜下层,4例起源于固有肌层。所有病灶的局部管壁结构完整,未见壁外脏器压迫,周围无肿大淋巴结。本组患者临床资料详见表1。所有患者术前行超声内镜、胸部X线片、腹部超声和(或)CT检查,了解病灶部位、大小、形态,评估病灶的浸润深度,排除肿瘤淋巴结转移。如患者服用抗凝药物或抗血小板聚集药物均停药7 d再进行治疗,需住院。术前签署知情同意书,并均告知可能获得的益处和风险。
1.2 操作器械 器械为 Olympus GIF-XQ240,Olympus GIF-Q260J,环扫型超声内镜 UMQ-240、频率为 7.5 MHz,超声小探头 UM-2R、频率 12 MHz,UM-3R、频率为20 MHz,ERBE VIO 200S高频电凝器及 APC凝固器,Olympus透明吸帽,medwork注射针,Endo-Flex GmbH圈套器,Cook套扎器,五爪钳,HX-110QR钛夹,Olympus KD-620LR钩型电刀,hook刀,IT刀。
1.3 操作方法 所有患者术前半小时静脉使用抗生素预防感染,随后行气管插管,在全身麻醉下进行手术。操作前于内镜前端置透明帽,手术由有经验的内镜医师操作。具体操作过程如下:进镜确定病灶大致部位后,用氩气刀于距肿物边缘0.5 cm处黏膜环形标记,接着用0.01%肾上腺素液+0.3%靛胭脂溶液行黏膜下注射,使病灶充分抬举,用DUAL刀切开肿物周围黏膜,后用IT刀或钩型电刀逐步剥离病灶,操作过程中观察创面有无出血,如存在出血,予热活检钳、APC、钛夹夹闭、喷洒止血剂(如去甲肾上腺素+冰盐水)等方式止血。完整剥离肿物后,予热活检钳、APC处理出血灶及显露的小血管,必要时予钛夹夹闭创口,并用生理盐水冲洗干净创面。具体操作过程详见图1。
1.4 术后处理 术后禁食2~3 d,严密观察生命征,注意观察有无出血、穿孔、纵隔气肿等并发症。常规使用质子泵抑制剂,营养支持治疗,酌情使用抗生素,2~3 d后逐步恢复流食、半流食饮食。
1.5 随访 术后1~3个月复查上消化道内镜,观察病灶愈合情况及有无病灶残留或复发。
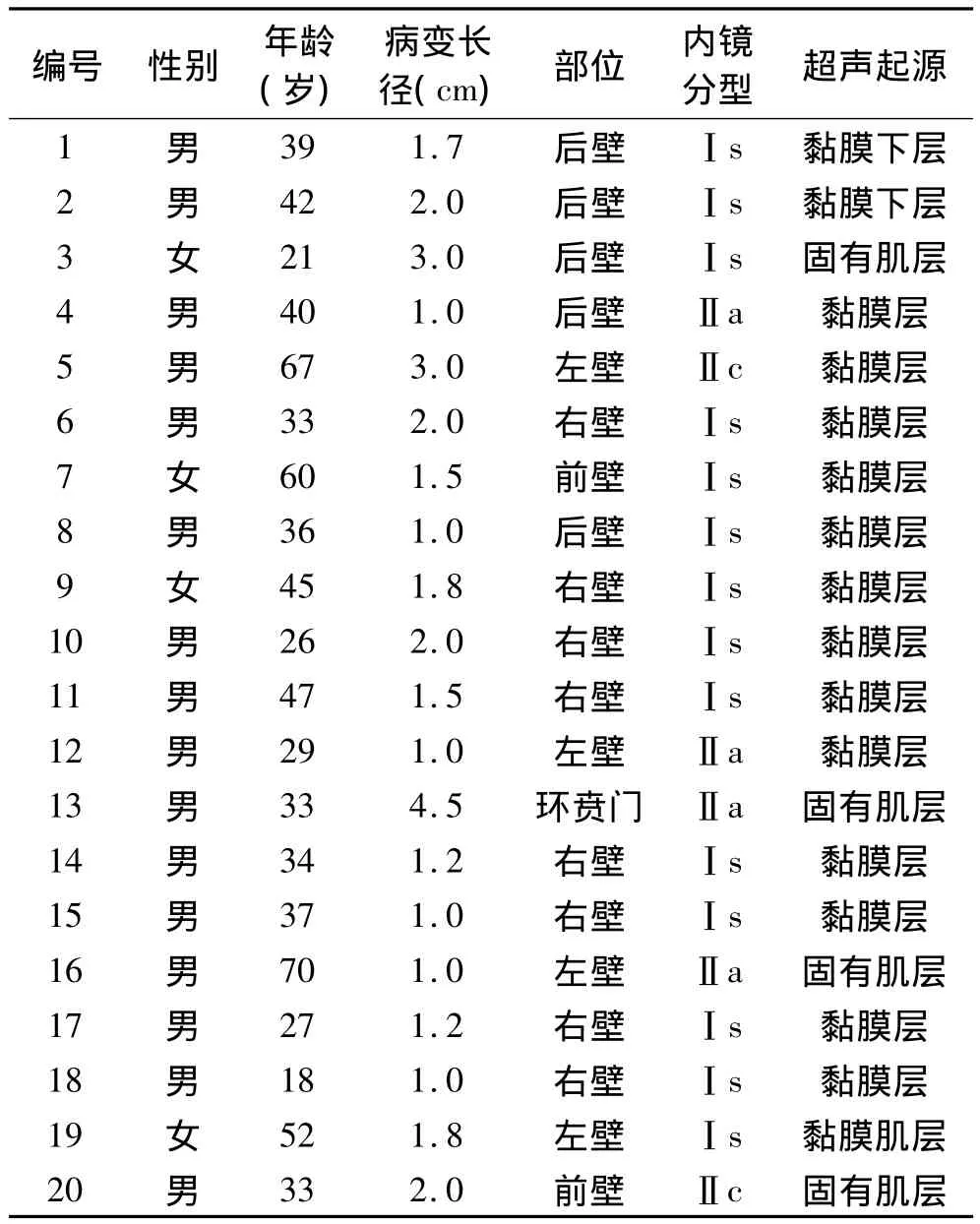
表1 20例胃食管连接部病变患者的部分临床资料
2 结果
2.1 治疗效果 本研究20例患者均能耐受手术,其中15例病灶均由ESD一次性完整切除,5例病灶分块完整切除。病灶长径1.0 ~4.5 cm,平均直径1.76 cm。手术操作时间为30 min~180 min,平均操作时间为84 min。全组病例均无迟发性出血、穿孔、气腹、纵隔气肿等并发症,均无追加外科手术及与手术相关的死亡病例。
2.2 病理结果 20例患者术后病理结果:增生性息肉10例,其中1例病灶腺上皮可见肠上皮化生,1例病灶表面可见溃疡,1例部分食管鳞状上皮呈Barrett食管改变;平滑肌瘤4例;炎症2例;中度不典型增生1例;溃疡病1例,HP(+),部分腺体呈轻-中度不典型增生;管状腺瘤性息肉1例;平滑肌肉瘤1例。
2.3 随访及复查 20例中有18例术后1~3个月内复查内镜,术后1~3个月胃镜随访,所有随访病例病变黏膜基本愈合正常,较大者可见瘢痕形成。7例术中予钛夹夹闭创面的患者,6例术后得到随访,有3例在随访过程见钛夹残留,但患者无腹痛、反酸、恶心等不适症状。所有随访患者均未见病灶残留及复发,且无明显由手术瘢痕引起的局部挛缩、食管狭窄等并发症。本研究所有患者术中、术后、随访情况详见表2。
2.4 并发症 本组病例无延迟性出血、穿孔、气腹、纵隔气肿、贲门狭窄等并发症发生。

表2 20例患者术中、术后、并发症及随访情况
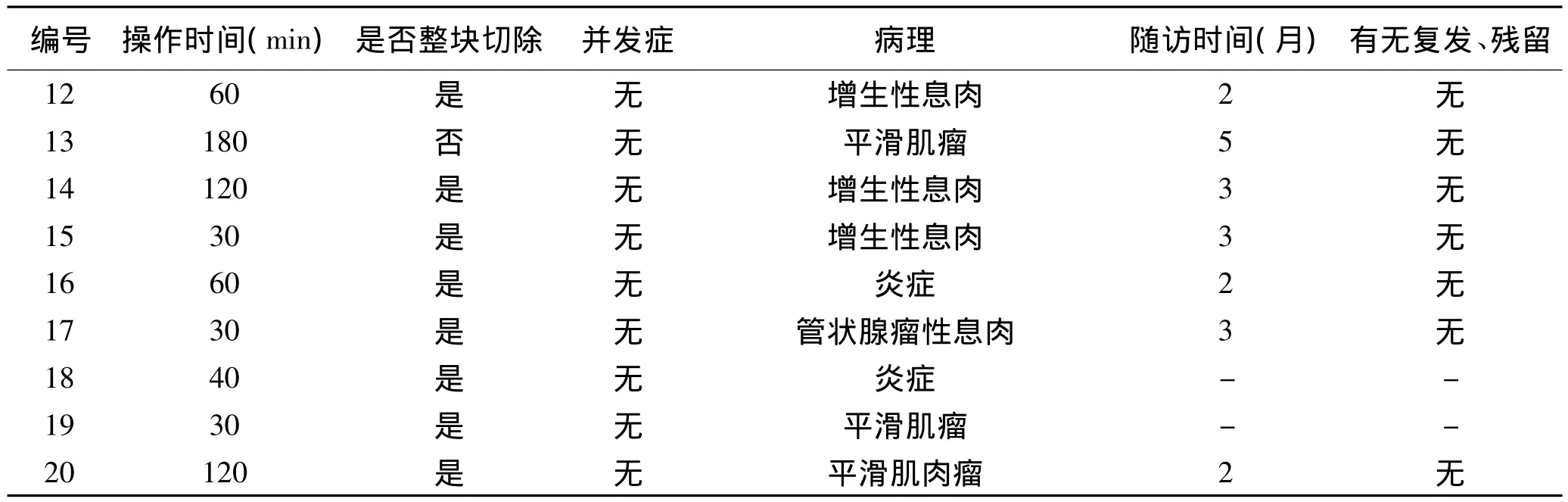
上接表2
3 讨论
GEJ处于胸腹交界处,由于其狭窄的管腔、锐利的角度和特殊的位置,因此传统的GEJ病变治疗方式主要是各种术式的食管和(或)胃切除,有时尚需连带切除周围脏器或组织,存在一定的过度治疗。由于手术治疗的创伤大,并发症多,患者恢复慢,术后生活质量低。近年来,各种内镜微创技术开始流行,随着内镜技术的发展,早期病变的诊断率增高,对于一些局限于黏膜内或黏膜下而没有淋巴结转移的GEJ早癌或者癌前病变,理论上只要进行局部切除就可以治愈。近年来,EMR和ESD开始逐渐应用于消化道早癌和癌前病变的治疗,并取得了很好的疗效[3,4]。根据日本胃癌协会发表的胃癌治疗指南,EMR可用于治疗病变<2 cm且没有淋巴结转移的早期胃癌[5],而 Shiro Oka等对688位早期胃癌患者行EMR手术,结果表明即使是<2 cm的病变,其整块切除率仅为47.8%,经病理证实的完整切除率仅为26.9%[6]。随着ESD技术的发展,由于ESD的整块切除率高,且对于大多数黏膜下肿物而言,不管大小和形态如何,ESD都能整块切除肿物,因此ESD作为一种新型的内镜切除技术被广泛应用[4]。近几年,ESD也开始用于切除GEJ病变,甚至是GEJ癌前病变及早期肿瘤[1,7]。
早期消化道肿瘤的治愈性切除率越高,则肿瘤的复发率越低。Shiro Oka等报道随访的347例用EMR整块切除的溃疡阴性不论大小及形态的早期胃癌患者中,其复发率为2.9%(10/347),而分片切除的478例患者中,肿瘤复发率为4.4%(21/478),随访162例用ESD整块切除的溃疡阴性不论大小及形态的早期胃癌患者中,无一例复发[6]。我国学者邹晓平等[2]对28例经ESD切除和51例经EMR切除的GEJ癌前病变及早癌研究中,ESD组治愈切除率为 78.6%,EMR组为 43.1%(P<0.05)。局部原位复发率ESD组为3.6%,EMR组为19.6%(P<0.05),且复发者中分片切除的占72.7%。由此可见,整块切除率及治愈性切除率越高,复发率越低。本研究中所有病例在随访过程中均未出现复发。但本研究随访时间较短,最长者仅为22个月,且本研究中75%(15/20)为局限于黏膜层(包括黏膜肌层)的良性病变,故本研究无复发病例,除了与ESD整块切除率高有关外,可能也与本研究病例以良性病变为主及随访时间较短有关。因此有必要继续随访,进一步观察病变转化情况,并且需加大病例数。
虽然ESD整块切除率和治愈性切除率高,局部复发率低,但ESD仍有一定的局限性。与EMR相比,ESD操作耗时较长,且并发症如穿孔、出血等发生率较高。由于GEJ处于胸腹交界的特殊位置,若在ESD操作过程中出现穿孔,有可能会造成气腹或纵隔气肿,如果穿孔率高,这势必会限制ESD的应用与发展。吕瑛等[2]用ESD治疗28例GEJ早癌或癌前病变,其穿孔发生率为7.4%;周平红等[8]对143例起源于固有肌层的 GEJ肿瘤行ESD切除,穿孔发生率为4.2%(6/143),但这6例患者均为行EFTR(Endoscopic full-thickness resection)过程中发生穿孔,其余行传统ESD过程未发生穿孔。上述所有穿孔患者用钛夹缝合,经禁食、补液、抗生素保守治疗成功,无需外科手术治疗。Kingo Hirasawa等[9]报道用ESD治疗58例早期胃腺癌患者,术中未发生穿孔。本研究病例无一穿孔发生。以下方法可减少穿孔的发生。第一:采用自带射水系统的内镜,同时在内镜前端安装透明帽以便在操作过程中获得更好的视野;第二,黏膜下注射含糖和透明质酸的液体,使黏膜层抬举时间保持更长;第三,要求操作者要有丰富的ESD操作经验[1]。出血是ESD的另一个主要并发症,出血包括术中出血和术后延迟性出血。本研究部分患者在ESD操作过程中,创面出现小出血,均经氩离子凝固术和(或)电凝止血处理,出血可停止,无需输血治疗。ESD操作需要术者耐心、细心,术中一旦发生出血,及时采用氩离子凝固术、电凝止血、金属钛夹等进行止血治疗,及时处理暴露的小血管,一般均能成功止血。术后仔细处理创面对预防迟发性出血均有一定作用。本研究所有患者均无迟发性出血发生。狭窄也是ESD并发症之一,虽然ESD术后狭窄在食管、胃的贲门及幽门ESD术后多见,但是发生率较低,本研究中未发生食管下段及贲门狭窄。
ESD属于微创治疗,虽然文献报道其整块切除率达90%以上,但其仍存在一定的残留率和复发率。对于那些已证实为完全切除的病灶,由于胃十二指肠反流物等外界刺激性因素的长期刺激,同样存在恶性转变的潜在可能。因此,对于ESD切除的GEJ病灶,术后定期内镜随访具有重要意义。本组18例病例在术后1~3个月行内镜(胃镜或超声内镜)随访。根据术后病理结果的不同,制定不同的随访计划。对于术后病理提示良性病变的病例,如增生性息肉、炎症等,若术后第一次内镜随访提示术口愈合良好,则可不需继续内镜随访。对于术后病理提示癌前病变或早期的患者,则需在术后第1、3、6、12个月进行内镜随访并在原术口或术口附近取活检送病理检查,如均无癌变的趋势,此后每年行内镜随访。但是如果病理结果提示复发或有癌变趋势,则根据病变浸润的情况选择不同的治疗方案。本研究中3例平滑肌瘤和3例癌前病变患者经随访至今无1例复发、癌变或死亡。1例平滑肌肉瘤患者术后2个月复查胃镜,胃镜提示贲门术口愈合良好,术后在原术区多点取活检,活检病理提示慢性轻度炎症,无癌变或转移的依据。由于本研究随访时间较短,因此有必要继续随访观察病变情况。
ESD可以一次性完整切除病变,提供完整的病理信息,术后患者创伤小,保持消化道的完整结构,避免术后出现消化道瘘及胸腹腔感染的发生,患者术后恢复快,住院时间短,局部复发率及并发症低,且具有与外科手术相同的疗效。因此,ESD是治疗胃食管连接部病变可行、安全、有效的微创方法。
[1]Kakushima N,Yahagi N,Fujishiro M,et al.Efficacy and safety of endoscopic submucosal dissection for tumors of the esophagogastric junction[J].Endoscopy,2006,38(2):170-174.
[2]吕 瑛,张晓琦,邹晓平,等.内镜黏膜下剥离术和内镜黏膜切除术治疗胃食管连接部癌前病变及早癌的疗效比较[J].中华消化内镜杂,2012,29(5):243 -246.
[3]汤金海,高泉根,陈 易,等.胃黏膜切除术与黏膜剥离术治疗早期消化道癌和癌前病变的比较分析[J].现代消化及介入诊疗,2011,16(5):316 -319.
[4]M¨onig SP,Schr¨oder W,Beckurts KT,et al.Classification,diagnosis and surgical treatment of carcinomas of the gastroesophageal junction[J].Hepatogastroenterology,2001,48(41):1231-1237.
[5]Ichiro Oda1,Daizo Saito,Masahiro Tada,et al.A multicenter retrospective study of endoscopic resection for early gastric cancer[J].Gastric Cancer,2006,9(4):262 -270.
[6]Shiro Oka,Shinji Tanaka,Iwao Kaneko,et al.Advantage of endoscopic submucosal dissection compared with EMR for early gastric cancer[J].Gastrointestinal Endoscopy,2006,64(6):877-883.
[7]Yoshinaga S,Gotoda T,Kusano C,et al.Clinical impact of endoscopic submucosal dissection for superficial adenocarcinoma located at the esophagogastric junction[J].Gastrointestinal Endoscopy,2008,67(2):202 -209.
[8]Li QL,Yao LQ,Zhou PH,et al.Submucosal tumors of the esophagogastric junction originating from the muscularis propria layer a large study of endoscopic submucosal dissection[J].Gastrointestinal Endoscopy,2012,75(6):1153 -1158.
[9]Hirasawa K,Kokawa A,Oka H,et al.Superficial adenocarcinoma of the esophagogastric junction long-term results of endoscopic submucosal dissection[J].Gastrointestinal Endoscopy,2010,72(5):960 -966.

