β-蒎烯合成酶(QH6)在大肠杆菌中的表达及其产β-蒎烯的研究
冯红茹,杨建明,秦 利,咸 漠
(1.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866;2.中国科学院 青岛生物能源与过程研究所生物基材料重点实验室,山东 青岛 266101;3.青岛农业大学 生命科学学院,山东 青岛 266109)
β-蒎烯合成酶(QH6)在大肠杆菌中的表达及其产β-蒎烯的研究
冯红茹1,2,杨建明2,3,秦 利1,咸 漠2
(1.沈阳农业大学 生物科学技术学院,辽宁 沈阳 110866;2.中国科学院 青岛生物能源与过程研究所生物基材料重点实验室,山东 青岛 266101;3.青岛农业大学 生命科学学院,山东 青岛 266109)
蒎烯是一种重要的平台化合物,可以用来合成高密度燃料、精细化学品及材料。将来源于黄花蒿的β-蒎烯合成酶基因与外源杂合甲羟戊酸(MVA)途径一起整合到BL21(DE3)中共表达,通过气相色谱-质谱(GC- MS)和气相色谱(GC)对发酵产物进行了定性及定量检测。通过发酵条件优化,对影响发酵产β-蒎烯的因素(诱导温度、诱导剂浓度和N源)进行了考察。结果表明:来自黄花蒿的蒎烯合酶可以在宿主细胞内高效表达,且能高效催化β-蒎烯的合成。通过对重组菌进行发酵条件优化得到最佳培养条件:诱导温度为28℃,IPTG浓度为0.1 mmol/L,最佳有机N源为MD牛肉粉。在此条件下,检测出β-蒎烯产量达到22.89 mg/L,比优化前(4.60 mg/L)提高了3.98倍。
β-蒎烯合成酶;大肠杆菌;亲和层析;生物合成
蒎烯是一种重要的萜类化合物,在自然界中主要以2种形式存在:α-蒎烯和β-蒎烯。二者是一对同分异构体,β-蒎烯有一双键在环外,比α-蒎烯更易形成二聚体结构,β-蒎烯二聚体的燃料性能略优于α-蒎烯二聚体[1]。由于蒎烯二聚体的高能量密度和高燃烧净热值(能量密度0.938 g/cm3,燃烧净热值39.5 MJ/L),被广泛应用于高密度燃料的合成。除此之外,还广泛应用于药理活性物、农用及家用生物活性物、功能材料、香料、松油醇、芳香醇、乙酸松油酯、二氢松油醇和二氢月桂烯醇等的合成[2-3]。
目前,工业上获得蒎烯的主要来源是采用高效精馏塔从脂松节油或粗硫酸盐松节油中进行分离提取[4-5]。这种方法存在对设备要求高、操作困难、能耗大和效率低等缺点,同时造成大量自然资源的浪费。通过在工业微生物中构建合成代谢路径,以低成本的可再生生物质为原料生产各种化学品,包括萜类化学品,可以有效地解决化学品的原料瓶颈问题。
目前,只有Yang等[6]对生物法合成α-蒎烯进行了研究,α-蒎烯的产量最高达到了0.97 g/L。而Lu等[7]的研究检测了黄花蒿的蒎烯合成酶(QH6)的体外酶反应,在添加底物牻牛儿焦磷酸(GPP)的条件下产生了质量比例为94∶6的β-蒎烯和α-蒎烯混合物。但并未对其直接进行生物发酵获得目的产物进行研究。
本研究在前人研究的基础上,将黄花蒿的蒎烯合成酶基因与实验室构建的生物体外高效甲羟戊酸(MVA)途径共同整合到大肠杆菌中,通过生物发酵得到了β-蒎烯和α-蒎烯的混合物,并通过气相色谱-质谱(GC-MS)及GC对发酵产物进行了定性及定量研究,以实现以葡萄糖为底物,经大肠杆菌发酵获得目的产物β-蒎烯。以期为微生物法合成蒎烯的工业化研究奠定一定的基础。
1 材料与方法
1.1 材料
1.1.1 菌种及材料
E.coli BL 21(DE3),Invitrogen公司;pACYCDuet-1质粒,Novagen公司;含有β-蒎烯合成酶基因的质粒pGH-QH6,上海捷瑞生物科技有限公司。
1.1.2 工具酶和试剂
Pyrobest DNA聚合酶、dNTP、感受态细胞制备试剂盒,TaKaRa公司;Ni SephroseTM6×fast flow,GE Healthcare公司;限制性内切酶、T4 DNA连接酶,Fermentas公司;质粒提取试剂盒、胶回收试剂盒,Omega公司;异丙基硫代-β-D-半乳糖苷(IPTG),Biosharp公司;胰蛋白胨和酵母抽提物,Oxoid公司;α-蒎烯、β-蒎烯标准品,Sigma公司;牛肉粉,北京奥博星生物技术有限责任公司;大豆蛋白胨,国药集团化学试剂有限公司;蛋白胨,天津大茂化学试剂厂;牛肉膏,Solarbio公司;牛肉浸膏,北京双旋微生物培养基制品厂;牛肉浸粉,阿拉丁公司;牛肉粉,Molecular Devices公司。所有试剂如无特殊说明均为国产分析纯。
1.1.3 培养基
LB液体培养基(g/L):蛋白胨10、酵母提取物5、NaCl 10;LB液体培养基加入20 g/L的琼脂粉即为LB固体培养基。
发酵培养基:K2HPO4·3H2O 9.8 g、柠檬酸·H2O 2.1 g、檬酸铁铵0.3 g、MD牛肉粉9 g、葡萄糖2 g、1 mL 1 000×微量元素((NH4)6Mo7O24·4H2O 0.37 g、ZnSO4·7H2O 0.29 g、H3BO42.47 g、CuSO4·5H2O 0.25 g、MnCl2·4H2O 1.58 g用蒸馏水定容至100 mL过滤除菌)、1 mol/L MgSO42 mL。并根据情况添加100 μg/mL的氨苄青霉素或34 μg/mL的氯霉素。
1.2 仪器与设备
7890A-5975C型气相色谱-质谱连用仪,Agilent Technologies公司;SP6890型气相色谱仪,山东鲁南瑞宏有限公司;Mycycler PCR仪、PowerPac Basic核酸电泳仪、Gel Doc XR凝胶成像系统,Bio-Rad公司;Allegra X-22R型离心机,德国Beckman公司。
1.3 方法
1.3.1 外源基因的克隆
黄花蒿的β-蒎烯合成酶基因QH6(GenBank登录号AF276072.1)通过化学合成法合成,合成的基因片段被构建到了pGH克隆载体上。为了将QH6基因克隆到表达载体上,合成的pGH-QH6带有限制性内切酶位点BglⅡ和XhoⅠ。
设计合成如下PCR引物进行扩增,正向引物:ATCGGGATCCGAACCGTCGTTCTGCTAACTA,反向引物:CGATGAGCTCTTAGATCGGGTTAACGAACA,其中正向引物和反向引物分别引入BamHⅠ和SacⅠ酶切位点(下划线),引物由上海捷瑞生物工程有限公司合成。以大肠杆菌基因组为模板,PCR反应条件:94℃ 预变性3 min;94℃ 变性30 s,56℃退火30 s,72℃ 延伸2.5 min,循环30次;72℃ 延伸10 min。PCR反应产物经1%琼脂糖凝胶电泳检测。

表1 本研究中所用的菌株和质粒Table 1 Bacterial strains and plasmids used in this study
1.3.2 表达载体的构建
以pGH-QH6为模板,以上述引物扩增目的基因QH6,得到带有特定酶切位点的基因片段。PCR产物和pACYDuet-1质粒均采用BamH I和Sac I双酶切,将纯化后的DNA片段与线性化的pACYDuet-1载体连接,转化大肠杆菌BL21(DE3)感受态细胞。菌液PCR筛选阳性克隆,提取质粒,酶切鉴定并测序。鉴定正确的重组质粒命名为pFHR-1(表1)。该载体用于单独分析该基因的可溶性表达情况。
将pGH-QH6和pYJM27质粒均采用Bgl II和Xho I双酶切,对酶切产物QH6和pYJM27的大片段进行胶回收,将纯化后的2个线性片段进行连接,转化大肠杆菌BL21(DE3)感受态细胞。菌液PCR筛选阳性克隆,提取质粒,酶切鉴定并测序。鉴定正确的重组质粒命名为pFHR-2。由于pYJM27和pYJM14共同完成外源杂合甲羟戊酸(MVA)途径的构建,本文将pFHR-2和pYJM14两种质粒共同转化E.coli,从而构建以葡萄糖为底物,经MVA途径合成β-蒎烯的新方法。
1.3.3 重组菌的蛋白表达及纯化
将pFHR-1转化大肠杆菌BL21(DE3)获得工程菌株,命名为FHR-1。将FHR-1接种于含有氯霉素抗性的液体LB培养基,37℃振荡培养过夜。次日按1%接种量(体积分数)转接至100 mL新鲜的含有氯霉素抗性的液体LB培养基,振荡培养至对数生长期(OD600约为0.6),加入IPTG至终浓度为0.5 mmol/L,30℃诱导培养4 h后收集菌体。用5 mL磷酸缓冲液(PBS)(0.5 mol/L NaH2PO419 mL,0.5 mol/L Na2HPO481 mL、NaCl 2.93 g,pH 7.4)重悬菌体后,置于冰上超声破碎,4℃、12 000 r/min离心10 min取部分上清进行SDS-PAGE检测,剩余部分用Ni SephroseTM6×fast flow纯化系统纯化His-tag融合蛋白。
1.3.4 发酵产物定性检测
pYJM14和pFHR-2转化大肠杆菌BL21(DE3)获得工程菌株,命名为FHR-2。挑取单克隆到含有氯霉素和氨苄霉素的LB培养基中,37℃活化过夜。按1%接种量转接至500 mL厌氧瓶中(含100 mL发酵培养基),30℃ 下诱导培养,培养48 h后对产物进行检测。分别用气相色谱-质谱联用(GC-MS)及气相色谱(GC)方法对产物进行了定性和定量。
(1)GC-MS定性检测发酵产物。
GC-MS检测同样采用顶空气相色谱法测定。利用Ailgent气相色谱-四极杆质谱联用仪,色谱条件:色谱柱为HP-INNOWAX毛细管柱(30 m×0.25 mm×0.25 μm);升温程序为40℃保持5 min,以20℃/min升至75℃,保持1 min;以20℃ /min升至245℃,保持5 min。质谱条件:电子轰击(EI)离子源;电子能量70 eV;传输线温度275℃;离子源温度200℃;母离子m/z 285;激活电压1.5 V;全扫描模式;质量扫描范围m/z 10~600。样品通过与蒎烯标准品色谱图直接比对,进行定性分析。
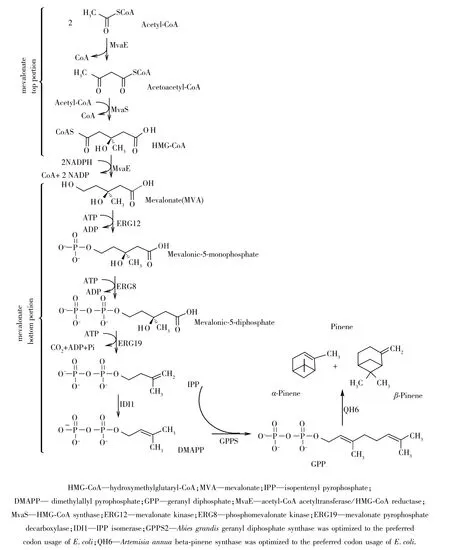
图1 重组菌FHR-2中引入的用于合成蒎烯的MVA代谢途径Fig.1 MVA pathway for pinene biosynthesis in strain FHR-2
(2)气相色谱(GC)定量检测发酵产物。
GC检测采用顶空气相色谱法测定[8]。收集1 mL密闭培养基顶部空间的气体样品,采用山东鲁南瑞虹SP-6890型气相色谱仪,色谱柱为HP--INNOWAX column(25 m×250 μm×0.2 μm),检测器为FID检测器;气化室温度200℃,柱室温度升温程序50℃ 保温0.5 min,4℃/min升至70℃,20℃/min升至250℃,检测器温度200℃,载气流速1 mL/min。用已知浓度的蒎烯绘制蒎烯标准曲线[6],通过将检测得到的峰面积引入标准曲线,对发酵产物进行定量。
1.3.5 发酵条件优化
为进一步提高目的产物的产量,本研究对发酵过程进行了单因素水平的筛选[9-10]。主要考察了4种因素(诱导温度、诱导剂浓度、N源组成和转速)对生物发酵产β-蒎烯的影响规律。
(1)诱导温度。
挑取单克隆于5 mL LB小瓶中培养活化过夜,按1%量接种于100 mL含有氯霉素和氨苄霉素的液体发酵培养基中,37℃振荡培养4 h,当OD600=0.6~0.9,加入终浓度为0.5 mmol/L IPTG分别于不同温度下(25、28、30、34和37℃)进行诱导培养,在不同时间点取1 mL顶空气体进行GC测定。
(2)诱导剂(IPTG)浓度。
挑取单克隆于5 mL LB小瓶中培养活化过夜,按1%量接种于100 mL含有氯霉素和氨苄霉素的液体发酵培养基中,37℃振荡培养4 h,当OD600= 0.6~0.9,加入不同浓度的IPTG(0.1、0.25、0.5和1 mmol/L)于28℃下进行诱导培养,在不同时间点取1 mL顶空气体进行GC测定。
(3)N源。
考察7种不同厂家来源的有机氮对生物催化合成β-蒎烯产量的影响规律。取单克隆于5 mL LB小瓶中培养活化过夜,按1%量接种于100 mL含有氯霉素和氨苄霉素及不同N源的液体发酵培养基中,37℃振荡培养4 h,当OD600=0.6~0.9,加入0.5 mmol/L IPTG于30℃下进行诱导培养,在不同时间点取1 mL顶空气体进行GC测定。
2 结果与分析
2.1 β-蒎烯合成酶表达质粒的构建
为验证外源基因是否在重组菌中正确且有效的表达,本研究将构建两个表达载体pFHR-1和pFHR-2。这2个质粒都利用载体pACYDuet-1本身的启动子进行高拷贝的表达。
对构建完成的含有质粒pFHR-1和pFHR-2的重组大肠杆菌进行菌液PCR扩增,产物经琼脂糖凝胶电泳鉴定,均获得了约800 bp的与预期大小相符的电泳条带(图2),纯化后的重组质粒分别经过BamH I/Sac I和Bgl II/Xho I双酶切后也得到大约为1.6 kb左右的片段,与预期相符。DNA测序分析显示插入的 QH6基因(GenBank登录号AF276072.1)和已报道的序列一致,二者的基因的同源性为100%,说明质粒构建成功。
2.2 QH6蛋白的表达与验证
构建成功的表达载体pFHR-1经转化到感受态细胞BL21(DE3)中,得到重组菌FHR-1。由于载体pFHR-1含有His-tag,可以对表达蛋白进行镍柱纯化,检测其是否以可溶的形式在重组细胞中得到表达。虽然Lu等[7]也研究了该蛋白在大肠杆菌BL21(DE3)中的蛋白表达情况,但基于本次研究使用了不同的表达载体,且该基因还要与体外构建的杂合MVA途径共同构建到宿主细胞中进行生物发酵,仍需要检测该蛋白是否在宿主细胞中得以正确表达。
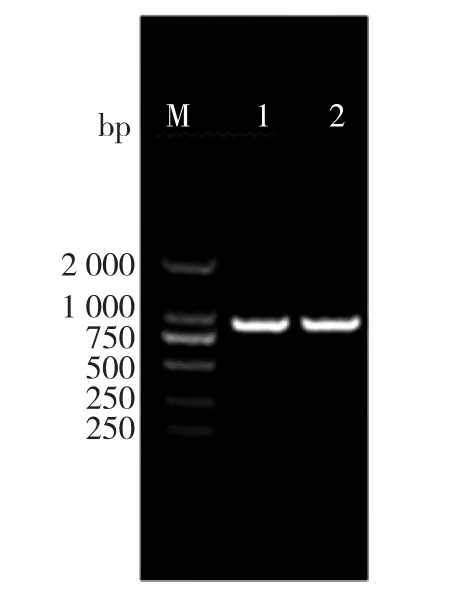
图2 PCR鉴定重组菌株中的β-蒎烯合成酶基因Fig.2 PCR identification of recombinant plasmid containing QH6
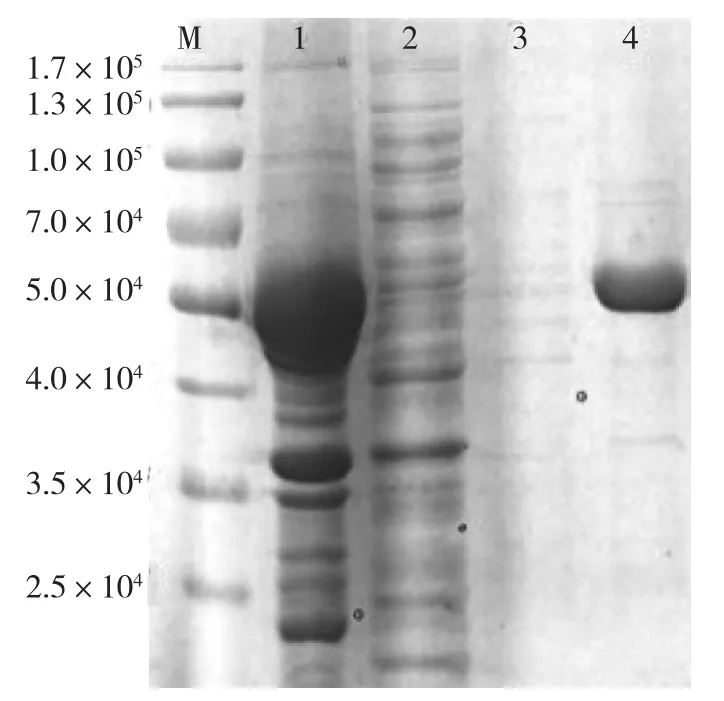
图3 β-蒎烯合成酶(QH6)的表达与纯化Fig.3 Expression and purification of β-pinene synthase gene in recombinant E.coli
重组菌FHR-1经IPTG诱导4 h,菌体超声破碎后,离心去除细胞碎片,上层裂解液进行SDSPAGE检测,结果如图3所示。由图3可知:蛋白经Ni柱纯化之后,SDS-PAGE检测结果在相对分子质量约为6.0×104处出现1条特异带,与预期的His-tag融合蛋白理论大小数值相符。说明β-蒎烯合成酶基因QH6在大肠杆菌BL21(DE3)中以可溶性的形式得到了正确表达。
2.3 发酵产物定性检测
2.3.1 GC-MS定性检测发酵产物
将构建好的质粒pFHR-2和YJM14共转到感受态细胞BL21(DE3)中,得到重组菌FHR-2。经LB培养基活化后,接种到发酵培养基中,当OD600= 0.4~0.6时,0.5 mmol/L IPTG诱导,30℃培养24 h后,抽取1mL顶空气体进行GC-MS检测。GC检测结果表明:混合气体中同时含有α-蒎烯和β-蒎烯。通过质谱分析进一步确定了产物是α-蒎烯和β-蒎烯的混合物。
2.3.2 GC定量检测发酵产物
将构建好的质粒pFHR-2和YJM14共转到感受态细胞BL21(DE3)中,得到重组菌FHR-2。经LB培养基活化后,接种到发酵培养基中,当OD600= 0.4~0.6时,0.5 mmol/L IPTG诱导,30℃培养24 h后,抽取1 mL顶空气体测定β-蒎烯的产量,结果如图4所示。由图4可知:β-蒎烯合成酶既可以催化产生β-蒎烯还可以催化产生一定量的α-蒎烯,产物α-蒎烯和β-蒎烯的质量浓度分别为0.32、4.60 mg/L;其质量比为6.5∶93.5,与Lu等[7]的研究结果6∶94存在略微差异。分析原因可能是发酵过程及细胞内环境的复杂性影响产物的合成,也有可能是检测过程中出现的误差所致。
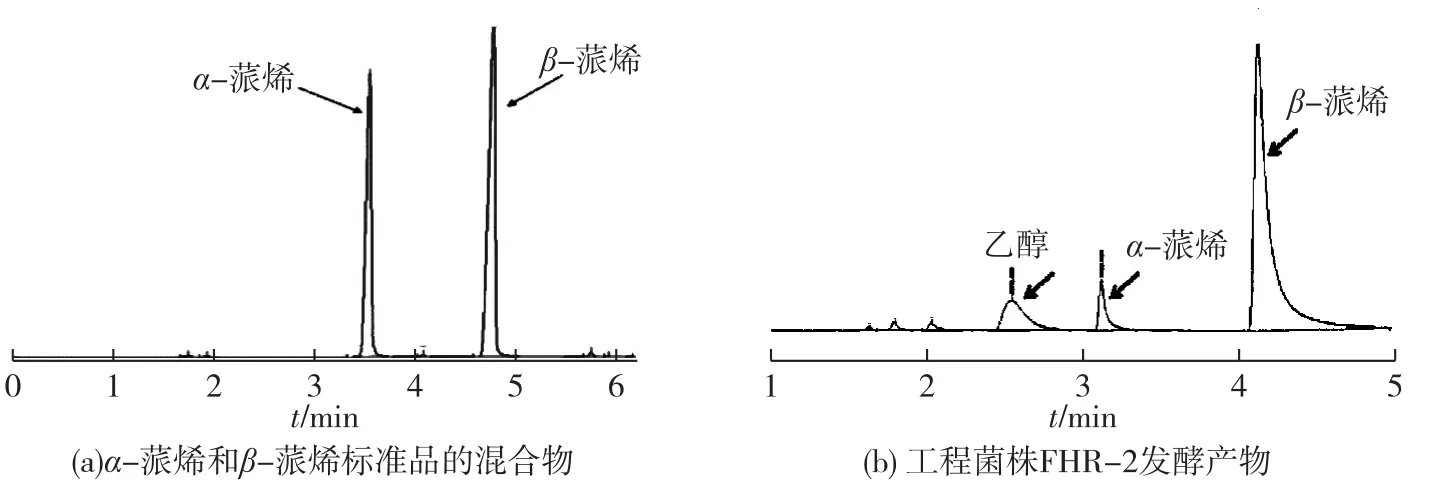
图4 样品GC检测结果Fig.4 GC analysis of samples
2.4 发酵条件优化
2.4.1 诱导温度对β-蒎烯产量的影响
低的诱导温度可以增加重组酶的可溶性表达,进而增加其在工程菌细胞体内的活性[11-12]。然而低的诱导温度势必会影响菌体的正常生长,从而影响目的产物的产量。因此,最佳诱导温度的控制是酶的表达、细胞生长和产物形成的最佳平衡[10]。为提高目的产物β-蒎烯的产量,考察不同的诱导温度(25、28、30、34和37℃)对产物的影响,结果见图5。
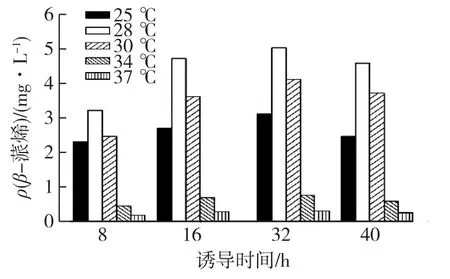
图5 诱导温度对工程菌FHR-2产β-蒎烯的影响Fig.5 Effects of induction temperature on β-pinene production by FHR-2
由图5可知:随着诱导时间的延长,不同诱导温度下的β-蒎烯产量都有一个逐渐上升后又有所下降的趋势。而随着诱导温度的升高,β-蒎烯的产量逐渐升高,在28℃时达到一个峰值,然后逐渐降低。这可能是由于摇瓶的气密性不好和中间取样造成胶塞漏气等原因造成。在28℃诱导温度下,β-蒎烯的产物质量浓度最高可达5.01 mg/L,是30℃ 时最高产量(4.12 mg/L)的1.22倍。由此可知发酵最适诱导温度为28℃。
2.4.2 诱导剂(IPTG)浓度对β-蒎烯产量的影响
外源基因的过量表达通常会增加工程菌的代谢负担,从而影响细胞的生长速率、细胞浓度、产物水平及质粒的稳定性[13-14]。通过调节诱导剂IPTG的浓度可以改善外源基因的表达对细胞代谢的影响。考察不同诱导剂IPTG浓度(0.05、0.1、0.25、0.5和1 mmol/L)对工程菌β-蒎烯产量的影响,结果见图6。由图6可知:随着诱导剂浓度的升高,β-蒎烯产量有一个先上升后下降的趋势。诱导剂浓度低于0.5 mmol/L时,β-蒎烯的产量随诱导时间的延长逐渐升高,最后又有所降低。在诱导剂浓度为1 mmol/L时,蒎烯产量极低而且没有明显升高的趋势,可能是因为:高浓度诱导剂对于载体中重组酶的过表达导致了代谢负担,使得代谢流不利于目标产物的合成;同时高表达量载体对蛋白表达有利,却不一定有利于终产物β-蒎烯的合成。在28℃诱导温度下,IPTG浓度为0.1 mmol/L时,β-蒎烯的产物质量浓度最高可达到18.933 mg/L。而0.05、0.25、0.5和1 mmol/L的最高产物质量浓度分别为13.953、5.78、4.12和1.184 mg/L。由此可知,IPTG最适诱导浓度为0.1 mmol/L。

图6 IPTG浓度对工程菌FHR-2产β-蒎烯的影响Fig.6 Effects of inducer concentration on β-pinene production by FHR-2
2.4.3 N源对β-蒎烯产量的影响
培养基的N源种类在提高微生物发酵目标产物的产率方面发挥重要的作用[15]。考察7种不同厂家来源的有机N源对生物催化合成β-蒎烯产量的影响,结果见图7。除培养基中N源不同外,其他组分与前文一致。由图7可知:在28℃诱导温度下,IPTG浓度为0.1 mmol/L时,来自于MD公司的牛肉粉效果最好,β-蒎烯产量为22.89 mg/L。该结果比 Bokinsky等[16]得到的蒎烯产量(1.7±0.6)mg/L提高了12.46倍。
根据以上发酵条件优化获得的数据,不难看出微生物发酵生产β-蒎烯的最适培养条件是:诱导温度为28℃,IPTG浓度为0.1 mmol/L,最佳有机N源为MD牛肉粉。

图7 不同N源对工程菌FHR-2产β-蒎烯的影响Fig.7 Effects of different organic nitrogen source on β-pinene production by FHR-2
3 结论
将β-蒎烯合成酶与外源杂合的甲羟戊酸(MVA)一起整合到大肠杆菌BL21(DE3)中,通过对重组菌进行发酵条件优化得到最佳培养条件:诱导温度为28℃,IPTG浓度为0.1 mmol/L,最佳有机N源为MD牛肉粉,在此条件下,检测出β-蒎烯产量达到22.89 mg/L,比优化前(4.60 mg/L)提高了3.98倍。从合成生物学的角度来分析本研究的实验现象和数据可知:对于构建多酶催化的复杂代谢途径而言,有必要通过发酵条件优化等手段来调整各种酶的表达量与活力,使得代谢流更有利于目标产物合成。此外,本研究利用代谢工程的手段改造大肠杆菌,成功地在大肠杆菌体内构建了一条β-蒎烯合成途径,为利用MVA途径生产生物基化学品的研究奠定了一定的基础。
[1]Meylemans H A,Quintana R L,Harvey B G.Efficient conversion of pure and mixed terpene feedstocks to high density fuels[J]. Fuel,2012,97:560-568.
[2]Harvey B G,Wright M E,Quintana R L.High-density renewable fuels based on the selective dimerization of pinenes[J].Energy Fuels,2009,24(1):267-273.
[3]Bokinsky G,Pamela P P,Anthe G.Synthesis of three advanced biofuels from ionic liquid-pretreated switchgrass using engineered Escherichia coli[J].Proc Natl Acad Sci USA,2011,108(50):19949-19954.
[4]Behr A,Johnen L.Myrcene as a natural base chemical in sustainable chemistry:a critical review[J].Chem Sus Chem,2009,2(12):1072-1095.
[5]栾国颜,阎丽萍,高维平.松节油中提取α-蒎烯与β-蒎烯的分离研究[J].吉林化工学院学报,1998,15(2):11-16.
[6]Yang J M,Nie Q J,Ren M,et al.Metabolic engineering of Escherichia coli for the biosynthesis of alpha-pinene[J].Biotech Biofuels,2013.doi:10.1186/1754-6834-6-60.[7]Lu S,Xu R,Jia J W,et al.Cloning and functional characterization of a β-pinene synthase from Artemisia annua that shows a circadian pattern of expression[J].Plant Physiol,2002,130(1):477-486.
[8]Kolb B.Headspace sampling with capillary columns[J].J Chromatogr A,1999,842(1):163-205.
[9]Jones K L,Kim S W,Keasling J.Low-copy plasmids can perform as well as or better than high-copy plasmids for metabolic engineering of bacteria[J].Metab Eng,2000,2(4):328-338.
[10]Harcum S W,Bentley W E.Heat-shock and stringent responses have overlapping protease activity in Escherichia coli[J].Appl Biochem Biotech,1999,80(1):23-37.
[11]Sanchez D G N,Salvador V.Effect of temperature on protein quality in bacterial inclusion bodies[J].FEBS Lett,2006,580(27):6471-6476.
[12]Hunke S,Betton J M.Temperature effect on inclusion body formation and stress response in the periplasm of Escherichia coli[J].Mol Microbiol,2003,50(5):1579-1589.
[13]Bentley W E,Mirjalili N,Aandersen D C,et al.Plasmid-encoded protein:the principal factor in the"metabolic burden"-associated with recombinant bacteria[J].Biotechnol Bioeng,1990,35(7):668-681.
[14]Glick B R.Metabolic load and heterologous gene expression[J]. Biotechnol Adv,1995,13(2):247-261.
[15]Torija M J,Beltran G,Novo M,et al.Effect of the nitrogen source on the fatty acid composition of Saccharomyces cerevisiae[J].Food Microbiol,2003,20(2):255-258.
[16]Bokinsky G,Peralta-Yahya P P,George A,et al.Synthesis of three advanced biofuels from ionic liquid-pretreated switchgrass using engineered Escherichia coli[J].Proc Natl Acad Sci USA,2011,108(50):19949-19954.
(责任编辑 荀志金)
Expression of β-pinene synthase(QH6)in Escherichia coli for the biosynthesis of β-pinene
FENG Hongru1,2,YANG Jianming2,3,QIN Li1,XIAN Mo2
(1.College of Bioscience and Biotechnology,Shenyang Agricultural University,Shenyang 110866,China;2.Key Laboratory of Bio-based Materials,Qingdao Institute of Bioenergy and Bioprocess Technology,Chinese Academy of Sciences,Qingdao 266101,China;3.College of Life and Sciences,Qingdao Agricultural University,Qingdao 266109,China)
Pinene is an important natural product that is widely used in high-density renewable fuels and fine chemicals.The Artemisia annua β-pinene synthase gene(QH6)was successfully assembled in Escherichia coli BL21(DE3)with the heterologous hybrid mevalonate(MVA)pathway.Pinene was quantitatively analyzed and characterized by gas chromatography(GC)and GC-mass spectrometry(MS). The influences of induction temperature,inducer concentration,and nitrogen on production of β-pinene were studied.After shake-flask fermentation,β-pinene productivity of the engineered strain was 4.60 mg/L.Under the optimum conditions of induction temperature 28℃,inducer(IPTG)concentration 0.1 mmol/L,and beef extract powder(MDbio Inc.),the β-pinene yield was up to 22.89 mg/L,3.98 times higher than that before optimization.
β-pinene synthase;E.coli;affinity chromatography;biosynthesis
Q851
A
1672-3678(2015)01-0028-07
10.3969/j.issn.1672-3678.2015.01.006
2013-09-11
国家自然科学基金(21376255);国家高技术研究发展计划(863计划)(SS2013AA050703-2);青岛科技发展计划(12-1-4-9-(3)-jch)
冯红茹(1989—),女,河北衡水人,硕士研究生,研究方向:生物化工;杨建明(联系人),教授,E-mail:yjming888@126.com

