甲状腺乳头状癌中PTEN 蛋白和肿瘤坏死因子的表达及意义
宋润波 马建亭 孟增智 贾庆雨 董耀 刘伟
甲状腺癌是最常见的内分泌恶性肿瘤,也是头颈部常见的恶性肿瘤之一。研究资料表明,甲状腺癌占头颈部恶性肿瘤的5.11%,占全身恶性肿瘤的0.22%~1.0%[1]。甲状腺癌也是近年来发病率增长较快的恶性肿瘤。据来自国际癌症学会资料的统计显示:甲状腺癌在世界各国的发病率逐年上升。在我国,通过流行病学的调查,甲状腺癌的发病率也逐年上升。不同于一般癌肿多发生于老年人,甲状腺癌较多发生于年轻女性,年龄35 ~50 岁,男女比为1∶2.6。甲状腺癌中最常见的是分化型甲状腺癌(differentiated thyroidcarcinoma,DTC),占所有甲状腺癌的95%。分化型甲状腺癌又分为乳头状甲状腺癌(papillary thyroid carcinoma,PTC)占DTC 的85%和滤泡状甲状腺癌(follictalar thyroid carcinoma,FTC),占DTC 的15%[1]。当前,甲状腺癌的发病机制不甚明了。PTEN 蛋白是1997 年发现的抑癌基因,研究显示PTEN 蛋白与恶性肿瘤的发生、发展及转移、浸润密切相关。肿瘤坏死因子-α(TNF-α)是单核巨噬细胞产生的细胞因子,对肿瘤具有调控作用[2]。本实验应用免疫组化的方法检测PTEN 蛋白和TNF-α 在甲状腺乳头状癌和甲状腺腺瘤中的表达,检测PTEN 蛋白和TNF-α 与甲状腺乳头状癌临床病理因素的关系。探索PTEN 蛋白和TNF-α在甲状腺癌的病因、检查、治疗、预后等方面的临床意义。
1 资料与方法
1.1 一般资料选取石家庄市第三医院2009 至2014 年甲状腺乳头状癌切除标本共60 例,患者进行手术前没有应用放疗和化疗,所切取标本均有病理诊断。其中男24 例,女36 例;年龄25 ~76 岁,平均年龄(40.5±8.4)岁。甲状腺腺瘤切除标本60 例,男28 例,女32 例;年龄22 ~78 岁,平均年龄(46.7±5.6)岁。2 组所切取标本患者的年龄、性别比,差异无统计学意义(P >0.05)。
1.2 试剂及方法免疫组化染色所用试剂为鼠抗人PTEN 蛋白免疫组化单克隆抗体(即用型)、鼠抗人TNF-α 免疫组化单克隆抗体(即用型)及SP 法试剂盒,购于上海华东生物工程有限公司。DAB 显色剂(氨基联苯胺试剂盒)、PBS(磷酸盐缓冲液)、柠檬酸缓冲液及其他免疫组化试剂均由石家庄市第三医院病理科提供。操作原理为抗原结合抗体,通过已知抗体检测抗原。按照SP 试剂盒说明书严格进行操作。阴性对照用PBS 代替一抗,阳性对照为试剂盒中阳性片。所有切片来自石家庄市第三医院病理科,使用同一批号试剂来完成免疫组化染色。
1.3 结果判定PTEN 蛋白和TNF-α 的免疫组化结果通过DAB 显色系统显色,阳性表现为深浅不一的黄色颗粒位于细胞质内。依照参考文献[3]免疫组化的结果通过半定量积分的方式进行判断,随机确定染色较为清楚的高倍视野6 ~7 个,每个视野计数200 个细胞,阳性细胞占同类计数细胞比例<5%记为0 分,6%~25%记为1 分,26%~50%记为2 分,51%~75%记为3 分,>75%记为4 分。染色强度以阳性细胞颜色为衡量标准:不染色=0 分,淡黄色=1 分,黄色=2 分,棕黄色=3 分。阳性细胞所占比例与染色强度的乘积作为细胞的表达水平:0 分=阴性(-),1 ~4分=弱阳性(+),5 ~8 分=中度阳性(++),9 ~12分=强阳性(+++)。(-)~(+)视为阴性表达,(++)~(+++)视为阳性表达。
1.4 统计学分析应用SPSS 16.0 统计软件,计数资料采用χ2检验,各组间比较应用pearson χ2检验和Fisher 确切概率检验。PTEN 蛋白和TNF-α 的实验数据的关系采用Spearson 秩相关分析,P <0.05 为差异有统计学意义。
2 结果
2.1 甲状腺乳头状癌和甲状腺腺瘤中PTEN 蛋白和TNF-α 的表达甲状腺乳头状癌组织中PTEN 蛋白阳性表达率显著低于在甲状腺腺瘤中的表达,差异有统计学意义(P <0.05)。甲状腺乳头状癌组织中TNFα 阳性表达率显著高于甲状腺腺瘤中的表达,差异有统计学意义(P <0.05)。见表1。

表1 甲状腺乳头状癌和甲状腺腺瘤中PTEN 蛋白和TNF-α 的表达n=60
2.2 PTEN 蛋白和TNF-α 的表达与甲状腺癌临床病理因素的关系不同性别、年龄、肿瘤大小的患者,癌组织中二者的阳性表达率差异无统计学意义(P >0.05)。而有无淋巴结转移、有无浆膜浸润、不同TNM临床分期的患者,癌组织中PTEN 蛋白和TNF-α 的阳性表达率比较,差异有统计学意义(P <0.05)。见表2。
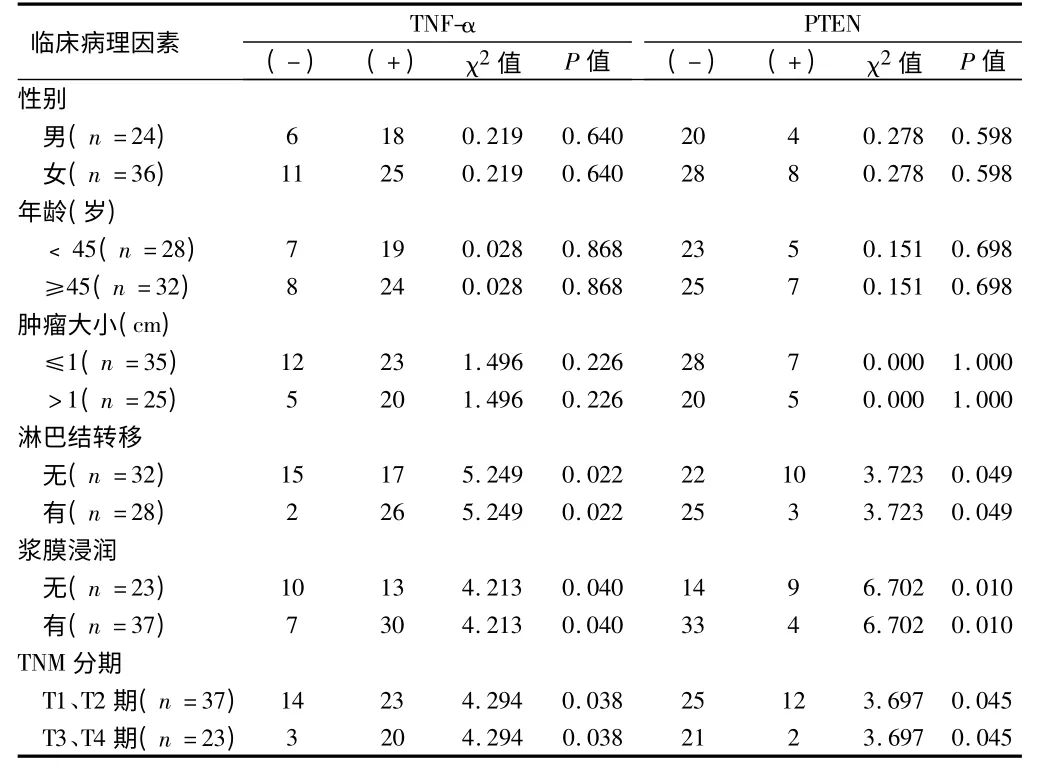
表2 PTEN 蛋白和TNF-α 的表达与甲状腺乳头状癌临床病理因素的关系 例
2.3 相关性检验60 例甲状腺乳头状癌中PTEN 蛋白和TNF-α 同时表达阳性的例数为6 例,同时表达阴性的例数18 例,PTEN 蛋白表达阳性而TNF-α 表达阴性者10 例,PTEN 蛋白表达阴性而TNF-α 表达阳性者15 例。通过Spearson 秩相关分析显示:两者在甲状腺乳头状癌中的表达呈负相关(r = -0.338,P <0.05)。
3 讨论
PTEN 蛋白定位于人染色体10q23.3 位点,全长约200 kb[4],是由Li 等[4]3 个研究小组在1997 年发现并克隆到的一种抑癌基因,具有较高的突变率和缺失率。通过对PTEN 蛋白开放读码框架序列分析表明:细胞骨架蛋白张力蛋白(tensin)与PTEN 蛋白有176 个氨基酸序列与同源,所以被命名PTEN 蛋白。PTEN 蛋白中由403 个氨基酸组成的一条多肽链构成氨基端的磷酸酶结构域,其末端区域具有双特异性磷酸酶功能,是到目前为止发现并确定的唯一具有蛋白酪氨酸磷酸酶和脂质磷酸酶活性的双特异性磷酸酶活性的抑癌基因。它不但具有抑癌基因的特性,还具有磷酸酶活性。而PTEN 蛋白的氨基端的磷酸酶结构域易发生突变而失活。现已证实:正是该结构域的突变、失活与多种肿瘤如头颈部肿瘤、卵巢癌、乳腺癌、胃癌、胶质细胞瘤及前列腺癌等的发生、发展密切相关。
PTEN 蛋白的生物学功能如下:(1)通过PTEN/PI3K/AKT 信号通路来实现。PI3K 受到特定细胞因子(如IGF,TNF)的刺激,在细胞膜上生成磷脂酰肌醇-3,4,5-磷酸[phosph atidylinositol(3,4,5)-trisphosphate,PIP3],作为细胞第二信使,PIP3 与丝、苏氨酸激酶(AKT)或蛋白激酶B(PKB)结合,使其被磷酸化而活化。活化的AKT 再进一步活化其下游因子,调节细胞分化、凋亡。在该信号通路中,PTEN 蛋白对PI3K/AKT 通路起着拮抗作用。PTEN 蛋白使PIP3 去磷酸化为PIP2,从而抑制PI3K 的磷酸化作用,使PI3K/AKT 通路活化受到抑制,阻断PKA 及其下游激酶的活性,使细胞周期阻滞在G1 期,干扰细胞生长,促进细胞凋亡。(2)PTEN/ERK/MARK 途径,PTEN 通过抑制ERK 的激活,阻断MARK 途径的磷酸化,抑制细胞的生长和分化[5,6]。(3)PTEN 下调血管内皮生长因子(VEGF-C)的表达并影响其分泌,从而抑制血管生长,进而抑制肿瘤细胞的迁移与侵袭[7]。(4)PTEN 蛋白可抑制一些肌动蛋白张力纤维的形成,从而抑制细胞生长、迁移及浸润。对肿瘤细胞的转移、浸润起到抑制作用。
本实验中,PTEN 蛋白在甲状腺瘤组织中阳性表达率与在甲状腺乳头状癌组织中阳性表达率比较有显著差异,提示甲状腺乳头状癌的发生可能与PTEN 的表达下调紧密相关。提示PTEN 蛋白表达下调和缺失可能在甲状腺肿瘤发生过程中起到重要作用。
我们分析甲状腺乳头状癌临床病理因素与PTEN蛋白的关系发现,PTEN 蛋白的阳性表达与甲状腺乳头状癌的淋巴结转移、浆膜浸润、TNM 分期相关。有淋巴结转移者的PTEN 蛋白表达的阳性率(10.1%)显著低于无淋巴结转移的PTEN 蛋白表达的阳性率(31.2%),差异有统计学意义(P <0.05)。伴浆膜浸润的PTEN 蛋白表达的阳性率(10.8%)显著低于不伴浆膜浸润的PTEN 蛋白表达的阳性率(39.1%),差异有统计学意义(P <0.05)。Ⅲ、Ⅳ期甲状腺乳头状癌组织PTEN 蛋白表达阳性率(8.6%)显著低于Ⅰ、Ⅱ期甲状腺乳头状癌组织 PTEN 蛋白表达阳性率(32.4%),差异有统计学意义(P <0.05)。提示PTEN 蛋白的表达下调及缺失可能与甲状腺乳头状癌的侵袭、转移紧密相关。由此推断PTEN 蛋白表达的下调及缺失可能既是甲状腺恶性肿瘤发生的原因之一,而且也与甲状腺乳头状癌的转移、浸润和预后紧密相关。
TNF-α 是单核巨噬细胞系统细胞产生的一种蛋白质,它既具有抗肿瘤作用,可导致炎症、细胞坏死,并能够抑制肿瘤新生血管的形成,影响肿瘤细胞膜的渗透性,从而引起细胞凋亡。TNF-α 也可与白介素、干扰素等一起对肿瘤细胞起到杀伤作用,使肿瘤生长受到抑制,使机体抗肿瘤能力得到提升[8]。适量存在的TNFα 对机体有保护作用。而过量分泌的TNF-α 则会对机体产生副作用。TNF-α 可刺激单核巨噬细胞分泌白介素、前列腺素等大量血管活性介质,这些血管活性介质既可以促进肿瘤细胞增殖,同时也明显降低机体的免疫功能。同时,TNF-α 诱导VEGFmRNA 的表达增加,促进VEGF 合成增加,VEGF 可促进肿瘤细胞的增殖并改变淋巴管的生理特性,为肿瘤经淋巴管转移创造条件。
本实验结果显示,甲状腺乳头状癌患者较甲状腺瘤患者具有较高水平TNF-α 表达,差异有统计学意义(P <0.05)。甲状腺乳头状癌临床病理因素与TNFα 的关系显示:有淋巴结转移者的TNF-α 表达的阳性率(92.8%)显著高于无淋巴结转移的TNF-α 表达的阳性率(53.2%),差异有统计学意义(P <0.05)。伴浆膜浸润的TNF-α 表达的阳性率(81.1%)显著高于不伴浆膜浸润的TNF-α 表达的阳性率(56.5%),差异有统计学意义(P <0.05)。Ⅲ、Ⅳ期甲状腺乳头状癌组织TNF-α 表达阳性率(86.9%)显著高于Ⅰ、Ⅱ期甲状腺乳头状癌组织TNF-α 表达阳性率(62.2%),差异有统计学意义(P <0.05)。结果表明:甲状腺肿瘤的发生,可激活体内单核巨噬细胞过分释放TNF-α,另一方面肿瘤细胞也可通过自分泌方式分泌TNF-α,并且TNF-α 随着肿瘤的负荷的不断增加,肿瘤的分期恶化而进一步升高,过度升高的TNF-α 不但促进肿瘤细胞的增殖、转移,同时也使机体的免疫功能受到损害[9],促进甲状腺癌的发生、发展。
通过本实验研究发现,在甲状腺乳头状癌组织中PTEN 蛋白与TNF-α 的表达呈负相关。分析甲状腺乳头状癌中,TNF-α 可能抑制PTEN 蛋白的活性。促进肿瘤的发生[10]。而肿瘤的发生,反过来又使TNF-α 生成增多。由此推测PTEN 和TNF-α 可能协同参与并促进甲状腺癌的发展。
综上所述,PTEN 蛋白和TNF-α 在甲状腺乳头状癌发生、发展及转移的过程中具有重要意义,二者之间的相关性还有待后续实验进一步研究。就目前而言,应用二者的联合检测,有利于甲状腺乳头状癌的早期发现、诊断及预后判断。
1 Dahia PL.A unique tumor suppressor gene.Endoerrola Cancer,2000,7:115-129.
2 Lo SZ,Steer JH,Joyce DA.TNF-α renders macrophages resistant to a range of cancer chemotherapeutic agents through NF-κ B mediated antagosis signoling.Cancer Lett,2011,307:80-92.
3 许良中,杨文涛.免疫组织化学反应结果的判断标准.中国癌症杂志,1996,6:229-311.
4 Li J,Yen C,Liaw D,et al.PTEN,a putative protein tyrosine phosphatase gene mu-rated in human brain,breast,and prostate cancer.Science,1997,275:1943.
5 王亚明,田增民.PTEN 肿瘤抑制基因和细胞间信号传导研究进展.海军总医院学报,2004,9:167-172.
6 Wen LP,Jessica LB,Charis E.PTEN blocks insulin-mediate EST-2 Phosphorylation through Map kinase,Independent of the phosphoinositide 3-kinas-e way.Hum Mol genet,2002,11:1687.
7 Tammela T,Zarkada G,Wallgard E,et al.Blocking VEGFR-3 suppresses angiogenic sprouting and vascular net-work formation.Nature,2008,454:656-660.
8 Wu GX,Wu ZS,He BL,et al.Epidemiological characteristics of stroke in 16 provinces of China.Natl Med J China,1994,74:281-325.
9 Lo SZ,Steer JH,Joyce DA.TNF-α renders macrophages resistant to a range of cancer chemo-therapeutic agents through NF-κB-madiated antogonism of apophosis sigaling.Cancer Lett,2011,307:80-92.
10 Pan L.Histone deacetylase inhibitor trichostatin a potentiatesdoxorubicin-induced apoptosis by up-regulating PTEN expression.Cancer,2007,109:1676-1688.

