硫化氢对大鼠局灶性脑缺血损伤的影响
孙立新 李国风 骆海坤 张勤增 解丽君 姜红 李立萍 郝娜 张建新
脑卒中是导致疾病和死亡的一个重要因素,现已成为继心血管疾病和癌症的第三大死亡原因。脑卒中分为缺血性脑卒中和出性脑卒中两种类型,其中大约80%以上的脑卒中由缺血引起。缺血性脑卒中的发病原因为脑部某动脉供血区的血流因栓塞或出血而暂时或永久地减少导致的脑组织缺血。目前,关于缺血性脑卒中的发病机制正在逐步深入研究[1]。硫化氢(hydrogen sulfide,H2S)是一种具有臭鸡蛋气味的有毒气体,然而近年来的研究发现,H2S广泛参与机体的多种病理和生理过程,被认为是继一氧化氮(nitric oxide,NO)和一氧化碳(carbon monoxide,CO)之后的第三种气体信号分子[2]。研究证实H2S参与了脑缺血性损伤的发生,并认为神经系统内产生H2S的主要酶是胱硫醚-β-合酶(cystathionine-β-synthase,CBS)和3-巯基丙酮酸转硫酶(3-mercaptopyruvat sulfur transferase,3MST),并进一步证实3MST是中枢神经系统生成H2S的重要酶[3-5],但对于局灶性脑缺血损伤和H2S/3MST的关系以及H2S对脑缺血损伤的影响报道较少,本研究拟采用复制局灶性脑缺血大鼠模型,观察H2S对局灶性脑缺血损伤的影响。
1 材料与方法
1.1 实验材料 NaHS,2,3,5-三苯基四氮唑兰(TTC),美国Sigma公司;考马斯亮兰试剂盒,南京建成生物工程研究所;α-酮戊二酸,上海试剂三厂;电动匀浆器Silentcrusher M,德国Eppendorf公司;分析天平梅特勒-AE240,瑞士梅特勒公司;全波长酶标仪,美国BIOTEK公司;722分光光度计,上海市第三分析仪器厂;恒温干燥箱,日本SANYO公司;SHA-C恒温水浴振荡器,常州市国华电器有限公司。
1.2 实验动物及分组 健康成年雄性Sprague-Dawley(SD)大鼠80只,体重250~280 g,由河北医科大学实验动物中心提供。大鼠随机分为5组,每组16只,分别为假手术组;缺血模型组;NaHS低剂量组(L-NaHS);NaHS中剂量组(M-NaHS);NaHS高剂量组(H-NaHS)。NaHS低、中、高剂量组分别于大鼠脑缺血3 h 时腹腔注射0.7、1.4 和2.8 mg/kg的 NaHS,假手术组和缺血模型组注射等容量的0.9%氯化钠溶液。各组大鼠均于缺血24 h断头取脑,TTC染色测定脑梗死体积,测定脑组织中H2S含量,改良法测定脑组织3MST的活性。
1.3 大鼠局灶性脑缺血模型制备 大鼠10%水合氯醛350 mg/kg腹腔注射麻醉,取仰卧位固定,消毒颈前区皮肤,取颈正中切口,分离左侧颈总动脉(CCA)、颈外动脉(ECA)、颈内动脉(ICA),用电热烧灼器将颈外动脉的分支烧断,结扎并游离颈外动脉主干一段,在颈外动脉游离段上剪开一小口,将预先制备好的尼龙线栓子插入,经颈总动脉分支处通过颈内动脉入颅,至大脑前动脉首端,尼龙线插入深度平均为(18.5±0.5)mm。以插入尼龙线栓子作为缺血记时的开始,动物苏醒后,出现霍纳(Horner)综合征:左侧眼裂变小并右侧偏瘫,以右上肢更为明显;提尾悬拉后出现右上肢蜷缩屈曲;下地不能直行,向右侧转圈跌倒,挑选手术成功、符合上述标准的大鼠进行实验。
1.4 检测指标及方法
1.4.1 脑梗死体积测定:按实验设计规定的时间处死动物,迅速取出大脑,置-20℃冰箱中冷冻30 min,从前向后切成1.5mm厚度的脑片,置0.5%TTC染液中,37℃孵育15 min。取出脑片后置10%的甲醛溶液中固定,在3d内取出照相,用PhotoshopCS2软件对图像进行处理并计算脑缺血体积。为减少大鼠个体差异、脑水肿和照相等因素对缺血体积检测的影响,对每只大鼠以梗死缺血体积/全脑体积(IV%)作统计计算。
1.4.2 脑组织中H2S含量的测定:采用去蛋白的方法测定[4],用不同浓度的NaHS绘制标准曲线。在不同时间点处死大鼠开颅取脑,分离出缺血侧脑组织,放入液氮保存备用。用0~4℃的50mmol/L磷酸钾缓冲液(pH值7.4)制备匀浆(质量体积比为12%),匀浆液离心(47000 ×g,10 min,4℃),取 75 μl上清液移至另一离心管中,在室温下加入0.25 ml的1%醋酸锌及0.45 ml蒸馏水孵育10 min,然后加入10%三氯乙酸0.25 ml再次离心(14000 ×g,10 min,4℃),收集清澈的上清液,加入133 μl的N,N-二甲基对苯二胺盐酸盐(20mmol/L)/HCl(7.2 mol/L)缓冲液及 133 μl的 FeCl3(30mmol/L)/HCl(1.2 mol/L)缓冲液,充分混匀。20 min后,用全自动酶标仪(Bio-TEK ELx800,美国)在波长670 nm测定吸光度,根据不同浓度NaHS绘制的标准曲线计算溶液中的H2S含量,以单位重量的脑组织中H2S的量(nmol/g)表示。
1.4.3 脑组织中3MST活性的测定:参照Qu、Kimura等的方法并改良[4,5]。反应在25 ml锥形瓶中进行,反应体积1 ml含50mmol/L磷酸钾缓冲液(pH值7.4)0.5 ml、10mmol/L 的 L-半胱氨酸 0.1 ml、5mmol/L 的α-酮戊二酸 0.1 ml和 12%(W/V)脑组织匀浆0.3 ml。在中央室中加入1%的0.5 ml醋酸锌,放入滤纸(0.5cm×1.5cm)增加吸收面积。用氮气将锥形瓶充盈30 s后瓶塞封口,转移到37℃水浴摇床中开始反应,90 min后向其中注入0.5 ml的50%三氯乙酸中止反应,继续水浴60 min后向中央室内加入50 μl的N,N-二甲基对苯二胺盐酸盐(20mmol/L)/HCl(7.2 mol/L)缓冲液及 50 μl FeCl3(30mmol/L)/HCl(1.2 mol/L)缓冲液,充分混匀。20 min后,用全自动酶标仪在波长670 nm测定吸光度,根据H2S标准曲线计算溶液中H2S浓度,组织中3MST活性以单位重量的脑组织在单位时间内生成 H2S的量(nmol·min-1·mg-1pro)表示。
1.5 统计学分析 应用SPSS 13.0统计软件,计量资料以表示,组间比较采用单因素方差分析(One-Way ANOVA),P <0.05为差异有统计学意义。
2 结果
2.1 H2S对大鼠脑梗死体积的影响 大鼠局灶性脑缺血经TTC染色后,脑梗死区呈白色,非梗死区呈红色。与假手术组比较,缺血模型组大鼠脑梗死体积明显增大(P<0.01),表明本实验局灶性脑缺血模型制备成功;与缺血模型组比较,NaHS中、高剂量组大鼠脑梗死体积明显减小(P<0.05),表明外源性给予H2S的供体NaHS可明显缩小大鼠的脑梗死体积。见表1、图 1。
2.2 H2S对大鼠脑组织中H2S/3MST的影响 3MST途径是脑组织生成H2S的重要途径。本实验研究结果显示,与假手术组比较,缺血模型组大鼠脑组织中H2S含量明显降低,同时3MST活性也明显降低(P<0.01),表明大鼠在发生局灶性脑缺血损伤后,随着脑缺血体积的增大,脑组织H2S生成减少,同时3MST活性降低,即由3MST途径生成的H2S明显减少;与缺血模型组比较,NaHS中、高剂量组大鼠脑组织中H2S含量和3MST活性明显升高(P <0.05或P <0.01),表明外源性给予H2S的供体NaHS可以通过提高3MST的活性从而提升脑组织H2S的含量。见表1。
表1 外源性H2S对大鼠脑缺血体积、脑组织H2S含量和脑组织3MST活性的影响 n=8,

表1 外源性H2S对大鼠脑缺血体积、脑组织H2S含量和脑组织3MST活性的影响 n=8,
注:与假手术组比较,*P <0.01;与缺血模型组比较,#P <0.05,△P <0.01
组别 剂量(mg/kg)脑缺血体积(%)H2S含量(nmol/g)3MST活性(nmol·min -1·mg-1pro)0 36.85 ±3.58 3.15 ±0.39缺血模型组 - 31.38 ±5.04*21.96 ±3.51* 0.98 ±0.21*H-NaHS 2.8 17.50 ±8.46△ 31.73 ±6.25△ 2.64 ±0.51△M-NaHS 1.4 22.75 ±3.88△ 27.15 ±5.97# 2.33 ±0.22△假手术组 -L-NaHS 0.7 30.29 ±1.40 22.67 ±4.94 0.95 ±0.25
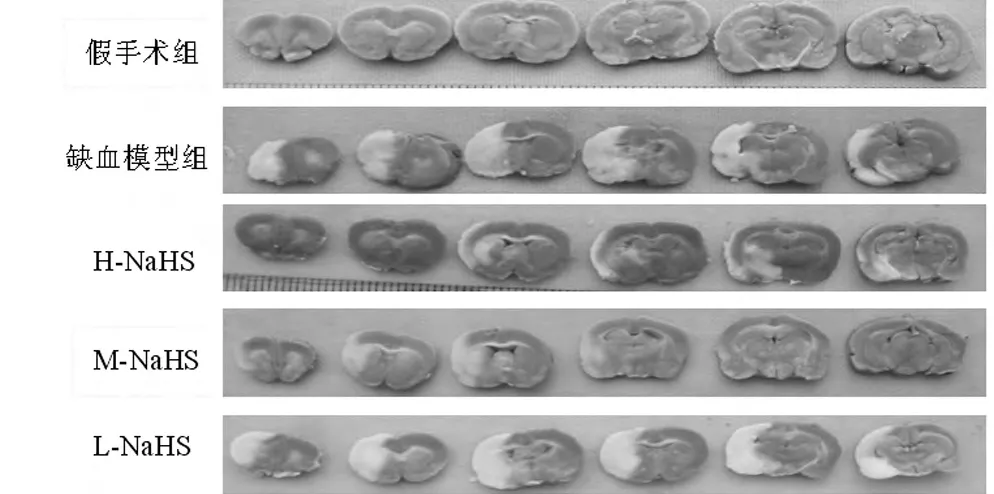
图1 5组脑缺血TTC染色图
3 讨论
线栓法建立大鼠MCAO模型是研究缺血性脑损伤的重要方法,其具有不用开颅,损伤小,易操作且模拟性强等特点,应用较广泛。本研究建立脑缺血模型时,对传统经典Longa线栓法[6]制备大鼠MCAO模型进行了改良,即在颈部正中部切口,分离出血管后不用血管夹而代之以缝合线牵引来阻断颈总动脉的血流,松开牵引即可恢复血流,避免了出现难以控制的出血情况,也不需结扎颈总动脉。结果显示脑组织切片染色现明显的梗死区,表明模型制备成功。
脑缺血的病理过程复杂,其发生过程涉及多重的时间和空间级联反应。其发病机制主要是由于血管硬化或血栓形成等原因引起脑动脉管腔狭窄或栓塞,造成脑局部血流量突然中断或持续减少,进而引起该动脉供血区脑组织血供不足,导致神经细胞的能量供应突然减少或丧失,继而引起血管内皮损伤和一系列的神经功能出现障碍。该状态持续较长时间则引起该脑部缺血区内的神经细胞死亡,即脑梗死。脑缺血发生后,随着时间的延长,可出现缺血区内的脑组织不可逆性坏死或细胞死亡。而据报道脑卒中患者发病后,若能在3~6 h内得到诊治,可得到恢复[7]。因此本研究选择在大鼠脑缺血后3 h给予NaHS,观察其对局灶性脑缺血损伤的影响。
本实验室前期研究结果显示,局灶性脑缺血发生时CBS活性升高,而给予CBS抑制剂氨基氧乙酸可减轻缺血性脑损伤,提示脑缺血后CBS途径生成的H2S可加重大鼠局灶性脑缺血损伤[8],与 Qu 等[9]报道一致。而任彩丽等报道外源性给予相对较低浓度NaHS(25 μmol/kg)可减轻全脑缺血再灌注损伤,其确切机制尚待阐明[10]。本研究参照任彩丽等实验方法设计高、中、低三种剂量给予NaHS,观察其对局灶性脑缺血损伤的影响。
80%以上的H2S在体内以NaHS形式存在,只有约20%的H2S以气体形式存在,NaHS可水解为Na+和 HS-,HS-可与体内的 H+再结合后生成 H2S,H2S和NaHS之间以水解和结合的形式形成一种动态平衡,这样不但可以保证H2S在体内的稳定,而且可以维持内环境的pH值。H2S在体内主要以单体或结合盐的形式经肾脏排出体外,其在体内的代谢途径主要有三条途径:(1)在线粒体中经氧化代谢;(2)在胞质中经甲基化作用代谢;(3)与血红蛋白、金属蛋白、氧化型谷胱甘肽、非硫蛋白等结合后被机体清除。H2S是继NO和CO之后的第三种气体信号分子,特别是在中枢神经系统,越来越多的证据表明H2S是一种新型的神经调节因子和信号传递分子。目前的研究认为机体催化H2S生成的酶主要为 CBS、胱硫醚-γ-裂解酶(cystathionine-γ-lyase,CSE)和 3MST。研究已经证实炔丙基甘氨酸(D,L-propargylglycine,PPG)是 CSE的不可逆性抑制剂,氨基氧乙酸(AOAA)为CBS的可逆性抑制剂,而关于3MST的研究尚处于起步阶段,其特异性的激动剂和抑制剂有待深入研究。CSE和CBS在体内的分布有明显的组织特异性,在大鼠体内,CBS主要分布于脑、肝脏、胰腺和肾脏;在小鼠体内,CBS主要分布于脑。在人体内主要分布于大脑和肺脏。CSE主要分布于各种血管组织,脑内未发现CSE的表达。早前的研究认为CBS是脑组织中内源性H2S的惟一来源,而最近Shibuya等[4]发现了脑内合成H2S的另一条重要途径:即以L-半胱氨酸和α-酮戊二酸为底物,在天门冬氨酸氨基转移酶的作用下首先生成3-巯基丙酮酸,再在3MST的作用下生成H2S和丙酮酸盐。他们还发现该途径生成的H2S占脑组织总H2S的90%,远超过CBS产生H2S的量。3MST主要分布于神经元、线粒体和血管内皮组织中,而CBS主要分布于星形胶质细胞中,两者不同的组织分布提示不同途径产生的H2S可能具有不同的作用。H2S作为一种神经调质,在中枢神经系统中发挥着重要的作用,参与了多种中枢神经系统疾病及缺血性脑损伤的发生发展过程[11-13]。3MST主要存在于神经元线粒体,而线粒体是产生活性氧族的场所,因而推测3MST途径生成的H2S可能通过抗氧化应激发挥神经元保护作用。然而H2S/3MST是否参与局灶性脑缺血损伤的研究未见报道。本研究结果显示大鼠局灶性脑缺血损伤发生后脑缺血体积增大,脑组织H2S含量和3MST活性明显降低,表明H2S/3MST参与了局灶性脑缺血的发生发展过程;给予NaHS治疗后,大鼠脑缺血体积明显减小,脑组织中H2S含量和3MST活性明显升高,脑缺血损伤得到明显改善,提示外源性补充H2S可明显减轻局灶性脑缺血性损伤。其详细机制有待深入研究。
1 唐康,张均田.脑缺血损伤机制和治疗策略研究进展.中国新药杂志,2000,9:809-813.
2 耿彬,杜军保,唐朝枢.内源性H2S:一种新的气体信号分子.生理科学进展,2002,33:256-258.
3 Eto K,Kimura H.The production of hydrogen sulfide is regulatedby testosterone and S-adenosyl-L-methionine in mouse brain.J Neurochem,2002,83:80-86.
4 Shibuya N,Tanaka M,Yoshida M,et al.3-Mercaptopyruvate sulfur transferase produces hydrogen sulfide and bound sulfane sulfur in the brain.Antioxid Redox Signal,2009,11:703-714.
5 Shibuya N,Mikami Y,Kimura Y,et al.Vascular endothelium expresses3-mercaptopyruvate sulfurtransferase and produceshydrogen sulfide.Biochem,2009,146:623-626.
6 Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebralarteryocclusion without craniectomy in rats.Stroke,1989,20:84-91.
7 张苏明,魏岗之.急性缺血性脑卒中的超早期抢救治疗.中华神经科杂志,1996,26:323-326.
8 李国风,张建新,骆海坤,等.氨基氧乙酸对大鼠局灶性脑缺血损伤的影响.中华麻醉学杂志,2011,31:984-986.
9 Qu K,Chen CPLH,Halliwell B,et al.Hydrogen sulfide is amediator of cerebral ischemic damage.Stroke,2006,37:889-893.
10 Caili Ren,Ailin Du,Dongliang Li,et al.Dynamic change of hydrogen sulfide during global cerebral ischemia-reperfusion and its effect in rats.Brain.Res,2010,1345:197-205.
11 Abe K,Kimura H.The possible role of hydrogen sulphide as an endogenous neuromodulator.Neurosci,1996,16:1066-1071.
12 Kimura H.Hydrogen sulfide:from brain to gut.Antioxid.Redox Signal,2010,12:1111-1123.
13 Chen SD,Yang DI,Lin TK,et al.Roles of oxidative stress,apoptosis,PGC-1α and mitochondrial biogenesis in cerebral ischemia.Int J Mol Sci,2011,12:7199-7215.

