高效液相色谱法测定清淋片中苦参碱含量
贾永亮,李晓燕,李成,卢燕
(1.河北省盐山县人民医院药剂科,河北沧州061300;2.河北以岭医药研究院,河北石家庄050035)
高效液相色谱法测定清淋片中苦参碱含量
贾永亮1,李晓燕2,李成2,卢燕2
(1.河北省盐山县人民医院药剂科,河北沧州061300;2.河北以岭医药研究院,河北石家庄050035)
目的建立测定清淋片中苦参碱含量的高效液相色谱(HPLC)法。方法色谱柱为NH2氨基柱(250 mm×4.6 mm,5 μm),流动相为乙腈-无水乙醇-2%磷酸溶液(84∶7∶9),流速1 mL/min,检测波长为210 nm。结果苦参碱进样量在86.697 6~1 812.000 0 ng范围内与峰面积呈良好线性关系(r=0.999 99),平均加样回收率为99.74%,RSD为1.57%(n=9)。结论该法简便、准确、重复性好,可用于清淋片中苦参碱的含量测定。
清淋片;苦参碱;高效液相色谱法
清淋片由柴胡、黄芩、大黄、苦参等7味中药材组方,具有疏解肝经气滞、清化下焦湿热的功效,临床主要用于治疗急性下尿路感染,疗效显著。苦参为臣药,其主要活性成分为生物碱和黄酮类[1],其中苦参碱具有很好的抗炎作用[2-3]。为全面控制清淋片的质量,对苦参中苦参碱进行了定量研究,现报道如下。
1 仪器与试药
Agilent 1100型高效液相色谱仪,VWD紫外检测器;KQ-250B型超声波清洗器;AT201型Mettler-Toledo电子天平。苦参碱对照品(中国食品药品检定研究院,批号为110805-200306);清淋片(石家庄以岭药业股份有限公司,批号为130101,130102,130103);乙腈、无水乙醇为色谱纯,其余均为分析纯,水为超纯水。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Waters Spherisorb NH2柱(250 mm×4.6 mm,5 μm);流动相:乙腈-无水乙醇-2%磷酸溶液(84∶7∶9);流速:1 mL/min;检测波长:210 nm。理论板数按苦参碱峰计应不低于2 000。
2.2 溶液制备
取苦参碱对照品适量,精密称定,加甲醇制成每1 mL含苦参碱0.3 mg的溶液,用盐酸-甲醇(1∶25)溶液稀释成每1 mL含苦参碱30 μg的溶液,作为对照品溶液。取样品研细,取0.5 g,精密称定,置具塞锥形瓶中,精密加80%甲醇25 mL,密塞,称定质量,超声处理(功率250 W,频率40 kHz)20 min,放冷,密塞,再称定质量,用80%甲醇补足减失的质量,摇匀,滤过,精密量取续滤液3mL,加在中性氧化铝柱(120~150目,4 g,内径1 cm)上,用甲醇洗脱至10 mL的容量瓶中,摇匀,滤过,取续滤液,即得供试品溶液。另取方中除苦参的其他药材,按制备工艺制得阴性样品,按供试品溶液的处理方法,得阴性对照品溶液。
2.3 方法学考察
专属性试验:精密吸取2.2项下3种溶液各10μL,注入高效液相色谱仪,依法测定。可见,对照品溶液与供试品溶液色谱峰保留时间一致,阴性样品无干扰,见图1。
线性关系考察:分别精密吸取质量浓度为8.697 6,17.395 2,28.992 0,90.600 0,144.960 0,181.200 0 μg/mL的苦参碱对照品溶液各10 μL,分别注入高效液相色谱仪,按拟订色谱条件测定,以峰面积积分值(Y)为纵坐标、苦参碱进样量(X)为横坐标绘制标准曲线,得回归方程Y=1.493 5 X+1.196 6,r=0.999 99(n=6)。结果表明,苦参碱进样量在86.697 6~1 812.000 0 ng范围内与峰面积积分值呈良好线性关系。
精密度试验:精密吸取同一对照品溶液各10 μL,在拟订色谱条件下连续进样5次,测定峰面积。结果的RSD为0.90%(n=5),表明仪器精密度良好。
稳定性试验:精密吸取同一供试品溶液各10 μL,分别于0,2,5,8,10,13,24 h进样测定峰面积。结果的RSD为1.71%(n=7),表明供试品溶液在24 h内稳定。
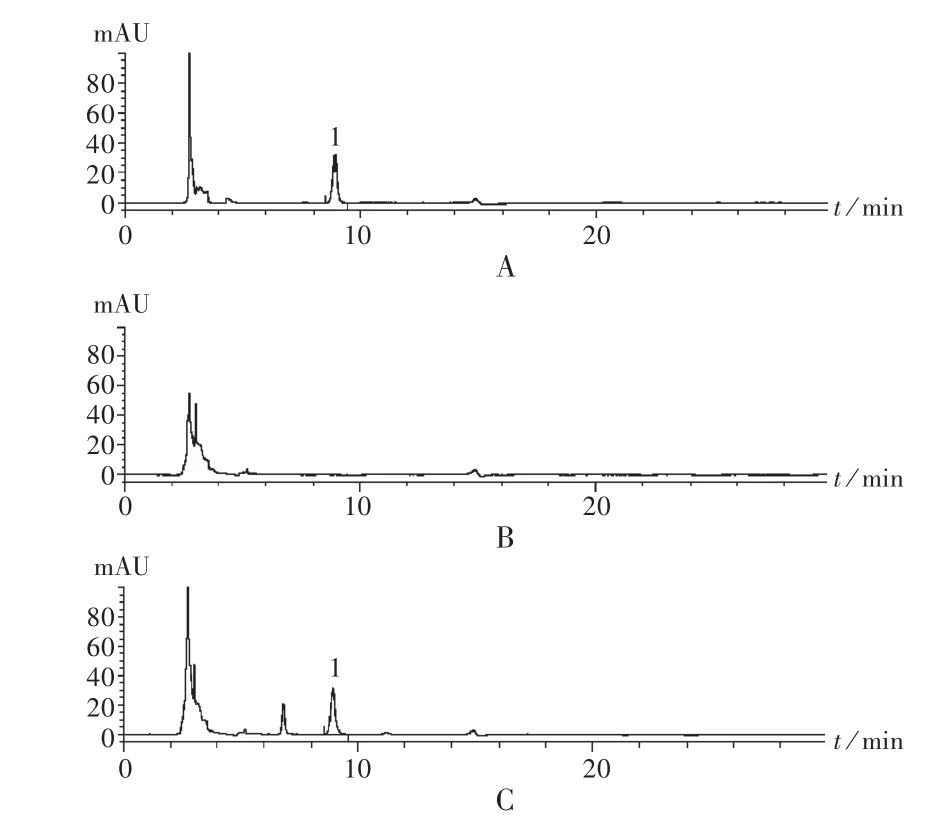
图2 高效液相色谱色谱图
重复性试验:取同一批样品9份,分别取高(0.6 g)、中(0.5 g)、低(0.4 g)3个剂量,依法测定。结果的RSD为1.02%(n=9),表明方法重复性良好。
加样回收试验:取同一批已知含量的样品9份,分为3组,分别精密加入25 mL高、中、低3种不同质量浓度的苦参碱对照品80%甲醇溶液,超声提取,依法测定结果,计算回收率。见表1。

表1 苦参碱加样回收试验结果(n=9)
耐用性试验:取同一份样品,分别在不同的测定波长、柱温及色谱柱的条件下检测苦参碱的含量,结果在210,208,212 nm波长下检测,苦参碱的RSD为0.88%;20,25,30℃的柱温下检测,苦参碱的RSD为0.36%。所考察的两种色谱柱对样品的分离无影响,因此测定条件的微小变动对检测结果无影响。
2.4 样品含量测定
用所制订的含量测定方法,对3批清淋片进行了苦参碱的含量测定。结果批号为130101,130102,130103的3批样品中苦参碱的含量分别为每片1.967,1.985,1.972 mg。
3 讨论
本研究中曾采用2010年版《中国药典(一部)》苦参项下苦参碱含量测定的流动相[4],但苦参碱的保留时间较短,不利于样品分析,特别是对处方药味较多的制剂色谱峰分离较差。经反复调整流动相比例,确定流动相为乙腈-无水乙醇-2%磷酸溶液(84∶7∶9),色谱峰分离良好。
对苦参碱对照品溶液进行光谱扫描,结果苦参碱在200 nm处有最大吸收,其他成分无干扰,因此选择210 nm为检测波长。
曾选择70%,80%,90%及甲醇进行提取,结果以甲醇作为提取溶剂时苦参碱的含量较低,而含水甲醇提取时苦参碱的含量较高,且不同含水甲醇苦参碱的含量相差不大。当选择80%甲醇,杂质峰较多,不利于苦参碱的测定,以甲醇作洗脱剂色谱峰分离良好,且10 mL即可洗脱完全。考虑到氧化铝的质量会影响含量测定,因此选择不同厂家及不同批号氧化铝进行试验,结果显示,市场上常用的氧化铝均可用于苦参碱的含量测定。
文献[5-8]均采用氯仿萃取或上氧化铝柱、氯仿洗脱,亦有采用缓冲盐作流动相、氯仿提取的处理方法[9-10]。本研究中供试品溶液制备方法采用常规的含水甲醇作提取溶剂及用甲醇作洗脱剂,与采用三氯甲烷相比,降低了有毒试剂的危害,利于环保,且方法简便,重复性好,易操作。
[1]苗抗立,张建中,董颖,等.苦参的化学成分及药理研究进展[J].天然产物研究与开发,2001,13(2):69-73.
[2]焦霞,沈其昀.苦参生物碱的临床及药理研究进展[J].中药新药与临床药理,2002,13(3):192-194.
[3]戴五好,钱利武,杨士友,等.苦参、山豆根生物碱及其总碱的抑菌活性研究[J].中国实验方剂学杂志,2012,18(3):177-180.
[4]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:188-189.
[5]周世玉,周晓英,唐婧坤.高效液相色谱法测定苦参片中苦参碱的含量[J].中国药业,2011,20(7):27-28.
[6]叶秀金,宋粉云.HPLC法测定清肺抑火丸中苦参碱和氧化苦参碱的含量[J].中国药房,2011,22(12):1 127-1 129.
[7]任永红,冯绍华.HPLC法测定康妇灵片中苦参碱和氧化苦参碱的含量[J].安徽医药,2009,13(2):154-155.
[8]闵庆璐,王巍,鞠成国,等.HPLC法测定丹黄祛瘀片中苦参碱和氧化苦参碱的含量[J].中国实验方剂学杂志,2012,18(1):60-62.
[9]杨芳.高效液相色谱法测定泻停封胶囊中苦参碱含量[J].中国药业,2011,20(24):52-53.
[10]覃振明,孔晓龙,莫凤珍,等.软坚护肝片中苦参碱和氧化苦参碱的含量测定[J].广西医学,2011,33(7):882-884.
Determination of Matrine in Qinglin Tablets by HPLC
Jia Yongliang1,Li Xiaoyan2,Li Cheng2,Lu yan2
(1.Hebei province Yanshan County People′s Hospital Department of Pharmacy,Cangzhou,Hebei,China061300;2.Hebei Yiling Medicine Institute,Shijiazhuang,Hebei,China050035)
ObjectiveTo establish a method for content determination of matrine in Qinglin Tablets.MethodThe NH2column(250 mm× 4.6 mm,5 μm)was used.Mobile phase:acetonitrile-ethanol absolute-2%phosphoric acid solution(84∶7∶9).Flow rate:1 mL/min.The detection wavelength:210 nm.ResultsThe calibration curve of matrine showed a good linearity within the range of 86.697 6-1 812.000 0 ng(r=0.999 99).The average recovery was 99.74%and RSD was 1.57%(n=9).ConclusionThe method is convenient,accurate and reproducible to operate and suitable for the quality control of Qinglin tablets.
Qinglin Tablets;matrine;HPLC
R284.1;R286.0
A
1006-4931(2015)20-0073-02
贾永亮(1975-),男,主管药师,研究方向为医院制剂质量检测,(电子信箱)872416195@qq.com;李晓燕(1974-),女,满族,高级工程师,主要从事中药新药开发及质量标准研究,本文通讯作者,(电话)0311-85901590(电子信箱)sjzyllxy@163.com。
2014-10-27;
2015-04-02)

