胡黄连苷Ⅱ治疗大鼠脑缺血损伤的剂量和时间窗研究
于春华,宋梦,曲宪成,王丽丽,王远
(1.山东省青岛市中心医院,山东青岛266000;2.山东省青岛市第九人民医院药剂科,山东青岛266000)
胡黄连苷Ⅱ治疗大鼠脑缺血损伤的剂量和时间窗研究
于春华1,宋梦1,曲宪成1,王丽丽1,王远2
(1.山东省青岛市中心医院,山东青岛266000;2.山东省青岛市第九人民医院药剂科,山东青岛266000)
目的研究胡黄连苷Ⅱ治疗大鼠脑缺血损伤的最佳剂量和时间窗。方法通过双侧颈总动脉结扎法(BCCAO)建立大鼠前脑缺血模型,采用正交试验设计分组,经由腹腔注射胡黄连苷Ⅱ干预治疗,应用黄嘌呤氧化酶法、化学比色法和光化学法分别检测血清超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)的活性。结果根据血清SOD,GSHPx和CAT活性分析,应用胡黄连苷Ⅱ治疗脑缺血损伤的最佳效果为脑缺血1.5 h腹腔注射20 mg/kg,1.5 h/10(mg·kg)和1.5 h/20(mg·kg)。结论胡黄连苷Ⅱ治疗脑缺血损伤的最佳治疗时间窗和剂量为脑缺血1.5~2.0 h和腹腔注射10~20 mg/kg。
胡黄连苷Ⅱ;脑缺血;剂量;时间窗;超氧化物歧化酶;谷胱甘肽过氧化物酶;过氧化氢酶;大鼠
脑缺血损伤会导致一系列病理过程,如能量代谢障碍、离子平衡失调、自由基过度生成等。生理状态下,体内不断生成的自由基由抗氧化系统清除,维持动态平衡[1]。超氧化物歧化酶(SOD)与超氧阴离子反应生成过氧化氢(H2O2),再由谷胱甘肽过氧化酶(GSH-Px)和过氧化氢酶(CAT)将H2O2分解为分子氧和水,消除氧自由基的毒性作用[2]。故SOD活性可反映机体清除氧自由基(OFR)的能力。细胞培养证实,胡黄连苷Ⅱ可通过减轻H2O2诱导的PC12细胞损伤而提高细胞存活率[3-5]。动物试验表明,胡黄连苷Ⅱ能通过调节诱导型一氧化氮合酶(iNOS)、SOD和天冬氨酸特异性半胱氨酸蛋白酶-9(Caspase-9)的表达,抑制脑缺血-再灌注损伤引起的细胞凋亡[6-7]。李红云等[8]的研究显示,大鼠脑缺血损伤后1.5 h,经腹腔注射胡黄连苷Ⅱ20 mg/kg可获得较好疗效。本研究中通过定量检测血清抗氧化酶活性变化,以确定胡黄连苷Ⅱ治疗脑缺血损伤最佳治疗剂量和时间窗,现报道如下。
1 材料与方法
1.1 动物与试药
成年健康雄性SPF级Wistar大鼠35只,体重230~250 g,青岛市药物检验所实验动物中心提供,合格证号SCXK(鲁)20120010。胡黄连苷Ⅱ(纯度不低于98%,相对分子质量为512.46,上海纯优生物科技有限公司,批号为39012-20-9);细胞裂解液(碧云天生物技术研究所,批号为P0013);SOD测试盒(批号为A001),GSH-Px测试盒(批号为A005),CAT测试盒(批号为A007),均为上海沪峰生物科技有限公司产品。
1.2 方法
动物模型制备:动物置实验室适应环境1周,自由进食、饮水;室温(23±2)℃,自然光照。随机抽取5只作为假手术组,其余30只分离并结扎双侧颈总动脉建立前脑缺血模型[9]。术前动物禁食12 h,经10%水合氯醛腹腔注射麻醉(0.3 mL/kg),仰卧固定、无菌操作,假手术组不结扎颈总动脉,其余操作同试验组。术后2 h仍未苏醒或死亡的9只动物剔除,将成功的21只动物模型再随机分为模型组5只和治疗组16只。
干预措施:将治疗组16只动物按照L16(45)正交试验设计分组,详见表1。治疗时间窗为因素A,设缺血1.0,1.5,2.0,2.5 h 4个水平,分别为因素A1,A2,A3,A4;治疗剂量为因素B,设5,10,20,40 mg/kg体重4个水平,分别为因素B1,B2,B3,B4。将胡黄连苷Ⅱ应用0.9%氯化钠注射液溶解稀释成1%溶液,按照L16(45)正交表设计,在相应的缺血时间,腹腔注射相应剂量胡黄连苷Ⅱ。假手术组和模型组术后2.0 h腹腔注射等量0.9%氯化钠注射液。
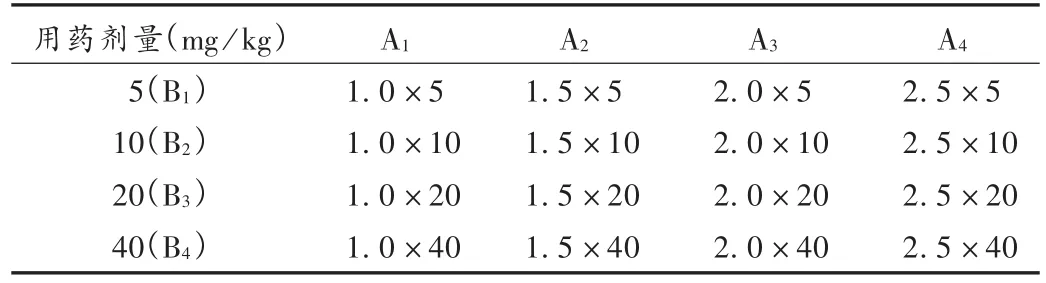
表1 L16(45)正交试验设计表
标本采集:大鼠给药24 h后,以10%水合氯醛0.3 mL/kg腹腔注射麻醉,开胸经心脏取血4 mL,以4 000 r/min的速率离心10 min,分离血清,-20℃保存。
指标检测:应用黄嘌呤氧化酶法、化学比色法和光化学法分别测定血清匀浆超SOD,GSH-Px和CAT的活性。取血清匀浆室温解冻,离心取上清液100 μL,按试剂盒说明书操作,蒸馏水调零,紫外分光光度计(BeckmannDU640,USA)在波长550 nm(SOD),412 nm(GSH-Px)和405 nm(CAT)处测定各管的吸光度值,计算血清匀浆中SOD,GSH-Px和CAT的活性。
1.3 统计学处理
采用SPSS 17.0统计软件分析。通过方差分析和t检验,根据不同水平的缺血(给药)时间和剂量,及给药时间和剂量的交互作用对检测指标是否有显著性影响,得出最佳的剂量和时间窗。P<0.05为差异有统计学意义。
2 结果
2.1 指标检测结果
造模后,动物血清中SOD,GSH-Px和CAT的活性较假手术组均显著降低(t=12.31~43.85,P<0.01);治疗后,动物血清SOD,GSH-Px和CAT的活性较模型组均明显升高(t=3.87~12.75,P<0.01),详见表2。治疗组动物血清SOD,GSH-Px和CAT的活性检测结果见表3。
表2 3组动物SOD,GSH-Px和CAT检测结果(±s,U/mL)

表2 3组动物SOD,GSH-Px和CAT检测结果(±s,U/mL)
注:与假手术组比较,*P<0.01;与模型组比较,#P<0.01。
组别假手术组(n=5)模型组(n=5)治疗组(n=16)SOD 92.50±6.44 62.42±4.72*82.22±7.69#GSH-Px 328.14±9.84 267.13±8.31*305.80±25.04#CAT 11.51±1.57 7.81±0.99*9.22±2.64#

表3 L16(45)正交试验设计与结果(U/mL)
2.2 方差分析
SOD活性:因素A和因素B的不同水平对脑缺血后血清SOD活性的影响比较,差异有统计学意义(P<0.01),而时间-剂量交互作用显示因素C对其无显著性影响(P>0.05),详见表4。说明不同水平的缺血时间即治疗时间窗和给药剂量对脑缺血后血清SOD活性均有显著性影响,而给药时间与给药剂量的交互作用对血清SOD活性无明显影响(P>0.05)。应用最小显著差数法(LSD)对各组数据进行两两比较,结果显示,血清SOD的活性在给药(缺血)时间1.5 h(A2)与2.5 h(A4),2.0 h(A3)与2.5 h(A4)间比较,差异有统计学意义(P<0.05),其余给药时间两两比较,差异无统计学意义(P>0.05);给药剂量5 mg(B1)与20 mg(B2),20 mg(B3)与40 mg(B4)比较,差异有统计学意义(P<0.05),其余给药剂量两两比较,差异无统计学意义(P>0.05)。从治疗时间窗最大化和用药剂量最小化的角度考虑,以A2B3组合最佳,即最佳治疗时间窗和治疗剂量为脑缺血1.5 h、腹腔注射20 mg/kg。

表4 SOD活性方差分析
GSH-Px活性:不同水平的缺血时间和给药剂量对血清GSH-Px活性的影响比较,差异有统计学意义(P<0.05),而时间-剂量的交互作用可忽略不计(P>0.05),详见表5。LSD两两比较显示,血清GSH-Px的活性在给药(缺血)时间1.0 h(A1)与2 h(A3),1.5 h(A2)与2.0 h(A3)比较,差异无统计学意义(P>0.05),其余给药时间两两比较,差异有统计学意义(P<0.05);给药剂量5 mg(B1)与40 mg(B4),10 mg(B2)与20 mg(B3)比较,差异无统计学意义(P>0.05),其余给药剂量两两比较,差异有统计学意义(P<0.05)。从治疗时间窗最大化和用药剂量最小化角度考虑,以A2B2最佳,即最佳治疗时间窗和剂量分别为脑缺血1.5 h和腹腔注射10 mg/kg。

表5 GSH-Px活性方差分析
CAT活性:不同水平的缺血时间对血清CAT活性均有明显影响(P<0.01),而给药剂量和时间-剂量交互作用对其无显著性影响(P>0.05),详见表6。LSD两两比较显示,血清CAT活性在给药(缺血)时间1.0 h(A1)与2.0 h(A3)间比较,差异无统计学意义(P>0.05),其余给药时间两两比较,差异有统计学意义(P<0.05);给药剂量5 mg(B1)与20 mg(B3),10 mg(B2)与40 mg(B4),20 mg(B3)与40 mg(B4)比较,差异有统计学意义(P<0.05),其余给药剂量两两比较,差异均无统计学意义(P>0.05)。根据治疗时间窗最大化和给药剂量最小化原则,以A2B3最佳,即最佳治疗时间窗和剂量为脑缺血1.5 h和腹腔注射20 mg/kg。

表6 CAT活性方差分析
3 讨论
医学研究表明,有些中药的有效成分如红景天苷、银杏内酯、毛蕊异黄酮、大黄酚等能有效改善脑缺血损伤后动物的神经功能、缩小脑梗死体积,减轻脑组织病理改变[10-12]。以剂量依赖的方式降低丙二醛(MDA),H2O2和蛋白羟基合物含量,增强SOD,CAT和GSH-Px的活性,具有抗氧化和抗细胞凋亡作用[13]。细胞培养发现,胡黄连苷Ⅱ对H2O2导致的PC12神经细胞[4-5]损伤有明显保护作用。动物试验表明,脑缺血-再灌注损伤后,胡黄连苷Ⅱ可能通过抑制细胞凋亡和调节iNOS及SOD的表达,改善模型大鼠神经行为功能[14]。
本试验以脑缺血大鼠血清中SOD,GSH-Px和CAT的活性为检测指标,L16(45)正交试验结果表明,不同水平的给药时间和用药剂量对胡黄连苷Ⅱ的治疗效果差异有统计学意义(P<0.05),且根据不同的检测指标分析其最佳组合结果也不尽一致。从用药剂量最小化和治疗时间窗最大化的角度考虑,以A2B3,A2B2和A3B3组合较好,即胡黄连苷Ⅱ治疗脑缺血损伤的最佳治疗时间窗和剂量为脑缺血1.5~2.0 h和腹腔注射10~20 mg/kg。
[1]Tomatsuri N,Yoshida N,Takagi T,et al.Edaravone,a newly developed radical scavenger protects against ischemia-reperfusion injury of the small intestine in rats[J].Int J Mol Med,2004,13(1):105-109.
[2]王景叶,于榕,姚明辉.红景天苷对缺血再灌注大鼠脑组织损伤的保护作用[J].中华中医药杂志,2010,25(3):456-459.
[3]Li P,Matsunaga K,Yamakuni T,et al.PicrosidesⅠandⅡ,selective enhancers of the mitogen-activated protein kinase-dependent signaling pathway in the action of neuritogenic substances on PC12D cells[J].Life Sci,2002,71(15):1 821-1 835.
[4]陶移文,刘建文,魏东芝,等.胡黄连苷-Ⅱ在体外对PC12神经细胞损伤的保护作用[J].中国临床药理学与治疗学,2003,8(1):27-30.
[5]郭明川,曹艳,刘建文.胡黄连苷Ⅱ在谷氨酸诱导的PC12细胞损伤中的保护作用[J].中国临床药理学与治疗学,2007,12(4):440-443.
[6]Sun L,Li XD,Wang L,et al.Anti-oxidant effect of picrosideⅡin a rat model of cerebral ischemia/reperfusion injury[J].Neural Regen Res,2011,6(15):1 141-1 146.
[7]Li Q,Li Z,Xu XY,et al.Neuroprotective properties of picrosideⅡin rat model of focal cerebral ischemia[J].Int J Mol Sci,2010,11(11):4 580-4 590.
[8]李红云,赵丽,宿希,等.胡黄连苷Ⅱ治疗脑缺血/再灌注损伤剂量和时间窗的初步探讨[J].中国药理学通报,2012,28(4):549-553.
[9]Márquez-Martín A,Jiménez-Altayó F,Dantas AP,et al.Middle cerebral artery alterations in a rat chronic hypoperfusion model[J].J Appl Physiol,2012,112(3):511-518.
[10]林宇,崔红霞,赵学梅,等.银杏内酯B对大鼠脑缺血再灌注损伤的保护作用[J].中国药理学与毒理学杂志,2012,26(3):430-431.
[11]Guo C,Tong L,Xi M,et al.Neuroprotective effect of calycosin oncerebral ischemia and reperfusion injury in rats[J].J Ethnopharmacol,2012,144(3):768-774.
[12]王树,张丹参,薛贵平,等.大黄酚对脑缺血再灌注小鼠脑组织H2O2和CAT的影响[J].中药药理与临床,2008,24(4):22-24.
[13]SunYX,Tang Y,Wu AL,et al.Neuroprotective effect of liquiritin against focal cerebral ischemia/reperfusion in mice via its antioxidant and antiapoptosisproperties[J].JAsianNatProdRes,2010,12(12):1051-1060.
[14]赵多明,张梓倩,段云霞,等.胡黄连苷Ⅱ对脑缺血再灌注大鼠神经损伤的保护作用研究[J].国际药学研究杂志,2010,37(6):461-465,468.
Preliminary Study on the Treatment of Rats with Cerebral Ischemia Injury in Dose and Time Window of PicrosideⅡ
Yu Chunhua1,Song Meng1,Qu Xiancheng1,Wang Lili1,Wang Yuan2
(1.Central Hospital of Qingdao,Qingdao,Shandong,China266000;2.Department of Pharmacy,The Ninth Hospital of Qingdao,Qingdao,Shandong,China266000)
ObjectiveTo study the optimal dose and time window of Picroside II in treating cerebral ischemia injury in rats.Methods The bilateral common carotid arteryligation(BCCAO)was used to establish the model of forebrain ischemia in rats,the orthogonal experiment design was used to divide the groups.The rats were given intraperitoneal injection of PicrosideⅡ.The serum superoxide dismutase(SOD),glutathione peroxidase(GSH-Px)and catalase(CAT)activity was detect by the application of xanthine oxidase,chemical colorimetry and photochemical method.ResultsAccording to the analysis of serum SOD,GSH-Px and CAT activity in cerebral ischemia,the optimal effect of PicrosideⅡin treating cerebral ischemic injury was by intraperitoneal injection of 1.5 h 20 mg/kg,1.5 h/10(mg·kg)and 1.5 h/20(mg·kg).ConclusionThe optimal dose and time window of PicrosideⅡin treating cerebral ischemia is by intraperitoneal injection of 1.5-2.0 h and 10-20 mg/kg.
PicrosideⅡ;cerebral ischemia;dose;time window;SOD;GSH-Px;CAT;rat
R285.5;R282.71
A
1006-4931(2015)20-0062-03
于春华(1963-),女,汉族,大学本科,副主任药师,研究方向为心脑血管疾病,(电子信箱)0532meng@sina.com;王远,女,汉族,大学本科,副主任药师,研究方向为心脑血管疾病,本文通讯作者,(电话)0532-84961730。
2015-03-30)

