胆碱能受体激动剂逆转天疱疮棘层松解的机制研究
李志量 张洁尘 徐浩翔 杨永红 冯素英 王宝玺
·论著·
胆碱能受体激动剂逆转天疱疮棘层松解的机制研究
李志量 张洁尘 徐浩翔 杨永红 冯素英 王宝玺
目的 研究胆碱能受体激动剂对天疱疮棘层松解的逆转作用及其机制。方法 将HaCaT细胞与寻常型天疱疮IgG(PV-IgG)共培养建成天疱疮细胞模型后,再加入胆碱能受体激动剂卡巴胆碱共培养,以PVIgG诱导的天疱疮细胞模型作为对照,通过细胞解离实验定量分析卡巴胆碱对棘层松解的逆转情况,用免疫荧光方法定性观察桥粒蛋白变化;分别用RIPA和Triton X-100裂解细胞,得到总蛋白和胞质蛋白,用蛋白免疫印迹灰度值定性分析HaCaT细胞表面与黏附相关的桥粒芯蛋白3(Dsg3)、桥斑珠蛋白(PG)的变化,不同时间点p38丝裂原活化蛋白激酶(p38 MAPK)、表皮生长因子受体(EGFR)的磷酸化水平;用定量聚合酶链反应(qPCR)检测上述细胞表面蛋白在mRNA水平的变化;通过免疫共沉淀方法定性分析Dsg3与PG相互作用的变化情况。结果 PV-IgG组细胞碎片数为46.67±2.03,卡巴胆碱组为18.67±2.52,两组比较,t=11.22,P<0.01;免疫荧光实验发现,卡巴胆碱可以逆转PV-IgG所致的桥粒分子内化。在天疱疮细胞模型中,细胞总的Dsg3和PG含量下降,非桥粒部分的Dsg3下降,非桥粒PG含量增加,且Dsg3与PG的相互作用减弱,加入卡巴胆碱后可逆转上述变化。卡巴胆碱也可使Dsg3 mRNA的相对表达量(2-ΔΔCt)由1.428±0.215增加至4.974±0.948(t=3.65,P=0.01),PG mRNA 的相对表达量由1.563±0.247增加至 13.420±1.715(t=6.85,P<0.01)。磷酸化实验中,卡巴胆碱可以抑制EGFR磷酸化,而对p38 MAPK磷酸化无明显影响。结论 胆碱能受体激动剂卡巴胆碱具有逆转棘层松解的作用,这种逆转作用的机制可能包括:抑制Dsg3和PG内化并增加其表达,增强Dsg3与PG的相互作用,抑制棘层松解关键信号EGFR的磷酸化。
天疱疮;胆碱能激动剂;皮肤棘层松解;桥粒芯糖蛋白质3;γ连环素;HaCaT细胞
天疱疮是一种由自身抗体引起的自身免疫性皮肤病。系统应用糖皮质激素大大降低了该病死亡率(10%),但其不良反应已成为天疱疮患者死亡的重要原因[1]。从天疱疮发病机制出发,寻找非激素治疗方法成为近年研究的热点。有观点认为,除了桥粒芯蛋白途径之外,乙酰胆碱途径也在天疱疮的发病中发挥一定作用[2]。天疱疮患者血清中存在乙酰胆碱受体抗体[3-4],天疱疮患者皮损中乙酰胆碱受体的表达、分布发生了变化[4]。在细胞水平[5]、动物水平[6]及临床观察[7]均证实胆碱能激动剂对天疱疮棘层松解有抑制作用,但确切机制尚不明确。我们在HaCaT细胞构建的天疱疮细胞模型基础上[8],对胆碱能激动剂卡巴胆碱(carbachol)逆转棘层松解的机制进行研究。
材料和方法
1.主要实验试剂:HaCaT细胞系来源于中国医学科学院皮肤病研究所中心实验室;10%胎牛血清-DMEM培养液(美国life technologies公司)。寻常型天疱疮IgG(pemphigus vulgaris immunoglobulin G,PV-IgG)和正常人IgG分别由PV患者和正常人血清经IgG亲和纯化得到,浓缩后IgG质量浓度为20 g/L,桥粒芯蛋白 3(desmoglein-3,Dsg3)抗体为653 U/ml,Dsg1 抗体为 343 U/ml;IgG 终浓度为 1 g/L。其他主要试剂:卡巴胆碱(美国sigma-Aldrich公司,选取不影响细胞增殖与活力的最高浓度10-4mol/L);分散酶Ⅱ(美国罗氏诊断产品有限公司);10%Bis-tris预制胶、MOPS电泳缓冲液、上样缓冲液、trizol、鼠抗人Dsg3抗体(美国life technologies公司);蛋白预染marker(美国Bio-rad公司);化学发光液、IgG亲和纯化柱、免疫共沉淀试剂盒(Pierce Direct IP Kit 26148)、免疫印迹洗脱液(美国Thermo Fisher scientific);兔抗人p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38 MAPK)、磷酸化p38 MAPK、表皮生长因子受体(epidermal growth factor receptor,EGFR)、磷酸化 EGFR抗体(美国Cell Signal Technology公司);鼠抗人桥斑珠蛋白(plakoglobin,PG)抗体(美国 BD 公司);RIPA 裂解液、Triton X-100裂解液、HRP标记山羊抗小鼠、HRP标记山羊抗兔IgG抗体(上海碧云天生物技术研究所);逆转录试剂盒、qPCR试剂盒(美国普洛麦格生物技术有限公司);桥粒芯蛋白抗体检测试剂盒(日本MBL公司)。
2.实验分组与处理:HaCaT细胞培养至80%融合后实验分4组:正常人IgG(NH-IgG)组、PV-IgG组、NH-IgG+卡巴胆碱组、PV-IgG+卡巴胆碱组,qPCR实验中加一组未经任何处理的HaCaT细胞作空白对照。经上述处理,作用12 h,收集细胞进行进一步实验。在检测细胞因子磷酸化实验中,PV-IgG分别作用 HaCaT 细胞 30、60、120、180 min,以研究细胞因子磷酸化最高峰的时间点。
3.HaCaT细胞解离实验:HaCaT细胞用磷酸盐缓冲液(PBS)清洗2次,加入1 ml 2 U/ml分散酶Ⅱ,37℃孵箱中作用30 min后细胞单层与培养皿分离,但细胞间仍保持紧密连接状态;吸除分散酶Ⅱ溶液,加入1 ml PBS,在相同机械力(1 ml移液器匀速吹打10次)作用下,细胞发生解离,计数每孔的细胞碎片数量。每组实验均重复3次。
4.免疫荧光:HaCaT接种于铺有细胞专用爬片的12孔板中孵育,细胞经各组处理后,以PBS清洗,加入新鲜配置的4%多聚甲醛固定10 min。PBS洗3次,每次5 min。加入0.1%Triton X-100作用5 min,并以PBS清洗后加入2%牛血清白蛋白-PBS封闭30 min。加入相应抗体室温孵育1 h;加入二抗后室温孵育45 min;加入7.5 mg/L Hoechest33342染色10 min标记细胞核,激光共聚焦显微镜(FluoViewTMFV1000,Olympus corporation) 下观察Dsg3、PG蛋白荧光染色。阴性对照以PBS代替一抗。
5.蛋白抽提:各组HaCaT细胞用PBS洗2次后,加入RIPA或Triton X-100裂解液(RIPA可以强效裂解细胞,将膜蛋白和胞质蛋白完全抽提,得到总蛋白;Triton X-100是温和裂解液,无法将紧密连接的桥粒蛋白从胞膜上剥离,可以抽提胞质蛋白以及与细胞膜上非桥粒黏附分子,反映的是膜蛋白与细胞膜连接的紧密程度),4℃作用5 min后,用细胞刮将细胞裂解液快速刮于培养皿的一端,吸至离心管中,13 800×g离心 15 min,收集上清并分装。
6.免疫印迹:蛋白定量后,将等量的提取蛋白分别与4倍上样缓冲液预混,70℃加热变性10 min后上样,每孔上样量 25 μl,200 V 电泳45 min。转至聚偏二氟乙烯膜(PVDF),湿法转印,300 mA恒流2 h,牛血清白蛋白(BSA)室温摇床振荡封闭1 h。与相应稀释度的一抗(β肌动蛋白作为内参,磷酸化实验中,总的p38 MAPK、EGFR作内参)在4℃摇床振荡孵育16 h,三羟甲基氨基甲烷吐温缓冲液(TBST)洗涤后,加入相应二抗室温孵育1 h。TBST洗去未结合的二抗,采用化学发光法在凝胶成像仪(Bio-rad ChemiDocTMXRS+)上观察各自条带。每组实验均重复3次。
7.不同细胞表面蛋白mRNA表达测定:细胞用PBS洗2次后,TRIzol法提取RNA,蛋白核酸分析仪测定RNA浓度,要求A260/280 nm值为1.7-2.0。依据逆转录试剂盒说明合成反转录脱氧核糖核苷酸(cDNA);依据qPCR试剂盒说明扩增目的条带,引物序列见表1。采用Thermal cycler′s软件包计算Ct值,分析荧光强度。2-ΔΔCt代表mRNA相对表达量。
8.免疫共沉淀:按照免疫共沉淀试剂盒说明书流程操作,用免疫沉淀裂解液裂解细胞,PG单抗交联于琼脂糖珠,将裂解液中含PG的蛋白复合物沉淀下来,去掉琼脂(聚)糖小球,将蛋白复合物裂解,进行免疫印迹实验,以PG为内参,观察不同组别Dsg3的含量差异。

表1 qPCR引物序列
9.统计学处理:数据以SPSS 18.0软件包进行统计分析。计量资料以±s描述,两组间比较用t检验。
结 果
1.卡巴胆碱逆转天疱疮棘层松解:HaCaT细胞与PV-IgG共培养后,细胞解离实验显示,PV-IgG组细胞碎片数目为46.67±2.03,NH-IgG组为5.00±0.58,两组比较,n=3,t=19.76,P < 0.01;PV-IgG+卡巴胆碱组细胞碎片数减少至18.67±1.45,与PVIgG 组相比,t=11.22,P<0.01;NH-IgG+卡巴胆碱组为4.67±0.88。在免疫荧光实验中,PV-IgG组Dsg3和PG均出现了细胞内聚集现象;PV-IgG+卡巴胆碱组Dsg3与PG均恢复正常的胞膜染色模式(图 1)。
2.卡巴胆碱影响桥粒分子蛋白质水平的表达:HaCaT细胞与PV-IgG共培养后,RIPA裂解液作用下的Dsg3和PG水平下降。在Triton X-100作用下,非桥粒部分的Dsg3水平下降,而非桥粒部分的PG水平升高。在加入卡巴胆碱后上述变化均出现逆转,恢复到空白对照组水平。在与NH-IgG共培养的HaCaT细胞中加入卡巴胆碱后,Dsg3和PG总蛋白水平均明显升高(图2)。
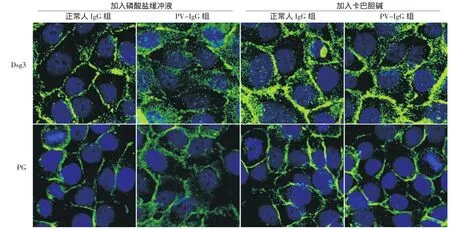
图1 卡巴胆碱逆转寻常型天疱疮IgG(PV-IgG)所致的桥粒芯蛋白3(Dsg3)和桥斑珠蛋白(PG)内化 HaCaT细胞在PV-IgG作用下,Dsg3和PG出现内化,染色不连续;在此天疱疮细胞模型的基础上加入卡巴胆碱后,Dsg3与PG并不出现内化现象,呈现出在胞膜的连续荧光
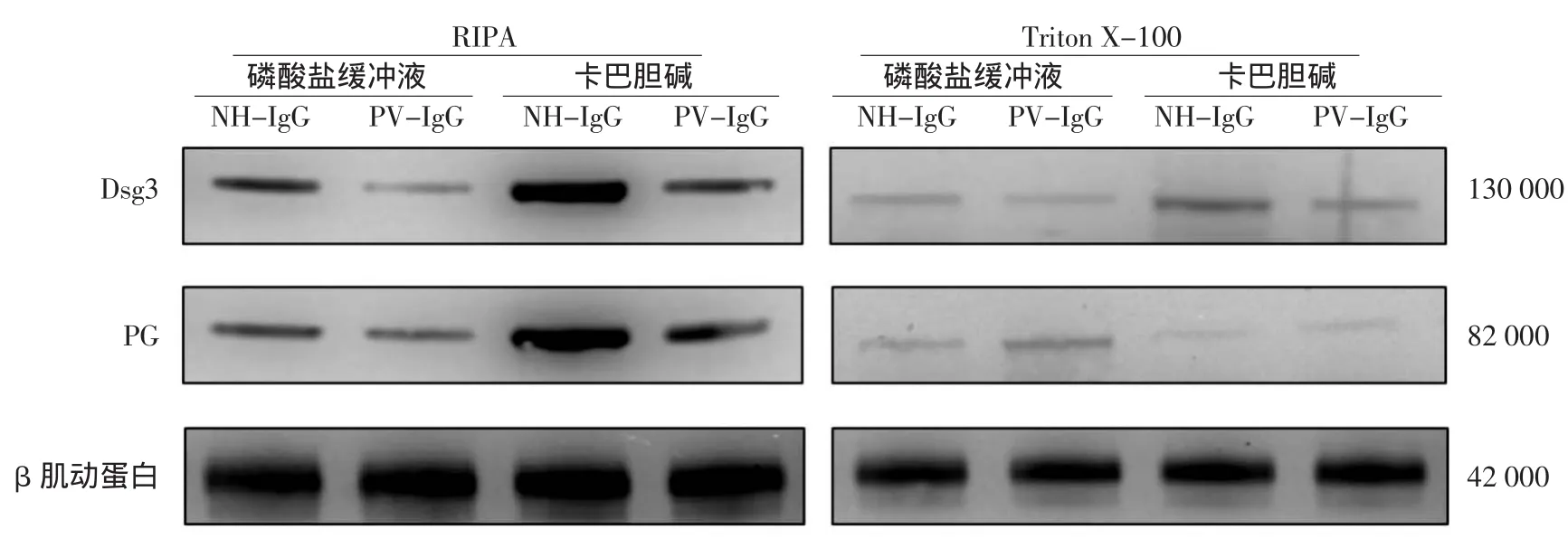
图2 卡巴胆碱对HaCaT细胞桥粒芯蛋白3(Dsg3)和桥斑珠蛋白(PG)蛋白质水平的影响 HaCaT细胞在PV-IgG作用下,Dsg3和PG总蛋白含量下降,Triton X-100可溶的Dsg3下降,PG含量升高;在此天疱疮细胞模型的基础上加入卡巴胆碱可逆转上述变化。NH-IgG:正常人血清IgG;PV-IgG:寻常型天疱疮患者血清IgG
3.卡巴胆碱影响桥粒分子mRNA水平的表达:如表2所示,在PV-IgG作用下,HaCaT细胞Dsg3和PG在mRNA水平与NH-IgG组相比无明显变化(t值分别为1.17和0.54,P值分别为0.29和0.61)。NH-IgG+卡巴胆碱组Dsg3和PG mRNA水平表达均明显升高,与NH-IgG组相比,t值分别为3.65和3.00,P值分别为0.02和<0.01;PV-IgG+卡巴胆碱组Dsg3和PG的mRNA水平表达与PV-IgG组相比也明显升高,与NH-IgG组相比,t值分别为3.65和6.85,P值分别为0.01和<0.01。
4.卡巴胆碱影响Dsg3与PG之间的相互作用:在免疫共沉淀实验中,HaCaT细胞在PV-IgG作用下,与PG相互作用的Dsg3明显减少;在加入卡巴胆碱后,与PG相互作用的Dsg3水平恢复到正常水平(图 3)。
5.卡巴胆碱影响棘层松解相关信号分子磷酸化水平:在PV-IgG作用下,HaCaT细胞p38 MAPK和EGFR发生磷酸化,p38 MAPK的磷酸化早于EGFR的磷酸化,其峰值时间分别在60 min和120 min;在加入卡巴胆碱后,p38 MAPK的磷酸化水平并未发生变化,而EGFR的磷酸化被完全抑制(图4)。
表2 卡巴胆碱对寻常型天疱疮IgG(PV-IgG)作用下HaCaT细胞蛋白桥粒芯蛋白3、桥斑珠蛋白mRNA 表达水平的影响(2-ΔΔCt,±s)
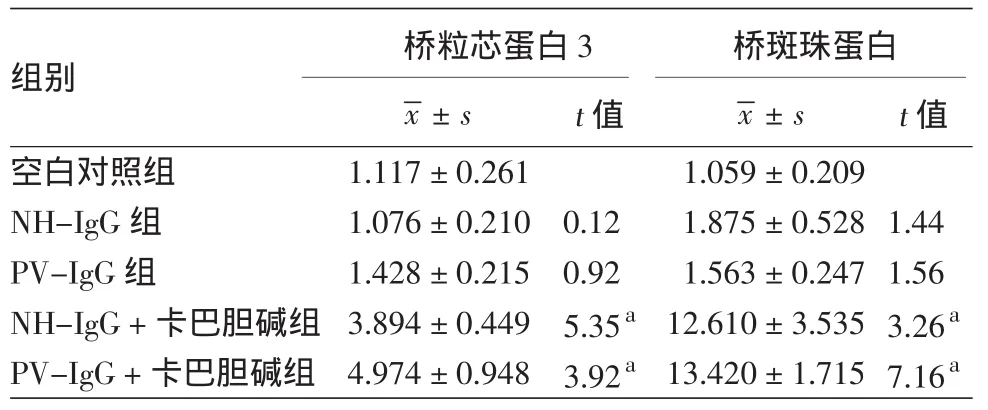
表2 卡巴胆碱对寻常型天疱疮IgG(PV-IgG)作用下HaCaT细胞蛋白桥粒芯蛋白3、桥斑珠蛋白mRNA 表达水平的影响(2-ΔΔCt,±s)
注:n=4,空白对照:HaCaT细胞不加任何处理;a:与空白对照组比较,P<0.05。NH-IgG:正常人IgG组
组别 桥粒芯蛋白3 桥斑珠蛋白x±s t值空白对照组 1.117±0.261 1.059±0.209 NH-IgG组 1.076±0.210 0.12 1.875±0.528 1.44 PV-IgG组 1.428±0.215 0.92 1.563±0.247 1.56 NH-IgG+卡巴胆碱组 3.894±0.449 5.35a12.610±3.535 3.26a PV-IgG+卡巴胆碱组 4.974±0.948 3.92a13.420±1.715 7.16a x±s t值
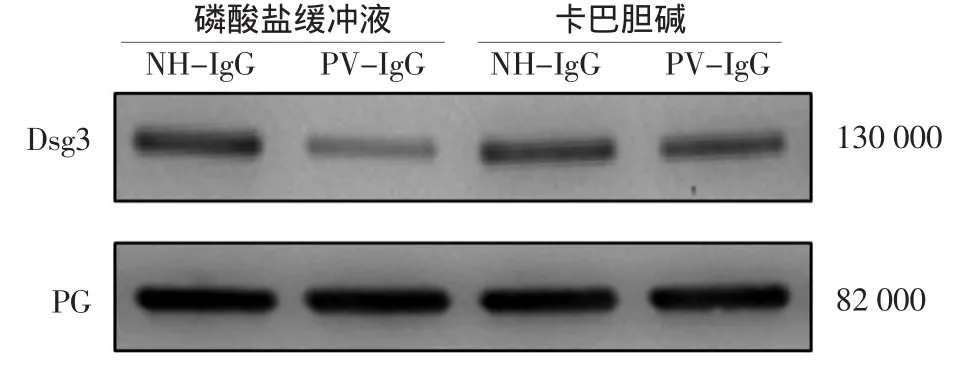
图3 卡巴胆碱影响HaCaT细胞桥粒芯蛋白3(Dsg3)与桥斑珠蛋白(PG)之间的相互作用 HaCaT在PV-IgG作用下,与PG作用的Dsg3含量下降;在此天疱疮细胞模型的基础上加入卡巴胆碱可增加与PG作用的Dsg3蛋白含量。NH-IgG:正常人血清IgG;PV-IgG:寻常型天疱疮患者血清IgG

图4 卡巴胆碱处理HaCaT细胞不同时间对棘层松解相关信号分子p38丝裂原活化蛋白激酶(p38 MAPK)、表皮生长因子受体(EGFR)磷酸化水平的影响 在HaCaT细胞中加入寻常型天疱疮IgG(PV-IgG)后,p38 MAPK在60 min时磷酸化水平达到最高,EGFR在120 min时磷酸化水平达到最高;在此天疱疮细胞模型的基础上加入卡巴胆碱后,EGFR的磷酸化完全被抑制,而对p38 MAPK的磷酸化水平无明显影响。p-p38 MAPK:磷酸化p38 MAPK;p-EGFR:磷酸化EGFR
讨 论
近年来针对天疱疮的研究表明,除了桥粒芯蛋白途径之外,还有其他一些旁路途径在天疱疮发病中也发挥一定作用;如 PG[9]、斑菲素蛋白[10]等其他桥粒分子,p38MAPK[11]、EGFR[12]等细胞内信号分子,以及乙酰胆碱途径、一氧化碳合酶途径[13]等。
在HaCaT细胞中加入PV-IgG后,细胞解离实验测得细胞碎片数量增多,且Dsg3、PG的荧光染色紊乱,出现向细胞内聚集的现象,与以往文献中报道的棘层松解现象一致[14]。加入卡巴胆碱后,细胞的解离和桥粒蛋白的染色模式均发生逆转,再次通过细胞实验证实了卡巴胆碱对棘层松解的逆转作用。值得注意的是,卡巴胆碱不仅使Dsg3的荧光染色模式逆转,Dsg3的荧光强度也明显增加,结合随后的免疫印迹与qPCR结果,这种荧光强度的增加与卡巴胆碱增加HaCaT细胞Dsg3的表达有关。
在天疱疮的细胞模型中,我们观察到Dsg3和PG的总蛋白量下降,但Dsg3和PG在mRNA水平并未出现明显变化,因此这种蛋白总量的下降并不代表表达水平的下降,而是由于蛋白内化降解所致;非桥粒部分的Dsg3与PG表现出了相反的变化,非桥粒Dsg3的减少可能是由于在PV-IgG作用下形成了Dsg3三聚体,这种三聚体在免疫印迹实验中相对分子质量130 000处无法被检测到[8];非桥粒PG的升高是由于PV-IgG作用下桥粒结构松动,PG从细胞骨架脱离从而容易被Triton X-100抽提。免疫共沉淀实验中,加入PV-IgG后,Dsg3与PG的相互作用减少。加入卡巴胆碱后,上述天疱疮细胞模型的各种变化都发生逆转。并且卡巴胆碱在mRNA水平也可以增加Dsg3和PG的表达,从而对稳定桥粒结构起到积极作用。
细胞内信号转导通路在天疱疮棘层松解的发生中发挥一定作用,既往的文献中,PV-IgG刺激后信号分子活化次序有所不同[15-16],我们的研究中,p38 MAPK磷酸化水平在60 min时即可达到顶峰,而EGFR磷酸化水平在120 min时达到顶峰,p38 MAPK的磷酸化发生在EGFR磷酸化之前,这与Bektas等[15]的研究一致。卡巴胆碱可以完全抑制EGFR磷酸化而对p38 MAPK磷酸化无明显影响,说明卡巴胆碱可以作用于较下游的信号途径从而抑制棘层松解。
本研究中,我们通过HaCaT细胞构建的天疱疮细胞模型研究了胆碱能激动剂逆转棘层松解的机制,胆碱能激动剂卡巴胆碱可以通过增加Dsg3、PG的表达,抑制Dsg3、PG内化,加强PG与Dsg3的相互作用,抑制EGFR磷酸化等途径逆转棘层松解。
[1]Martin LK,Murrell DF.Treatment of pemphigus:the need for more evidence[J].Arch Dermatol,2008,144(1):100-101.
[2]Nguyen VT,Ndoye A,Shultz LD,et al.Antibodies against keratinocyte antigens other than desmogleins 1 and 3 can induce pemphigus vulgaris-likelesions[J].J Clin Invest,2000,106(12):1467-1479.
[3]Vu TN,Lee TX,Ndoye A,et al.The pathophysiological significance of nondesmoglein targets of pemphigus autoimmunity.Development of antibodies against keratinocyte cholinergic receptors in patients with pemphigus vulgaris and pemphigusfoliaceus [J].Arch Dermatol,1998,134(8):971-980.
[4]冯素英,周武庆,桑红桂,等.乙酰胆碱受体在天疱疮患者体内的表达[J].临床皮肤科杂志,2012,41(8):457-460.
[5]Grando SA,Dahl MV.Activation of keratinocyte muscarinic acetylcholine receptors reverses pemphigus acantholysis[J].J Eur Acad Dermatol Venereol,1993,2(2):72-86.
[6]Nguyen VT,Arredondo J,Chernyavsky AI,et al.Pemphigus vulgaris acantholysis ameliorated by cholinergic agonists[J].Arch Dermatol,2004,140(3):327-334.
[7]Iraji F,Yoosefi A.Healing effect of Pilocarpine gel 4%on skin lesions of pemphigus vulgaris[J].Int J Dermatol,2006,45(6):743-746.
[8]Spindler V,Rötzer V,Dehner C,et al.Peptide-mediated desmoglein 3 crosslinking prevents pemphigus vulgaris autoantibody-induced skin blistering[J].J Clin Invest,2013,123(2):800-811.
[9]SpindlerV,DehnerC,HübnerS,etal.Plakoglobinbutnotdesmoplakin regulates keratinocyte cohesion via modulation of p38MAPK signaling[J].J Invest Dermatol,2014,134(6):1655-1664.
[10]Cirillo N,AlShwaimi E,McCullough M,et al.Pemphigus vulgaris autoimmune globulin induces Src-dependent tyrosinephosphorylation ofplakophilin 3 and itsdetachmentfrom desmoglein 3[J].Autoimmunity,2014,47(2):134-140.
[11]Berkowitz P,Hu P,Liu Z,et al.Desmosome signaling.Inhibition of p38MAPK prevents pemphigus vulgaris IgG-induced cytoskeletonreorganization[J].J Biol Chem,2005,280(25):23778-23784.
[12]Sayar BS,Rüegg S,Schmidt E,et al.EGFR inhibitors erlotinib and lapatinib ameliorate epidermal blistering in pemphigus vulgaris in a non-linear,V-shaped relationship[J].Exp Dermatol,2014,23(1):33-38.
[13]España A,Mòdol T,Gil MP,et al.Neural nitric oxide synthase participates in pemphigus vulgaris acantholysis through upregulation of Roussarcoma,mammalian target of rapamycin and focal adhesion kinase[J].Exp Dermatol,2013,22(2):125-130.
[14]Calkins CC,Setzer SV,Jennings JM,et al.Desmoglein endocytosis and desmosome disassembly are coordinated responses to pemphigus autoantibodies[J].J Biol Chem,2006,281(11):7623-7634.
[15]Bektas M,Jolly PS,Berkowitz P,et al.A pathophysiologic role for epidermal growth factor receptor in pemphigus acantholysis[J].J Biol Chem,2013,288(13):9447-9456.
[16]Chernyavsky AI,Arredondo J,Kitajima Y,et al.Desmoglein versus non-desmoglein signaling in pemphigus acantholysis:characterization of novel signalingpathways downstream of pemphigus vulgaris antigens[J].J Biol Chem,2007,282(18):13804-13812.
Mechanisms underlying the reversal of acantholysis in pemphigus by a cholinergic receptor agonist
Li Zhiliang,Zhang Jiechen,Xu Haoxiang,Yang Yonghong,Feng Suying,Wang Baoxi.Hospital of Dermatology,Chinese Academy of Medical Sciences and Peking Union Medical College;Jiangsu Key Laboratory of Molecular Biology for Skin Diseases and STIs,Nanjing 210042,China
s:Wang Baoxi,Email:wangbx@ncstdlc.org;Feng Suying,Email:fengsuying2010@aliyun.com
ObjectiveTo evaluate the reversal effect of a cholinergic receptor agonist on acantholysis in pemphigus,and to investigate its mechanism.MethodsHuman HaCaT keratinocytes were co-cultured with pemphigus vulgaris immunoglobulin G (PV-IgG)to establish a cell model of pemphigus,then classified into two groups to be incubated with the cholinergic receptor agonist carbachol for 12 hours(test group)or remain untreated(control group).Cell dissociation assay was performed to quantitatively estimate the reversal effect of carbachol on acantholysis,and immunofluorescence assay to qualitatively assess the changes of desmosomal proteins.Radio-immunoprecipitation assay(RIPA)lysis buffer and Triton X-100 were used to lyse HaCaT cells to obtain total proteins and cytoplasmic proteins,and Western blot was conducted to determine the expression levels of adhesion-related proteins desmoglein 3(Dsg3)and plakoglobin(PG)on the surface of HaCaT cells,as well as the phosphorylation levels of p38 mitogen activated protein kinase (p38 MAPK)and epidermal growth factor receptor(EGFR)at different time points.Quantitative polymerase chain reaction(qPCR)was performed to detect the mRNA expressions of the above surface proteins,and coimmunoprecipitation assay to qualitatively evaluate the interaction between Dsg3 and PG.ResultsThe number of cell debris was significantly lower in the test group than in the control group(18.67±2.52 vs.46.67±2.03,t=11.22,P<0.01).Immunofluorescence assay showed that carbachol could reverse the internalization of desmosomal molecules induced by PV-IgG.In the pemphigus cell model,the levels of total Dsg3 and PG as well as non-desmosomal Dsg3 were decreased,while the level of non-desmosomal PG increased,and the interaction between Dsg3 and PG was attenuated.When the pemphigus cell model was co-cultured with carbachol,these above changes were reversed.Carbachol also increased the mRNA levels(expressed as 2-ΔΔCt)of Dsg3 and PG from 1.428±0.215 and 1.563±0.247 in the controlgroup to 4.974±0.948(t=3.65,P=0.01)and 13.420±1.715(t=6.85,P<0.01)in the test group respectively.In phosphorylation assay,carbachol inhibited the phosphorylation of EGFR,but had no significant effect on that of p38 MAPK.ConclusionsThe cholinergic receptor agonist carbachol can reverse acantholysis in pemphigus,likely by inhibiting the internalization of Dsg3 and PG,enhancing their expressions and interaction,and suppressing the phosphorylation of the key signaling molecule for acantholysis,EGFR.
Pemphigus;Cholinergic agonists;Acantholysis;Desmoglein 3;gamma Catenin;HaCaT cells
10.3760/cma.j.issn.0412-4030.2015.04.011
国家自然科学基金(81071295);卫生公益性行业科研专项经费(201002016);江苏省重点实验室自拟课题(201220009);北京协和医学院学生创新基金(2013100217)
210042南京,中国医学科学院北京协和医学院皮肤病医院,江苏省皮肤病与性病学重点实验室
王宝玺,Email:wangbx@ncstdlc.org;冯素英,Email:fengsuying2010@aliyun.com
2014-07-23)
(本文编辑:颜艳)

