几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶特性的影响
杨贤庆,马静蓉,2,马海霞,李来好,陈胜军(.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州50300;2.广东海洋大学食品科技学院,广东湛江524088)
几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶特性的影响
杨贤庆1,马静蓉1,2,马海霞1,李来好1,陈胜军1
(1.中国水产科学研究院南海水产研究所,农业部水产品加工重点实验室,国家水产品加工技术研发中心,广东广州510300;2.广东海洋大学食品科技学院,广东湛江524088)
研究了乙二胺四乙酸二钠(EDTA)、焦磷酸钠(PPi)、牛血清蛋白(BP)、马铃薯粉(PP)等几种常见蛋白酶抑制剂对南海鸢乌贼鱼糜凝胶硬度、弹性和持水性的影响,并结合SDS-PAGE凝胶电泳对相关作用机理进行分析。结果表明,PPi、BP、PP都能显著提高鸢乌贼鱼糜的凝胶性能;当同时添加2%的谷氨酰胺转氨酶(TGase)、250 mg/kg的EDTA、0.3%的PPi、3%的BP和3%的PP时,鸢乌贼鱼糜的凝胶硬度、弹性达到最大。SDS-PAGE分析表明,4种蛋白酶抑制剂和TGase能共同促进鸢乌贼鱼糜凝胶的形成;TGase不能和肌动蛋白(Actin)发生交联反应;副肌球蛋白(PM)参与了鸢乌贼鱼糜凝胶的形成过程。
鸢乌贼鱼糜,蛋白酶抑制剂,谷氨酰胺转氨酶,凝胶特性
鱼糜制品作为一种优质蛋白产品,因其食用方便、味美形好、烹调简单等优点广受国内外消费者欢迎,需求量日益增长。然而随着海洋过渡捕捞,生产鱼糜的传统原料产量不断下降,寻找新的鱼糜原料已越来越迫切。近年来远洋渔业的飞速发展,为水产加工提供了大量的头足类资源,我国南海丰富的鸢乌贼资源被开发[1-2]。南海鸢乌贼高蛋白低脂肪,能满足人们对海洋蛋白的需求;含有丰富的氨基酸,肉美味鲜;含有丰富的DHA、EPA及锌铁元素,具备一定的保健功效[3],其加工利用成为人们普遍关注且急需解决的问题。以鸢乌贼胴体肌肉为原料来制作鱼糜及其制品,既能实现鸢乌贼的高值化利用,又能为鱼糜加工产业提供一种新型原料。
凝胶硬度、弹性以及持水性是衡量鱼糜制品品质的重要指标,因而提高鱼糜制品的硬度、弹性和持水性,是鱼糜生产的关键[4]。然而头足类动物不像其他的鱼类具有很好的热凝胶形成能力,其肌肉蛋白凝胶弹性和强度较低[5],这与头足类动物的肌肉特点有很大的关系,头足类动物肌肉中存在大量蛋白酶,其蛋白水解活性较其他大多数的鱼种都高,大量蛋白酶的存在将会干扰凝胶的形成[6-8]。目前研究发现这些酶主要是金属蛋白酶[8],在40℃附近活性较强,它会降解肌球蛋白重链(MHC),将其分解成重酶解肌球蛋白(HMM)和轻酶解肌球蛋白(LMM)。因而为提高鸢乌贼鱼糜制品的凝胶性能,有必要研究出能有效抑制这些蛋白酶的添加剂以提高其凝胶性能。
本文以南海鸢乌贼胴体肌肉为原料,研究了乙二胺四乙酸二钠(EDTA)、焦磷酸钠(PPi)、牛血清蛋白(BP)、马铃薯粉(PP)等几种常见的食品级蛋白酶抑制剂以及结合谷氨酰胺转氨酶(TGase)共同作用对鸢乌贼鱼糜凝胶性能的影响,以期为生产出优质的鸢乌贼鱼糜制品提供理论参考。
1 材料与方法
1.1材料与仪器
鸢乌贼(胴体长约15 cm,-20℃冻藏3个月) 来源于南海水产研究所“南锋号”科考船,捕捞于南海海域;EDTA、PPi为市售分析纯试剂;BP广州齐云生物科技有限公司;TGase(酶活力100 U/g) 绿微康生物工程有限公司;PP购于华润万家超市;SDSPAGE凝胶制备试剂盒康为世纪生物科技有限公司;考马斯亮蓝R250南京建成科技有限公司。
CT3质构仪美国Brookfield公司;Sigma-3K30高速冷冻离心机德国SIGMA公司;HH-4数显恒温水浴锅常州澳华仪器有限公司;Powerpac@HV等电聚焦电泳仪美国Bio-rad公司;Tanon1600凝胶成像系统上海天能科技有限公司。
1.2实验方法
1.2.1鸢乌贼鱼糜加工工艺流程鸢乌贼鱼糜的加工工艺参考杨芳[9]的方法并稍作修改,具体工艺流程为:鸢乌贼→前处理(去头、去皮、去内脏)→清洗→切块(2 cm×2 cm)→绞肉→漂洗(先用5倍于鱼糜质量的0.5%碳酸氢钠溶液,漂洗2次,再用清水漂洗一次,每次漂洗10 min,水温不高于10℃)→离心(10000 r/min,15 min)→斩拌(2%食盐)→加入辅料→成型(灌肠)→两段凝胶化(先35℃、60 min,再90℃、30 min)→冷却(碎冰冷却20 min)→4℃冰箱放置过夜
1.2.2外源添加物对鸢乌贼鱼糜凝胶特性的影响向各实验组鸢乌贼鱼糜中加入蛋白酶抑制剂,分别是1%、2%和3%的BP;1%、2%、3%和4%的PP;250 mg/kg的EDTA以及0.3%的PPi,考察各蛋白酶抑制剂对鸢乌贼鱼糜凝胶特性的影响。然后,将4种蛋白酶抑制剂进行组合添加(依据对鸢乌贼鱼糜凝胶特性的影响效果,BP与PP的添加量都选择3%),以及搭配2%的TGase同时添加到鸢乌贼鱼糜中加热凝胶,测定凝胶性能。调节各混合物的水分含量一致为86%。
1.2.3质构的测定采用CT3质构仪的TPA模式对鸢乌贼鱼糜进行质构分析。将鱼肠切成25 mm高的圆柱体,选用6 mm圆柱探头进行连续两次挤压样品。参数设定:触发值5 g,测试速度1 mm/s,下压位移15 mm。
硬度:指样品达到一定变形所必须的力,是第一次压缩时的峰值负荷,多数食品的硬度值出现在最大变形处。
弹性:压缩至目标形变量后,样品可恢复的程度。
1.2.4失水率的测定将样品切成5 mm的薄片并称重(M1),然后下面放3张滤纸,上面放2张滤纸,用5 kg的重物压制保持2 min,去掉滤纸,再次称重(M2)。失水率计算公式如下:失水率(%)=(M1-M2)/M1×100[10]
1.2.5SDS-PAGE电泳肉糜样品处理参考Benjakul等[11]的方法,取3 g肉糜与5%的SDS以1∶9(w/v)的比例混合,采用高速均质机均质,再于85℃的水浴中保温1 h来溶解样品中的蛋白质,随后在8000 r/mim离心15 min,取上清液,用Lowry法[12]测定上清液中蛋白质的浓度。取0.8 mL上清液与5X的凝胶上样缓冲液以4∶1的比例混合,煮沸10 min,放置于4℃冰箱中备用。电泳采用5%浓缩胶,10%分离胶,初始电压80 V,当样品进入分离胶后,将电压增大至120 V,当溴酚蓝到达分离胶底部上方约1 cm处,关闭电源,取出凝胶,用考马斯亮蓝R-250染色。
1.2.6数据处理应用JMP 10.0软件对实验结果进行统计分析,结果以平均值表示。组间分析采用t-检验,p<0.05为显著,p>0.05为不显著。
2 结果与分析
2.1几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶性能的影响
几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶硬度和弹性的影响如图1和图2所示,从图中可以看出,EDTA对鸢乌贼鱼糜凝胶硬度和弹性的影响并不明显,PPi、BP、PP对鸢乌贼鱼糜凝胶硬度和弹性的影响较大。EDTA具有金属螯合作用,在抑制鱿鱼肌肉蛋白的降解过程中显示出明显的抑制效果[13],本实验中,EDTA对鸢乌贼鱼糜的凝胶性能影响不显著的原因可能是由于采用1%碳酸氢钠溶液漂洗能除去一部分的蛋白酶,其次本实验采用的凝胶化条件是35℃水浴1 h,避开了肌肉体内金属蛋白酶的最适温度40℃。添加0.3%的PPi对凝胶硬度和弹性有显著影响(p<0.05),Konno等[8]指出PPi能抑制鱿鱼在加工过程中肌肉的自溶,其次,PPi能促进肌动蛋白和肌球蛋白的交联,从而提高鱼糜凝胶性能。BP对鸢乌贼鱼糜凝胶性能的影响极其明显,且一定范围内BP的添加量越多,鱼糜的凝胶硬度和弹性越好,当添加3%的BP,鱼糜的硬度和弹性分别是对照组的3.3、1.3倍。BP中含有的α2-巨球蛋白能够有效地抑制蛋白水解作用[14],而且其作为蛋白酶抑制剂被证明能最有效地增加鱼糜的凝胶特性。BP中存在内源性TGase,能够促进凝胶的形成,此外,作为一种蛋白提取物,其本身就具备凝胶功能[6]。添加3%的PP能显著提高的鸢乌贼鱼糜的凝胶硬度(p<0.05),2%的PP就能较大提高凝胶弹性,且添加量为4%时,鱼糜的弹性最好。Weerasinghe等[15]在PP中检测到许多的丝氨酸蛋白酶抑制剂,而且PP在加热时,能够吸水溶胀形成凝胶,淀粉凝胶填充于蛋白质凝胶的网络结构中,使得鱼糜凝胶的网络结构更加致密,故改善了鱼糜凝胶的品质。同时添加250 mg/kg的EDTA、0.3%的PPi、3%的BP、3%的PP,鸢乌贼鱼糜的凝胶硬度、弹性都达到最大。这可能是几种添加物产生了协同作用,共同促进鱼糜凝胶硬度的增加。

图1 几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶硬度的影响Fig.1 Effect of some protease inhibitors on the gel hardness of Ryukyu squid surimi in South China Sea
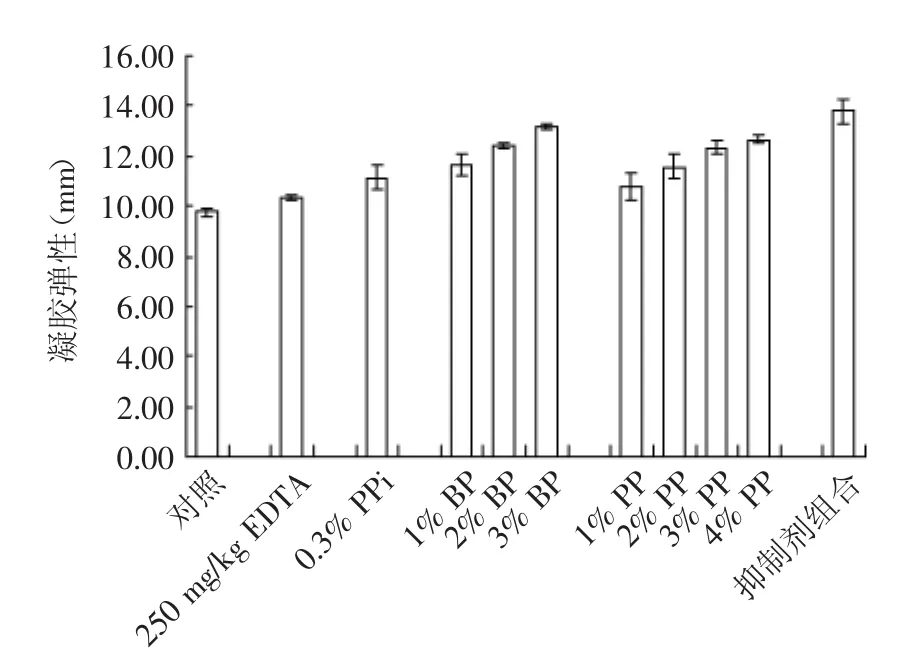
图2 几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶弹性的影响Fig.2 Effect of some protease inhibitors on the gel springiness of Ryukyu squid surimi in South China Sea
2.2几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶失水率的影响
持水性用于表征鱼糜蛋白质结合水的能力,对鱼糜凝胶制品加工特性、产量以及成本起着重要作用。凝胶失水率是鱼糜制品持水性的衡量指标,失水率越低,凝胶持水性能越好,同时鱼糜凝胶的持水能力与其凝胶特性是一致的,形成的凝胶越均匀致密则其失水率越低[16]。如图3所示,EDTA对鸢乌贼鱼糜凝胶失水率无显著影响,PPi、BP、PP以及同时添加几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶失水率影响显著(p<0.05)。分别添加0.3%的PPi、1%~3%的BP、2%~4%的PP以及同时添加几种蛋白酶抑制剂都能显著降低凝胶的失水率(p<0.05),提高鱼糜的持水性。此趋势现象和图1、图2中的凝胶硬度和弹性的变化基本上相对应,PPi、BP、PP以及同时添加几种蛋白酶抑制剂能提高鸢乌贼鱼糜的凝胶性,使形成的凝胶均匀致密,凝胶失水率也随之降低。
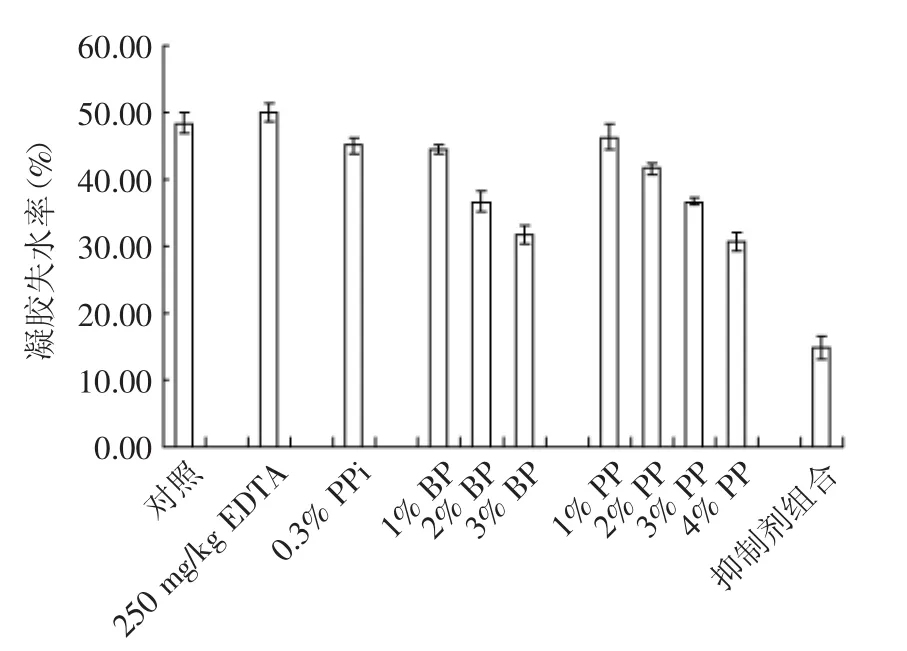
图3 几种蛋白酶抑制剂对鸢乌贼鱼糜失水率的影响Fig.3 Effect of some protease inhibitors on the water loss rate of Ryukyu squid surimi in South China Sea
2.3同时添加TGase和几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶性能的影响
如图4所示,单独添加2%的TGase和同时添加250 mg/kg的EDTA、0.3%的PPi、3%的BP、3%的PP都能较大地提高鸢乌贼鱼糜的凝胶硬度和弹性。当同时添加几种蛋白酶抑制剂和2%的TGase时,鱼糜的凝胶硬度达到最大,凝胶弹性较只添加2%的TGase显著增加(p<0.05),和只同时添加几种蛋白酶抑制剂相比无明显变化。研究表明蛋白酶抑制剂和TGase联合作用可以显著提高低凝胶形成能力鱼种的凝胶性能,Pérez-Mateos等[17]通过向冷冻鱿鱼肉糜中同时添加MTGase和蛋白酶抑制剂来研究其凝胶性能,发现鱿鱼肌肉凝胶的弹性和硬度显著提高,并且在折叠实验中获得满分。

图4 TGase和几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶性能的影响Fig.4 Effect of TGase and some protease inhibitors on the gel properties of Ryukyu squid surimi in South China Sea
2.4几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶SDSPAGE图谱的影响
从图5中能够发现,35℃水浴1 h的凝胶条件使得各处理条件下鸢乌贼肌肉蛋白的肌球蛋白重链(MHC)基本上降解完全,在此电泳图上不能清晰地看出各种添加剂分别作用对蛋白酶降解MHC的抑制效果。添加3%的BP的电泳条带中副肌球蛋白(PM)和肌动蛋白(Actin)发生了明显的减少,说明在BP的作用下其参与了凝胶的形成。其余几组的PM、Actin无明显差异。从电泳图中能够发现同时加入几种蛋白酶抑制剂的蛋白电泳条带的MHC、PM、Actin相比于对照组以及各单独的蛋白酶抑制剂组降解极为显著,这进一步说明几种蛋白酶抑制剂产生了协同作用,促进了鸢乌贼鱼糜凝胶的发生,增强了鱼糜的凝胶硬度和弹性。泳道4和6中,分子量在63 ku附近处有明显的蛋白条带,推测可能一部分是牛血清蛋白,另一部分是鸢乌贼肌肉的PM和MHC的降解产物。对比泳道4,泳道6中分子量在63 ku处的蛋白也发生了降解,这说明在各种蛋白酶抑制剂协同作用的情况下,蛋白降解产物进一步发生了反应,参与了蛋白凝胶的形成。
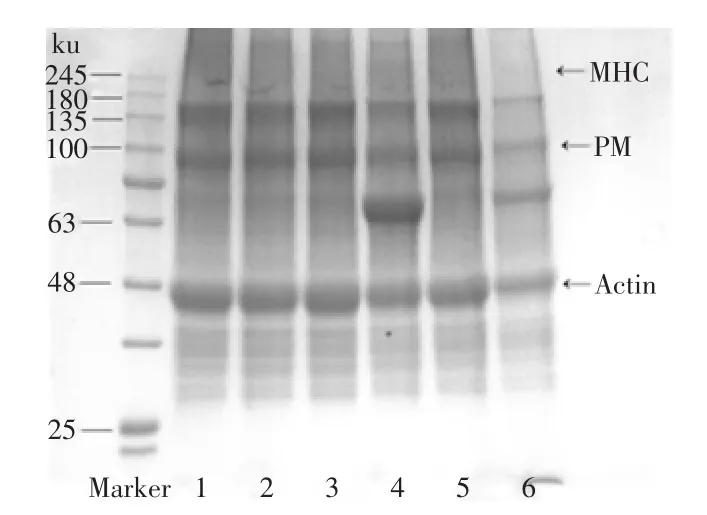
图5 几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶SDS-PAGE图谱的影响Fig.5 Effect of some protease inhibitors on the SDS-PAGE of Ryukyu squid surimi in South China Sea
2.5同时添加TGase和几种蛋白酶抑制剂对鸢乌贼鱼糜凝胶SDS-PAGE图谱的影响
图6中,泳道2的浓缩胶上方有一定量的大分子物质存在,这是因为TGase可以催化肌球蛋白重链上谷氨酸的γ-羟酰胺基和赖氨酸的ε-氨基形成共价键,在分子内或分子间产生大量的共价交联,促进蛋白凝胶。但是条带中Actin并未发生改变,这说明Actin并未参与TGase的交联反应,贾丹等[18]在其研究中也发现了这一现象。而几种蛋白酶抑制剂同时作用可以对Actin产生较大的作用,使其参与蛋白凝胶。单独添加蛋白酶抑制剂和TGase都能促进鱼糜凝胶性能的增强,且二者联合作用,可以更为显著地促进蛋白的凝胶作用,提高鸢乌贼鱼糜的凝胶性能。PM是无脊椎动物所特有的蛋白,从图6中能够发现,对比对照组其余各蛋白条带中PM都发生了降解,结合图4可以发现PM的降解越显著,对应的凝胶性能越好,这说明PM参与了鸢乌贼鱼糜凝胶的形成过程。徐辉[19]在对秘鲁鱿鱼凝胶特性的研究中也发现,PM的条带强度随着TGase浓度的增加逐渐减弱,推断PM参与了凝胶的形成。
3 结论
PPi、BP、PP都能显著提高鸢乌贼鱼糜的凝胶性能,EDTA在本实验中对鱼糜凝胶性能的影响并不显著,当同时添加2%的TGase、250 mg/kg的EDTA、0.3%的PPi、3%的BP、3%的PP,鸢乌贼鱼糜的凝胶硬度、弹性达到最大。通过对鸢乌贼鱼糜凝胶的SDS-PAGE图谱的研究表明,几种蛋白酶抑制剂同时添加能产生协同作用,促进了鸢乌贼鱼糜凝胶的发生;TGase单独作用不能和Actin发生交联反应,和蛋白酶抑制剂同时作用能更为显著地促进蛋白的凝胶作用,提高鸢乌贼鱼糜的凝胶性能。PM也参与了鸢乌贼鱼糜凝胶的形成过程。
[1]晏磊,张鹏,杨吝,等.月相对南海灯光罩网鸢乌贼渔获率的影响分析[J].南方水产科学,2015,11(3):16-21.
[2]张鹏,曾晓光,杨吝,等.南海区大型灯光罩网渔场渔期和渔获组成分析[J].南方水产科学,2013,9(3):74-79.
[3]于刚,张洪杰,杨少玲,等.南海鸢乌贼营养成分分析与评价[J].食品工业科技,2014,35(18):358-361,372.
[4]郭颖,孟珺,常忠义,等.谷氨酰胺转胺酶和磷酸盐对鱿鱼鱼糜凝胶性能的影响[J].食品科学,2012(19):178-181.
[5]Gómez-Guillén M C,Montero P,Solas M T.Thermally induced aggregation of giant squid(Dosidicus gigas)mantle proteins.Physicochemical contribution of added ingredients[J]. Agricultural Food Chemistry,1998,46(9):3440-3446.
[6]Ayensa M G,Montero M P,Borderı'as A J,et al.Influence of some protease inhibitors on gelation of squid muscle[J].Journal of Food Science,2002,67(5):1636-1641.
[7]Ayensa M G,An H,Gomez-Guillen,et al.Partial protease activity characterization of squid(Todaropsis eblanae)mantle[J]. Food Science and Technology International,1999,5(5):391-396.
[8]Konno K,Fukazawa C.Autolysis of squid mantle muscle protein as affected by storage conditions and inhibitors[J].Journal of Food Science,1993,58(6):1198-1202.
[9]杨芳.阿根廷鱿鱼肌原纤维蛋白特性及其加工的研究[D].福建:集美大学,2009.
[10]袁莉莉,刘书成,解万翠,等.虾肉和鱼肉混合鱼糜凝胶特性的研究[J].食品工业科技,2013(12):246-250.
[11]BenjakulS,VisessanguanW,PecharatS.Suwarigel properties as affected by transglutaminase activor and inhibitors[J].Food Chemistry,2004a,85(1):91-99.
[12]Lowry O H,Rosebrough N J,Farr A L,et al.Protein measurement with the folin phenol reagent[J].Journal of Biological Chemistry,1951,193:265-275.
[13]Okamoto Y,Otsuka-Fuchino H,Horiuchi S,et al.Purification and characterization of two metalloproteinases from squid mantle muscle,myosinase I and myosinase II[J].Biochimica et Biophysica Acta(BBA)-Protein Structure and Molecular Enzymology,1993,1161(1):97-104.
[14]Barrett A J,Starkey P M.The interaction of a2-macroglobulin with proteinases[J].Journal of Biochemistry,1973,133(4):709-724.
[15]Weerasinghe V C,Morrisey M T,An H.Characterization of active components in food grade proteinase inhibitors for surimi manufacture[J].Journal of Agricultural Food Chemistry,1996,44(9):2584-2590.
[16]Salvador P,Toldrá M,Saguer E,et al.Microstructurefunction relationships of heat-induced gels of porcine hemoglobin[J]. Food Hydrocolloids,2009,23(7):1654-1659.
[17]Pérez-Mateos M,Montero M,Gómez-Guillén M C.Addition of microbial transglutaminase and protease inhibitors to improve gel properties of frozen squid muscle[J].European Food Research and Technology,2002,214:377-381.
[18]贾丹,刘茹,刘明菲,等.转谷氨酰胺酶对鳙鱼鱼糜热诱导胶凝特性的影响[J].食品科学,2013,34(9):37-41.
[19]徐辉.谷氨酰胺转氨酶对秘鲁鱿鱼肌原纤维蛋白凝胶特性的影响[D].杭州:浙江工商大学,2007.
Influence of some protease inhibitors on gel properties of Ryukyu squid surimi
YANG Xian-qing1,MA Jing-rong1,2,MA Hai-xia1,LI Lai-hao1,CHEN Sheng-jun1
(1.Key Lab of Aquatic Product processing,Ministry of Agruculture,National R&D Center for Aquatic Product Processing,South China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Guangzhou 510300,China;2.Guangdong Ocean University,Zhanjiang 524088,China)
The effect of 4 food-grade protease inhibitors[ethylenediaminetetraacetic acid(EDTA),sodium pyrophosphate(PPi),bovine plasma(BP)and potato power(PP)]on the gel hardness,springiness and water loss rate of Ryukyu squid surimi in South China Sea was studied.The SDS-PAGE was used to analyze the relevant mechanisms.The results showed that the PPi,BP,PP could enhance the gel properties of Ryukyu squid surimi,maximum hardness and springiness were obtained by adding 2%TGase,250 mg/kg EDTA,0.3% PPi,3%BP and 3%PP.SDS-PAGE indicated that the 4 food-grade protease inhibitors combine with TGase could promote the gel formation of Ryukyu squid surimi.TGase couldn’t form covalent cross-linking with Actin. The PM was involved in the the gel formation of Ryukyu squid surimi in South China Sea was studied.
Ryukyu squid surimi;protease inhibitors;TGase;gel properties
TS254.1
A
1002-0306(2015)20-0107-05
10.13386/j.issn1002-0306.2015.20.013
2015-01-22
杨贤庆(1963-),男,本科,研究员,主要从事水产品加工、质量安全、标准化方面的研究,E-mail:yxqgd@163.com。
工信部高技术船舶科研项目(DC132101);农业部财政重大专项(NFZX2013)。

