植物中天然香豆素类化合物的提取纯化技术研究进展
龚 蕾,刘雁雨,焦必宁,3,4,*,张思远,张娇娇(1.西南大学柑桔研究所,农业部柑桔产品质量安全风险评估实验室,重庆400712;2.农业部柑桔及苗木质量监督检验测试中心,重庆400712;3.国家柑桔工程技术研究中心,重庆400712;4.柑桔学重庆市重点实验室,重庆400712)
植物中天然香豆素类化合物的提取纯化技术研究进展
龚蕾1,2,刘雁雨1,2,焦必宁1,2,3,4,*,张思远1,2,张娇娇1,2
(1.西南大学柑桔研究所,农业部柑桔产品质量安全风险评估实验室,重庆400712;2.农业部柑桔及苗木质量监督检验测试中心,重庆400712;3.国家柑桔工程技术研究中心,重庆400712;4.柑桔学重庆市重点实验室,重庆400712)
香豆素类化合物广泛分布在植物界中,具有抗肿瘤、抑菌、抗病毒、抗氧化等生物活性。近年来,国内外有关植物中天然香豆素的研究十分活跃,并取得显著进展。本文就植物中天然香豆素的种类与分布、提取方法、分离纯化方法的研究进行综述,旨在为我国天然香豆素类化合物的开发利用提供参考,推动香豆素产业发展。
香豆素,分布,提取,纯化
1820年,Vogel从圭亚那零陵香豆(黄香草木犀)中获得第一种香豆素。从此,香豆素类化合物引起了研究者们极大的兴趣,多种香豆素相继被发现。香豆素是由顺式邻羟基桂皮酸脱水而形成的内酯[1](图1),具有抗肿瘤、抗病毒、抗氧化、抗微生物、抗凝血等生物活性[2]。随着现代分离提取技术的快速发展,香豆素类物质在染料、荧光探针及杀虫剂等方面[3-5]也有广泛应用。
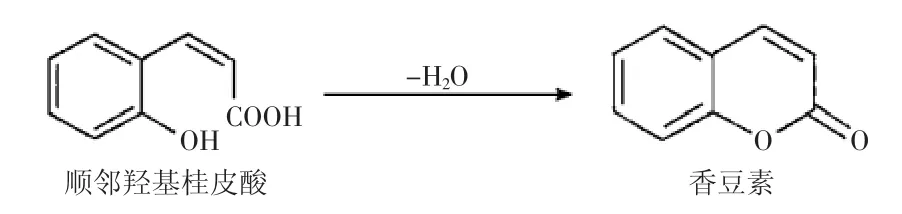
图1 香豆素的基本结构Fig.1 The basic structure of coumarin
目前,国内外对香豆素类化合物的研究主要集中在香豆素类化合物的分离鉴定与提纯、药理作用以及人工合成方法的改进等方面[6]。尽管我国拥有十分丰富的植物资源,但由于这方面的研究起步较晚,对植物中香豆素类化合物资源的鉴定和影响香豆素形成的生理生态条件的研究尚不系统、深入,香豆素提取和分离纯化技术体系尚不成熟,尚未大规模开发利用。所以,想要最大限度地加以利用,仍需研究者们的不懈努力。然而,不同植物中含有的香豆素种类不尽相同,其理化特性也有所差异,应采取不同的工艺对其进行提取纯化,制备高纯度的香豆素类化合物。本文就植物中天然香豆素的种类与分布、提取方法、分离纯化方法的研究进行综述。
1 香豆素的种类与分布
香豆素类化合物是一类具有苯并α-吡喃酮母核的天然产物的总称。根据其基本母核上取代基的不同,香豆素通常分成4类:简单香豆素类(如瑞香内酯、蛇床子素等)、呋喃香豆素类(如花椒毒酚、紫花前胡内酯等)、吡喃香豆素类(如紫花前胡素、白花前胡丙素等)及其他香豆素类(如胀果香豆素甲、拟雌内酯等)[1]。周汉荣等[7]统计,香豆素主要分布在70多科300多属植物中,集中分布于芸香科、伞形科、瑞香科、菊科、豆科、茄科、兰科、虎耳草科和木犀科等植物的各个部位。具体情况如表1所示。
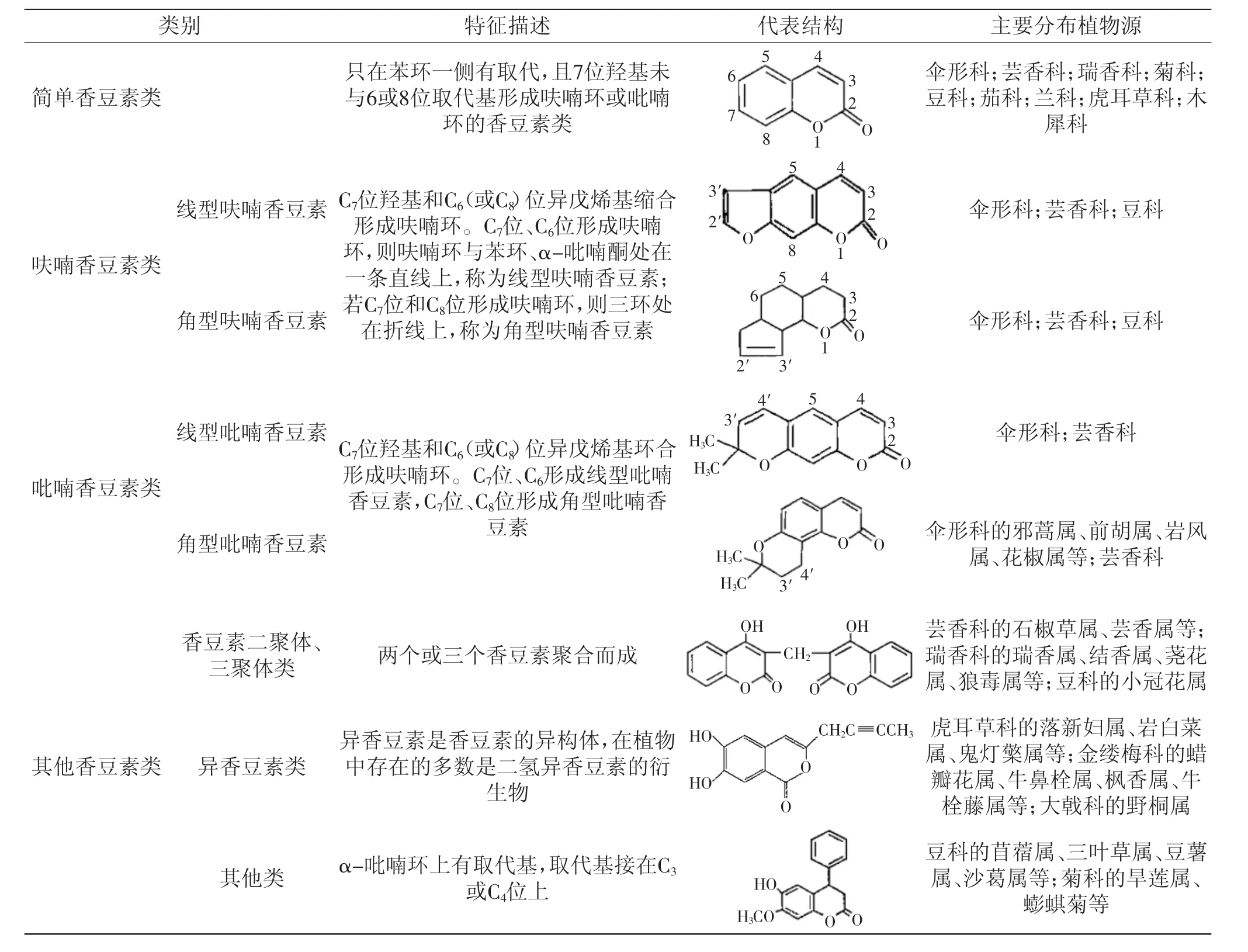
表1 香豆素的种类与主要分布植物源Fig.1 The species of coumarin and its ditribution
植物中香豆素类化合物的含量受品种、组织部位、成熟度、产地等因素的影响。田尚衣等[8]分别测定了瑞香狼毒的根、茎、叶、花中7,8-二羟基香豆素的含量,结果表明,根、茎、叶、花中7,8-二羟基香豆素含量分别为0.37%、0.58%、1.76%和1.60%,叶中含量是根的4.7倍。Laura Mercolini等[2]检测葡萄柚中的橙皮油素和伞形花内酯发现,白色葡萄柚品种普遍比粉红葡萄柚的含量高,其橙皮油素高出近10倍;而这两种葡萄柚囊衣中的香豆素含量明显高于外果皮和中果皮。侯雪英等[9]报道了肉桂不同部位中香豆素的含量分布,桂丁中含量最高,为3617.74 μg/g,其次是桂花和桂枝,最少的是桂碎。
不同品种以及同品种不同产地的植物中,其香豆素类化合物的含量也有显著差异。Min Kyung Kim等[10]检测来自不同产地防风中的补骨脂素、佛手苷内酯、欧前胡素等五种香豆素类化合物,发现韩国的防风只含有极少量的佛手苷内酯或欧前胡素,而中国的防风含有大多数香豆素类化合物;比较来自中国不同省份的防风中香豆素类化合物的含量,以内蒙古产防风中最丰富,其总量达到了0.099 μg/g,而甘肃产防风中仅含0.001 μg/g的补骨脂素。Laura Mercolini等[2]分析意大利产酸橙、葡萄柚、来檬、巴甘檬、甜橙、红桔、柠檬、枳和金柑中的橙皮油素和伞形花内酯含量发现,枳中橙皮油素含量明显高于其他种类,而来自卡塔尼亚的枳中橙皮油素含量又比其他产地高2~4倍。
在植物不同的生长期,香豆素类化合物的含量和种类也会发生变化。韦献果[6]研究了代代酸橙果实不同发育期中的香豆素类组分的动态变化,成熟果实检出8种,花期子房和幼果检出7种,而膨大期果实仅含3种,并且香豆素总含量显著下降,虽然成熟期香豆素总量又有所上升,但仍然很低。俞年军等[11]研究了前胡根中香豆素含量的动态变化,在营养生长前期(5~9月),白花前胡D素、E素的含量比生长后期(10~12月)高2~3倍,白花前胡甲素的含量在营养生长期变化不大,营养生长后期,其含量基本稳定,而生殖生长时期迅速下降。
2 香豆素的提取方法
2.1传统溶剂提取法
溶剂提取法是从植物中提取包括香豆素类等天然产物最常用的方法,主要包括煎煮、浸渍、渗漉、回流和连续提取[12]。水煎煮法是我国最早使用的传统方法,可煎出大部分活性成分,但挥发性及热不稳定性成分提取不宜用此法。浸渍法和渗漉法简单易行,常温操作,适于热不稳定成分的提取;用易挥发的乙醇或有机溶剂加热提取时,则需采用回流法;为减少回流提取溶剂用量,可采用连续提取法(即索氏提取)。Yoshiaki Miyake等[13]采用溶剂浸提法提取柠檬皮中的香豆素,使用柠檬皮1.20 kg,甲醇用量高达1.5 L,提取时间长达3 d。GUO Fang-qiu等[14]采用均匀设计法优化提取独活中香豆素的工艺条件,确定最优提取条件为:固液比1∶10、提取温度85℃、乙醇浓度95%、提取时间3.6 h,并建立了独活中香豆素的提取模型。蓝耀宏[15]采用响应面法优化白芷总香豆素的乙醇提取工艺,确定了最优提取条件,为白芷香豆素工业化提取提供借鉴。虽然这些传统方法加工成本低,但存在加热时间长、提取率低、溶剂消耗多、有机残留等缺点。因此,发展快速、高效、绿色的样品处理技术已成为研究者们的目标,一些新兴提取技术不断被开发。
2.2超临界流体萃取法
超临界流体萃取法是近三十年来迅速发展起来的新技术,具有萃取率高、无有机溶剂残留、避免活性成分损失等优点。最常用的超临界流体为CO2,其化学性质稳定、无毒、价廉且具有较低的临界压力和临界温度[16]。该法适合于多种植物基质中天然化合物的萃取,尤其是同类物质。Xiao Wang等[17]通过正交实验确定了从补骨脂中提取补骨脂素和异补骨脂素的最佳超临界条件,压力和温度分别为26 MPa、60℃,其最大提取量分别为1.100和1.344 mg/g。Pranabendu Mitra等[18]采用中心组合旋转设计法研究优化了超临界CO2(甲醇为调节剂)萃取大花菟丝子中的香豆素的工艺条件及参数,香豆素最高产量达到(90.13± 0.11)μg/g,并开发出预测香豆素得率的人工神经网络模型。A L Oliveira[19]利用超临界CO2从薇金樱子和薇茅中提取香豆素类物质,其提取得率分别为0.43%和0.00017%。CO2是非极性物质,不利于极性物质的提取,适当添加甲醇、乙醇、乙酸乙酯或丙酮等调节剂能克服该弱点。但对于紫花苜宿、金盏菊、马鞭草等植物中香豆素类物质的提取,添加调节剂不能改善提取效果[20]。因此,尽管超临界萃取技术有许多其他方法无法比拟的优点,该技术的推广还需解决如何提高极性成分的提取率和降低成本、适应工业化生产等问题。
2.3超声波辅助萃取法
超声波萃取是利用超声波产生的强烈空化效应、扰动效应、高加速度、击碎和搅拌作用等多级效应,破坏细胞壁,从而释放细胞内容物的一种方法。20世纪50年代,超声波技术首次用于实验室天然产物的提取研究[21],其优点是操作简单、低温提取、提取物活性高且提取率高[16]。Juan Su、Shan Fu、董自亮等[22-24]提取祖师麻、秦皮、白芷等中药中的香豆素类物质,通过1~2次超声提取30~70 min,其提取率能达到最高,回收率在96.2%~104.8%之间。杨春等[25]通过正交分析研究超声提取柳叶腊梅中总香豆素类化合物的最优条件发现,40 mL 80%的乙醇超声提取1 h得率最高,该工艺适于大规模生产。Petra Bajerová等[20]从16种植物中提取香豆素、类黄酮等抗氧化物质,对比超临界流体萃取、加速溶剂萃取、索氏提取、超声波提取和超声波探头提取五种方法发现,有10个品种的超声波探头提取物抗氧化能力最大,这说明超声波提取能有效保护香豆素等活性成分。超声波提取法设备简单,具有较好应用前景,且已成熟用于实验室。然而,工业上的应用比较滞后,进行工程放大是今后要解决的主要问题。
2.4微波辅助萃取法
1986年,Ganzler[26]首先报道了微波用于天然产物的提取。微波辅助萃取具有快速、加热均匀、选择性好、环保、同时多操作等优点,因此该法迅速发展。新发展的动态微波萃取,使用时可随时引入新鲜溶剂,导出的萃取液与分析仪器亦能在线联用,萃取效率和自动化程度都得以提高[27]。Heyuan Qiu[28]利用微波法提取飞龙掌血中的香豆素,50℃下甲醇提取仅1 min就分别得到茴芹灵、茴芹苦素和珊瑚菜内酯0.85、2.55、0.95 mg/g,其纯度分别达到了95.0%、99.1%和96.4%。董自亮等[29]研究微波提取白芷中总香豆素的工艺,对比传统提取法,微波提取法所用时间只有传统提取法的一半,总香豆素提取率约提高1.14%。Emanuela Martino等[30]比较了利用索氏提取、超声波和微波法从草木樨中提取香豆素的效果,研究表明索氏提取法提取量最少,超声波法虽然提取率不低,但耗时近60 min,而微波法在获得同样提取率时仅用时10 min,且回收率达到了91%。然而,微波辐射对人体有害,且高温不适用于热敏性成分。有研究表明[31],当微波温度达到175℃时,东莨菪素降解9.5%,秦皮乙素高达57%。只有克服以上缺点,微波辅助萃取法才能得到更广泛的应用。
2.5加速溶剂萃取法
加速溶剂萃取法是近年新发展起来的提取技术。Arwa Mustafa[32]认为从草本植物中提取功能成分,加速溶剂萃取无疑是一种“绿色”的技术,高温(室温~200℃)高压(35~200 bar)有利于功能成分在溶剂中的溶解以及高速能够减少降解。与常规方法相比,该法的溶剂用量和提取时间大大减少。M Vierikova等[33]报道采用加速溶剂萃取法从食品样品中提取香豆素类物质,10.34 MPa、100℃下二氯甲烷提取5 min即可,该法满足2002/657/EC[34]决策所有标准,适于常规分析。Jun Chu[35]采用加速溶剂萃取法从佛手中提取香豆素类物质,仅5 min就得到异莨菪亭、莨菪亭等6种香豆素类物质,回收率均在95.1%~104.9%之间。Fangyuan Gao[36]在吴芳等[37]的基础上提取蛇床子中的活性物质,实验采用同样的提取溶剂(95%的乙醇)和同样的料液比(1∶20),传统溶剂提取法在60℃耗费2 h才得到香豆素23.02 mg/g;而加速溶剂萃取法在122℃下仅需5 min就得到香豆素27.02 mg/g。加速溶剂萃取法已应用于食品、药物分析等领域,具有良好的发展前景。
2.6其他萃取法
分散液液微萃取法(DLLME)具有快速(浓缩净化时间低于5 min)、灵敏、富集倍数高等特点,对少量或微量有害成分的分析具有重要意义。张彦杰等[38]首次采用DLLME测定白芷及其元胡止痛片中香豆素的含量,实验表明补骨脂素、氧化前胡素浓缩倍数为12.6~38.5倍,回收率达到97.5%~114.8%。中空纤维液相微萃取法(HFLPME)可同时完成目标物的筛选和净化。Jun Zhou[39]自行设计HFLPME成功提取已口服蛇床子素的大鼠血浆中的蛇床子素。李利华等[40]将此法改进成中空纤维脂质体微筛选(HFLMS)技术,成功对中药蛇床子、补骨脂、羌活及独活提取液中的香豆素类和木脂素类成分进行了筛选和捕获。此外,有研究表明,非离子表面活性剂TritonX-114/(NH4)2SO4双水相体系[41]萃取蛇床子中蛇床子素效果非常好;分子印迹技术[42]能有效分离和纯化香豆素。
当然,提取植物中的香豆素类化合物要受到杂质、温度等多种因素的影响,一种萃取方法有局限性,而多种方法联用则能取长补短,更高效的提取目标物质,这将是未来提取天然活性物质的一个趋势。Zaixiang Lou[43]第一次使用超声波-微波萃取技术(UMAE)来提取牛蒡叶中的酚类物质,发现该法提取时间大大减少,萃取效率大大提高。后来,该团队进一步研究离子液体-超声波-微波辅助联用萃取法,结果此法比UMAE提取率更高,而与传统的加热回流萃取相比,提取率高出8%~17%,时间从5 h缩短到30 s[44]。Longhu Wang[45]首次报道采用超临界流体萃取、溶剂萃取、超声波萃取和超临界流体-液液萃取四种方法提取白芷中的香豆素,实验表明超临界流体-液液萃取法的选择性和分离效率最高,香豆素浓度从0.144%远远提高到41.68%。Zuofu Wei[46]提取木豆叶中的活性物质,初次对比离子液体分别与微波提取、加热提取和超声波提取联用提取法发现,离子液体-微波辅助萃取能够在25 min内完成,提取效率提高了11.0%~38.9%。
3 香豆素的纯化方法
3.1柱层析法
柱层析法又称柱色谱法,主要原理是根据提取物中各组分在固定相和流动相中分配系数不同,经多次反复分配将组分分开。层析柱使用的填充剂主要有聚酯酰胺、葡萄糖凝胶、硅胶等。Oasis®MCX固相萃取柱属于混合型阳离子交换柱,该设计克服了传统硅胶基质混合型固相萃取吸附剂的局限性[47]。Bond Elut C18是Bond Elut系列中疏水性最强的键合硅胶吸附剂,因为它能保留水相基质中的大部分有机物,可用于离子交换之前去除水相基质中的盐分[48]。Tingting Wang等[49]报道用ODS柱色谱纯化白芷乙醇初提物,佛手内酯、欧前胡素等的纯度均超过99%。Cla'udia A.L.Cardoso等[50]对比Sep-pak硅胶柱和Seppak C18柱纯化乳膏和润发油发现,乳膏中的同一香豆素物质如补骨脂素,通过Sep-pak C18纯化的回收率仅为78.2%,而通过Sep-pak硅胶柱纯化的回收率能达到94.9%。这说明Sep-pak硅胶柱稳定性更好、回收率更高,更适合用来检测乳霜和润发油中的呋喃香豆素成分。柱层析法处理量大、应用广泛、回收率高,但流速要求严格、耗时长且需反复层析,所以简化柱层析工艺是该法得以工业化应用的重点。
3.2薄层色谱法
薄层色谱法于20世纪50年代后期广泛使用,是一种常用的快速微量分离方法,适合分离同一类化合物。当人们认识到色谱的分离效率随颗粒的减小而增加时,随后又发展了高效薄层色谱法、棒状薄层色谱法和旋转薄层色谱法[51]。该法分离香豆素类物质使用的展开剂主要是水、甲醇、氯仿、乙酸、丙酮、甲苯、石油醚、乙酸乙酯等的混配溶液[52]。Małgorzata Kozyra等[53]用薄层色谱纯化前胡提取物,分别选用正庚烷-二氯甲烷-乙酸乙酯(40∶50∶10,V/V/V)、正庚烷-二氯甲烷-乙酸乙酯(30∶40∶30,V/V/V)及正庚烷-二异丙醚-异丙醇(80∶20∶12.5,V/V/V)三种流动相作为展开剂,成功分离出5种香豆素类化合物。Narendra A.Gajbhiye等[54]采用高效薄层色谱法分离印度桔树甲醇提取物中的香豆素类物质,木桔、茵芋、伞形花内酯、补骨脂素和欧前胡素等5种成分被检测出来,其回收率为97.99%~101.06%。薄层色谱法重现性差,一般不能准确定量分析,展开剂的选择也是经验式的,但由于操作简单,耗时短,而且薄层板的一次性使用能避免污染,所以在试样处理、同时分析多个试样等方面有它的独特优越性[51]。
3.3树脂吸附法
树脂吸附技术是20世纪60年代末发展起来的,其吸附剂是一类有机高聚物吸附树脂,具有选择性好、吸附速度快、吸附容量大、机械强度高、解析容易、再生方便等优点,因此在中药研究和生产中的应用日益广泛[55]。不同结构的树脂其吸附作用随吸附物质的结构不同而有所不同,同类吸附物质在各种树脂上的吸附容量均与其极性有关。夏建军等[56]自制含丙烯酸甲酯(MA)的吸附树脂,当MA含量达到54%时,白芷中欧前胡索和异欧前胡索的富集倍数达到200倍(以生药计)。盛华刚等[57]研究D-101大孔树脂对祖师麻香豆素的纯化富集性发现,提取液经过大孔树脂纯化后,有效成分含量大大提高,干膏率明显下降,为上柱前的48.32%。同样,D-101型大孔树脂对补骨脂药材中香豆素类物质也有较好的吸附量和解吸率。陈云红等[58]报道,提取液通过D-101型大孔树脂柱纯化,香豆素类物质的纯度(以补骨脂素和异补骨脂素计)由14.5%提高到33.7%。目前,树脂比较昂贵,操作较为复杂,评价标准和安全性问题尚存争议,主要在苷类成分纯化方面应用较广泛,该法在实际生产中的应用研究还有待深入。
3.4高速逆流色谱法
高速逆流色谱是两相溶剂体系在聚四氟乙烯管作高速行星运转时产生不对称离心力,实现物质在两相中的充分混合与分配而得以高效分离的技术[59]。它的一大特点是工作时不需要固体固定相,消除了传统色谱中由于使用载体而带来的吸附现象,因此,该技术已广泛用于生物化学、环境分析、农业和食品化学等领域,尤其是用来分离传统中药中的活性成分[60]。Huabin Li[61]以正己烷-乙酸乙酯-乙醇-水(5∶5∶6∶4,V/ V/V/V)和正己烷-乙酸乙酯-乙醇-水(5∶5∶6∶4,V/V/ V/V)为固定相,同时分离纯化蛇床子中的5种香豆素,其纯度为90.6%~98.9%,回收率为85.7%~94.2%。Renmin Liu[62]采用高速逆流色谱法分离纯化白花前胡中的香豆素类物质发现,前胡香豆精D、Pd-Ib、白花前胡素A、白花前胡素B和一种未知组分的纯度分别达到了98.6%、92.8%、99.5%、99.4%和99.8%。Zhiguo Hou等[60]报道,以石油醚-乙酸乙酯-甲醇-水(5∶5∶4∶6,V/V/V/V)为固定相同时分离纯化白花前胡中的香豆素类化合物,得到七种已知物质和两种新物质,纯度为92.8%~99.7%。
3.5分离纯化联用方法
张丽娟[63]首次将超滤技术应用于高山红景天植物原药材浸提液中有效成分红景天甙和酪醇的分离纯化,充分体现了膜分离技术的优越性。梅彦红[64]设计了超临界萃取-溶剂萃取-结晶集成技术来分离纯化白芷中的香豆素成分,最终产品中香豆素含量大于98%。Shuguo Hu等[65]利用分子印迹的强识别性,建立了从传统中药秦皮中提取秦皮乙素及其结构类似物的分子印迹聚合物(MIPs)固相萃取法,此法操作简单、溶剂消耗量小、模板和MIPs都可以回收再利用。
近年有不少高速逆流色谱与其他纯化方法联用的报道。2010年,Zhiguo Hou[66]团队针对白花前胡中检出的两种新物质,联用高速逆流色谱-制备型高效液相色谱纯化富集目标物,首次得到10.6 mg/kg雷塞匹亭和12.4 mg/kg前胡香豆精J。Guodong Xiao等[67]报道,高速逆流色谱-薄层色谱联用可有效纯化分离补骨脂中的抗氧化性物质,以正己烷-乙酸乙酯-甲醇-水(1∶1.1∶1.3∶1,V/V/V/V)为固定相,可从250 mg补骨脂果实提取物的乙酸乙酯部分中分别纯化得到补骨脂素5.91 mg、异补骨脂素6.26 mg和补骨脂次素3.19 mg,其纯度分别为99.5%、99.8%和99.4%;三种未分离的物质经过薄层色谱纯化后也得到有效分离,纯度达到91.7%~97.4%。Xueli Cao等[68]首次将硅胶柱色谱和高速逆流色谱联合起来分离茱萸和虎杖的石油醚提取物,能从近50 g石油醚萃取物中分离提纯得到56 mg花椒内酯等四种物质。
与传统溶剂提取法相比,超临界流体提取、超声波提取等方法有其独特的优势,但均存在一定缺陷,如表2:索氏回流提取费时;超临界流体提取设备昂贵;微波提取和超声波提取仅用于实验室,且微波和超声波对香豆素类物质结构和活性的影响还未深入研究;大孔树脂吸附法易受样品浓度的影响,稳定性差;高速逆流色谱法使用有机试剂繁多,有些对环境和人体健康影响较大;酶法提取果胶、类黄酮的技术已经成熟,而用于香豆素的提取却未见有报道等。

表2 提取纯化方法的优缺点比较Fig.2 Comparison of different extraction techniques
4 展望
香豆素类化合物来源丰富,它作为一种重要的生物化学物质,已在医药、农药、食品、香料以及日化工业中得到广泛应用,尤其近来天然抗HIV活性香豆素类化合物的发现为抗艾滋病药物的研究开辟了一个新的领域[69]。目前,国内外采用较多的是传统溶剂提取法、超临界流体提取法、微波提取法、超声波提取法以及柱层析法,但这些方法均有各自的不足之处。因此,为了加快我国丰富的香豆素类化合物资源开发利用,应该重点考虑以下几点:针对不同植物源,深入研究超临界流体、微波和超声波提取机理及工艺条件,建立一套完整的操作简便、安全高效、广泛适用的提取纯化体系,并研制适于工业化应用的配套装备;对各种提取纯化技术进行对比,研究不同模式下针对不同目标物的提取纯化机理,并强化研究超声波-微波萃取、超声波复频萃取、超临界流体-仿生提取、酶解-微波提取、超滤-结晶-层析纯化等组合技术的工艺条件及技术参数,促进工业化应用;加强香豆素类化合物活性机理研究,并研发可应用于食品和医药方面的新产品。总之,随着研究的深入,天然香豆素类化合物的提取纯化技术将更加工业化、自动化、通用化和绿色化。
[1]孔令义.香豆素化学[M].北京:化学工业出版社,2008,33:900-902.
[2]Mercolini L,Mandrioli R,Ferranti A,et al.Quantitative Evaluation of Auraptene and Umbelliferone,Chemopreventive Coumarins in Citrus Fruits,by HPLC-UV-FL-MS[J].Journal of Agricultural and Food Chemistry,2013,61(8):1694-1701.
[3]Liu X,Cole J M,Waddell P G,et al.Molecular Origins of Optoelectronic Properties in Coumarin Dyes:Toward Designer Solar Cell and Laser Applications[J].Journal of Physical Chemistry A,2012,116(1):727-737.
[4]Wagner B D.The Use of Coumarins as Environmentally-Sensitive Fluorescent Probes of Heterogeneous Inclusion Systems[J].Molecules,2009,14(1):210-237.
[5]连晓雪,刘秀琳,李酽,等.利用超声法制备γ-Al2O3/7-羟基香豆素纳米复合发光材料[J].化学世界,2011(11):651-653.[6]韦献果.柑橘及其近缘属植物天然香豆素研究[D].重庆:西南大学,2012.
[7]段金廒,周荣汉.植物化学分类学[M].上海:上海科学技术出版社,2005.
[8]田尚衣,魏春雁,周道玮,等.高效液相色谱法测定瑞香狼毒根、茎、叶、花中7,8-二羟基香豆素的含量[J].分析化学,2004(12):1627-1630.
[9]侯雪英,吴淳,周玉婷,等.肉桂不同部位中4种有效成分的含量及其分布研究[J].世界科学技术:中医药现代化,2013,15(2):254-259.
[10]Kim M K,Yang D,Jung M,et al.Simultaneous determination of chromones and coumarins in Radix Saposhnikoviae by high performance liquid chromatography with diode array and tandem mass detectors[J].Journal of Chromatography A,2011,1218(37):6319-6330.
[11]俞年军,吴文铃,刘守金,等.前胡根的干物质积累与香豆素类成分含量动态研究[J].中国中药杂志,2013(10):1489-1492.
[12]李爱红,刘长占.天然产物中活性成分提取技术研究进展[J].承德石油高等专科学校学报,2003,5(4):29-33.
[13]Miyake Y,Murakami A,Sugiyama Y,et al.Identification of Coumarins from Lemon Fruit[J].Journal of Agricultural and Food Chemistry,1999,47(8):3151-3157.
[14]Fangqiu G,Lanfang H,Huofei Z,et al.Extraction optimization of coumarins from radix angelicae pubescentis by HPLC-DAD coupled with uniform design[J].Journal of Central South University of Technology,2006,13(2):156-159.
[15]蓝耀宏.响应面优化白芷总香豆素提取工艺的研究[J].化工技术与开发,2014(2):20-24.
[16]Khoddami A,Wilkes M,Roberts T.Techniques for Analysis of Plant Phenolic Compounds[J].Molecules,2013,18(3):2328-2375.
[17]Wang X,Wang Y,Yuan J,et al.An efficient new method forextraction,separationandpurificationofpsoralenand isopsoralenfromFructusPsoraleaebysupercriticalfluid extraction and high-speed counter-current chromatography[J]. Journal of Chromatography A,2004,1055(1-2):135-140.
[18]Mitra P,Barman P C,Chang K S.Coumarin extraction from cuscuta reflexa using supercritical fluid carbon dioxide and development of an artificial neural network model to predict the Coumarin Yield[J].Food and Bioprocess Technology,2011,4(5):737-744.
[19]Oliveira A L,Pozza L N L,Santos D N,et al.Supercritical extraction of coumarin from guaco(Mikania laevigata and Mikania glomerata)for pharmaceutical applications[J].The Journal of Supercritical Fluids,2013,83:65-71.
[20]Gonçalves R,Lemos C,Leal I,et al.Comparing conventional and supercritical extraction of(-)-mammea A/BB and the antioxidantactivityofcalophyllumbrasilienseextracts[J]. Molecules,2013,18(6):6215-6229.
[21]马亚琴,叶兴乾,吴厚玖,等.超声波辅助提取植物活性成分的研究进展[J].食品科学,2010(21):459-463.
[22]Su J,Zhang C,Zhang W,et al.Qualitative and quantitative determination of the major coumarins in Zushima by high performance liquid chromatography with diode array detector and mass spectrometry[J].Journal of Chromatography A,2009,1216(11):2111-2117.
[23]Fu S,Zhang J,Li T,et al.Multi-responses extraction optimization based on response surface methodology combined with polarity switching HPLC-MS/MS for the simultaneous quantitation of 11 compounds in Cortex Fraxini:Application to four species of Cortex Fraxini and its 3 confusable species[J]. Journal of Pharmaceutical and Biomedical Analysis,2014,91:210-221.
[24]董自亮,肖丹,何健,等.星点设计-效应面法优化白芷的超声波辅助提取工艺[J].中成药,2011(6):972-975.
[25]杨春,程文亮,梅建凤,等.柳叶腊梅中总香豆素的提取工艺研究及纯化[J].浙江工业大学学报,2012,40(3):247-249.[26]黎海彬,王邕,李俊芳,等.微波辅助提取技术在天然产物提取中的应用[J].现代食品科技,2005,21(3):148-150.
[27]Ericsson M,Colmsjo A.Dynamic microwave-assisted extraction[J].Journal of Chromatography A,2000,877(1-2):141-151.
[28]Qiu H,Xiao X,Li G.Separation and purification of furanocoumarinsfromToddaliaasiatica(L.) Lam.using microwave-assisted extraction coupled with high-speed countercurrent chromatography[J].Journal of Separation Science,2012,35(7):901-906.
[29]董自亮,张小维,肖丹.微波预处理提取白芷中总香豆素的研究[J].食品与药品,2011(1):21-25.
[30]Martino E,Ramaiola I,Urbano M,et al.Microwave-assistedextraction of coumarin and related compounds from Melilotus officinalis(L.)Pallas as an alternative to Soxhlet and ultrasoundassisted extraction[J].Journal of Chromatography A,2006,1125(2):147-151.
[31]Liazid A,Palma M,Brigui J,et al.Investigation on phenolic compounds stability during microwave-assisted extraction[J]. Journal of Chromatography A,2007,1140(1-2):29-34.
[32]Mustafa A,Turner C.Pressurized liquid extraction as a green approach in food and herbal plants extraction:A review[J]. Analytica Chimica Acta,2011,703(1):8-18.
[33]Vierikova M,Germuska R,Lehotay J.Determination of coumarin in food using ultra-performance liquid chromatographyelectrospray-tandem mass spectrometry[J].Journal of Liquid Chromatography&RelatedTechnologies,2009,32(PII 9056258671):95-105.
[34]European Commission.Implementing Council Directive 96/ 23/EC concerning the performance of analytical methods and the interpretation of results[S].2002.
[35]Chu J,Li S,Yin Z,et al.Simultaneous quantification of coumarins,flavonoids and limonoids in Fructus Citri Sarcodactylis by high performance liquid chromatography coupled with diode array detector[J].Journal of Pharmaceutical and Biomedical Analysis,2012,66:170-175.
[36]Gao F,Hu Y,Ye X,et al.Optimal extraction and fingerprint analysis of Cnidii fructus by accelerated solvent extraction and high performance liquid chromatographic analysis with photodiode array and mass spectrometry detections[J].Food Chemistry,2013,141(3):1962-1971.
[37]吴芳,刘新宇,范国荣,等.蛇床子有效成分的RP-HPLC测定及其4种提取方法的比较研究[J].中国野生植物资源,2001(6):52-54.
[38]张彦杰,白小红,李利华,等.分散液液微萃取快速测定中药中4种呋喃香豆素化合物[J].分析化学,2009,37(12):1805-1809.
[39]Zhou J,Zeng P,Cheng Z H,et al.Application of hollow fiber liquid phase microextraction coupled with high-performance liquidchromatographyforthestudyoftheosthole pharmacokinetics in cerebral ischemia hypoperfusion rat plasma[J].Journal of Chromatography B,2011,879(23):2304-2310.
[40]李利华,薛雪,彭超,等.中空纤维脂质体微筛选及其用于中药中香豆素类和木脂素类可透膜成分群的筛选和捕获[J].分析化学,2013,41(3):337-343.
[41]谢玲,周军,田倩倩,等.双水相体系萃取分离-高效液相色谱法测定蛇床子中蛇床子素的研究[J].解放军药学学报,2010(4):310-314.
[42]Spevak A,Hrobonova K.Group-selective molecularly imprinted polymer as a sorbent for extraction of coumarins from medicinal plants[J].Chemicke Listy,2014,108(3):251-255.
[43]Lou Z,Wang H,Zhu S,et al.Improved extraction and identification by ultra performance liquid chromatography tandem mass spectrometry of phenolic compounds in burdock leaves[J]. Journal of Chromatography A,2010,1217(16):2441-2446.
[44]Lou Z,Wang H,Zhu S,et al.Ionic liquids based simultaneous ultrasonicandmicrowaveassistedextractionofphenolic compounds from burdock leaves[J].Analytica Chimica Acta,2012,716:28-33.
[45]Wang L,Mei Y,Wang F,et al.A novel and efficient method combining SFE and liquid-liquid extraction for separation of coumarins from Angelica dahurica[J].Separation and Purification Technology,2011,77(3):397-401.
[46]Wei Z,Zu Y,Fu Y,et al.Ionic liquids-based microwaveassistedextractionofactivecomponentsfrompigeonpea leaves for quantitative analysis[J].Separation and Purification Technology,2013,102:75-81.
[47]Kollroser M,Schober C.Determination of coumarin-type anticoagulants in human plasma by HPLC-electrospray ionization tandem mass spectrometry with an ion trap detector[J].Clin Chem,2002,48(1):84-91.
[48]Scotter M J,Roberts D P T,Rees G O.Development and single-laboratoryvalidationofanHPLCmethodforthe determinationofcoumarininfoodstuffsusinginternal standardization and solid-phase extraction cleanup[J].Analytical Methods,2011,3(2):414.
[49]Wang T,Jin H,Li Q,et al.Isolation and simultaneous determination of coumarin compounds in radix angelica dahurica[J].Chromatographia,2007,65(7-8):477-481.
[50]Cardoso C A,Vilegas W,Honda N K.Rapid determination of furanocoumarins in creams and pomades using SPE and GC[J].J Pharm Biomed Anal,2000,22(2):203-214.
[51]周同惠.薄层色谱法[J].分析实验室,1986,5(9):34-41.[52]Glowniak K,Bartnik M,Mroczek T,et al.Application of column chromatography and preparative TLC for isolation and purification of coumarins from Peucedanum tauricum Bieb.fruits[J].JPC-Journal of Planar Chromatography-Modern TLC,2002,15(2):94-100.
[53]Kozyra M,Glowniak K,Zabza A,et al.Column chromatography and preparative TLC for isolation and purification of cournarins from Peucedanum verticillare L.Koch ex DC[J].JPC-Journal of Planar Chromatography-Modern TLC,2005,18(103):224-227.
[54]Gajbhiye N A,Makasana J,Thorat T.Simultaneous determination of marmin,skimmianine,umbelliferone,psoralene,and imperatorin in the root bark of Aegle marmelos by highperformance thin-layer chromatography[J].JPC-Journal of Planar Chromatography-Modern TLC,2012,25(4):306-313.
[55]张静泽,颜艳.吸附树脂分离技术在中药研究中的应用[J].中国中药杂志,2004(7):22-24.
[56]夏建军,施荣富,王春红.吸附树脂法分离纯化白芷中香豆素的研究[J].中草药,2007(38):139-141.
[57]盛华刚,朱立俏,王远国,等.大孔树脂纯化祖师麻中香豆素类成分的工艺优选[J].中国实验方剂学杂志,2011,17(23):14-17.
[58]陈云红,姜云云,叶光明.补骨脂药材中香豆素类化合物的大孔吸附树脂纯化工艺[J].时珍国医国药,2012,23(12):3164-3165.
[59]袁黎明,傅若农,张天佑.高速逆流色谱在植物有效成分分离中的应用[J].药物分析杂志,1998,18(1):60-64.
[60]Hou Z,Xu D,Yao S,et al.An application of high-speed counter-currentchromatographycoupledwithelectrospray ionizationmassspectrometryforseparationandonline identification of coumarins from Peucedanum praeruptorum Dunn[J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences,2009,877(24):2571-2578.
[61]Li H,Chen F.Simultaneous separation and purification of five bioactive coumarins from the Chinese medicinal plantCnidium monnieri by high-speed counter-current chromatography[J]. Journal of Separation Science,2005,28(3):268-272.
[62]Liu R,Feng L,Sun A,et al.Preparative isolation and purification of coumarins from Peucedanum praeruptorum Dunn by high-speed counter-current chromatography[J].Journal of Chromatography A,2004,1057(1):89-94.
[63]张利娟.高山红景天浸提液中红景天甙和酪醇的超滤纯化研究[D].开封:河南大学,2007.
[64]梅彦红.超临界萃取—溶剂萃取—结晶集成技术分离白芷中香豆素[D].杭州:浙江大学,2012.
[65]Hu S,Li L,He X.Solid-phase extraction of esculetin from the ash bark of Chinese traditional medicine by using molecularly imprinted polymers[J].Journal of Chromatography A,2005,1062(1):31-37.
[66]Hou Z,Luo J,Wang J,et al.Separation of minor coumarins from Peucedanum praeruptorum using HSCCC and preparative HPLC guided by HPLC/MS[J].Separation andPurification Technology,2010,75(2):132-137.
[67]Xiao G,Li G,Chen L,et al.Isolation of antioxidants from Psoralea corylifolia fruits using high-speed counter-current chromatography guided by thin layer chromatography-antioxidant autographic assay[J].Journal of Chromatography A,2010,1217(34):5470-5476.
[68]Cao X,Xu J,Bai G,et al.Isolation of anti-tumor compounds from the stem bark of Zanthoxylum ailanthoides Sieb.&Zucc. by silica gel column and counter-current chromatography[J]. Journal of Chromatography B,2013,929:6-10.
[69]KostovaI.Coumarinsas-inhibitorsofHIVreverse transcriptase[J].Current Hiv Research,2006,4(3):347-363.
Research progress in extraction and purification techniques of natural coumarin compounds in plants
GONG Lei1,2,LIU Yan-yu1,2,JIAO Bi-ning1,2,3,4,*,ZHANG Si-yuan1,2,ZHANG Jiao-jiao1,2
(1.Citrus Reserch Institute,Southwest University,Laboratory of Quality&Safty Risk Assessment for Citrus Products of Ministry of Agriculture,Chongqing 400712,China;2.Quality Supervision and Testing Centre for Citrus and Seedling,Ministry of Agriculture,Chongqing 400712,China;3.National Citrus Engineering Research Center,Chongqing 400712,China;4.Chongqing Municipal Key Laboratory for Citrus,Chongqing 400712,China)
Coumarins are widely distributed in the plant kingdom,which have the wide range of biological activity,such as anticancer,antimicrobial,antivirus and antioxidant activities.Research on natural coumarins was a recently very active topic and had made remarkable progress.In this paper,the varieties and distribution,extraction,isolation and purification methods of natural coumarins were summarized with the aims of providingabasisforthedevelopmentandutilizationofnaturalcoumarins,andpromotingindustrial development.
coumarins;distribution;extraction;purification
TS201.1
A
1002-0306(2015)20-0377-08
10.13386/j.issn1002-0306.2015.20.069
2015-01-20
龚蕾(1991-),女,硕士研究生,研究方向:食品安全与质量控制,E-mail:gonglei406@163.com。
焦必宁(1964-),男,大学本科,研究员,研究方向:果蔬贮藏加工技术与质量安全,E-mail:bljiao@tom.com。
国家现代农业(柑桔)产业技术体系建设专项(CARS-27);国家农产品质量安全风险评估重大专项(GJFP2015002,GJFP2015004);“十二五”国家科技支撑计划项目(2013BAD01B04);公益性行业(农业)科研专项(201303093)。

