玉米直、支链淀粉回生对含羟基红曲红色素护色机理探讨
董世瑞,刘立增,居 阳,林旭辉,连喜军,*
(1.天津商业大学,天津市食品生物技术重点实验室,生物技术与食品科学学院,天津300134;2.天津商业大学理学院化学系,天津300134;3.天津商业大学体育卫生部,天津300134)
玉米直、支链淀粉回生对含羟基红曲红色素护色机理探讨
董世瑞1,刘立增2,居阳3,林旭辉1,连喜军1,*
(1.天津商业大学,天津市食品生物技术重点实验室,生物技术与食品科学学院,天津300134;2.天津商业大学理学院化学系,天津300134;3.天津商业大学体育卫生部,天津300134)
以测定残留红曲红色素方法研究了玉米直链淀粉、支链淀粉的回生和色素添加方式对含羟基红曲红色素护色的效果,并利用红外光谱、核磁共振和X-射线衍射分析了淀粉护色机理。结果表明,玉米直链和支链淀粉的回生对红曲红色素具有明显的护色作用,15h紫外光照可使红曲红色素的保留率由38.3%提高到70%以上。在淀粉回生的糊化、高压和老化三个阶段中,高压后添加色素所得回生淀粉护色效果最好。核磁、红外和X-射线结果表明,回生淀粉与色素在C1、C6上发生了结合;直链淀粉结合色素更多,所以护色效果更好。
回生玉米淀粉,红曲红色素,护色,机理
红曲色素在我国食用已经有上百年历史,主要分红、橙、黄三种色素,其中起呈色作用的主要是红曲红色素。红曲红色素具有对pH稳定,耐热性强,蛋白质着色性好等特点,在我国广泛用于酒、饮料、香肠、火腿等食品中[1-5]。与所有天然色素一样,红曲红色素最大的缺点是在各种光辐射条件下会发生光褪色反应[6-9]。淀粉中含有大量羟基,在回生过程羟基之间形成氢键并进一步生成回生淀粉晶体。晶体可使光线发生折射从而减少红曲红色素吸收光能,进而延长其光褪色时间。本文以测定残留红曲红色素方法研究了玉米直链淀粉、支链淀粉的回生和色素添加方式对含羟基红曲红色素护色的效果,并利用红外光谱、核共振磁和X-射线衍射分析了其护色机理。
1 材料与方法
1.1材料与仪器
玉米淀粉市售;红曲红山东中惠食品有限公司;薄层层析硅胶板GF254(20cm×20cm) 青岛海洋化工有限公司;柱层析硅胶(200~300目) 青岛海洋化工有限公司;甲醇、无水乙醇、二氯甲烷、正己烷、乙酸乙酯、四氯化碳(分析纯) 天津市风船化学试剂科技有限公司。
RE-52AA型旋转蒸发器上海亚荣生化仪器厂;Lambda25紫外分光光度计美国PerkinElmer公司;KER3100-08S型精密恒温工作台南京凯尔仪器有限公司;FES135型红外分光光度计美国Bio-Rad公司;D-500型X-射线衍射扫描仪Siemens,Madison,WI,USA。
1.2实验方法
1.2.1红曲红色素提纯称取市售红曲红色素30g装入纸包,放置于索氏提取器中。分别用200mL正己烷、乙酸乙酯、甲醇作为索氏提取溶剂,按先后顺序分别进行3次索氏提取。将正己烷和乙酸乙酯提取液弃掉,将所得甲醇提取液旋转蒸发浓缩(50℃、55r/min)、干燥(65℃)至恒重。将0.5g色素溶解于5mL甲醇中,吸取0.05mL滴于薄层色谱板(20cm×20cm),用乙醇/石油醚(3∶7)做展开剂展开10cm后,层析板转90°后用甲醇/二氯甲烷(1∶1)做展开剂继续展开10cm。使用刮刀将红色色带刮下,甲醇溶解、过滤,自然干燥得纯红曲红色素。
1.2.2玉米直链和支链淀粉的制备取10g淀粉溶于100mL蒸馏水中,90℃糊化20min,放入高压锅中120℃高压(0.1磅/cm2)30min,取出冷却后放冰箱4℃老化48h。取出老化后淀粉添加0.6mL高温淀粉酶(200000U/mL)在95℃水解20min后离心(3050×g)得到沉淀为回生淀粉。用4mol/L KOH溶解回生淀粉至饱和溶液,再用6mol/L HCl调节pH至中性。之后添加3倍体积正丁醇搅拌、离心(3050×g)后得到玉米直链淀粉。上清液中添加5倍体积无水乙醇搅拌、离心(3050×g)后得到玉米支链淀粉[10-11]。
1.2.3含红曲红色素玉米回生淀粉制备加9mg左右色素于10mL水中,使整个溶液中色素的吸光度为1.0。色素液分别在淀粉糊化前、糊化后、高压后三个阶段添加。所得含红曲红色素的回生淀粉于60℃干燥至恒重后经研磨过120目筛子。
1.2.4紫外光辐射样品将样品置于平皿中摊平后,在距离紫外灯(45W)15cm处分别照射0、3、6、9、12、15h,取样添加甲醇溶出其中色素,加水定容至10mL,测定490nm下吸光度,计算色素残留率:
色素残留率(%)=(溶出色素吸光度/1.0)×100
1.2.5红外光谱分析将5mg淀粉用研钵研成细粉,在120℃干燥箱干燥30min,与200mg KBr混合后压片,在27℃下采用Bio-Rad FES135红外分光光度计扫描[10-11]。
1.2.6核磁氢谱分析干淀粉样品用氘代水于60℃振荡下溶解至澄清,用Mercury Vx-300 MHz(Varian,USA)核磁共振仪进行分析,氢谱分析频率300.07MHz,碳谱分析频率75.45MHz,旋转角45°,豫延迟时间1s,化学位移以tetramethylsilane(TMS)的化学位移(0)为参考[10-11]。
1.2.7X-射线衍射用铜箔和镍箔包裹淀粉采用X-射线衍射仪扫描(D-500 Siemens,Madison,WI,USA)。扫描电流和电压分别为27mA和50kV。扫描衍射角(2θ)从4°到40°,步长为0.05°,间隔时间为2s。
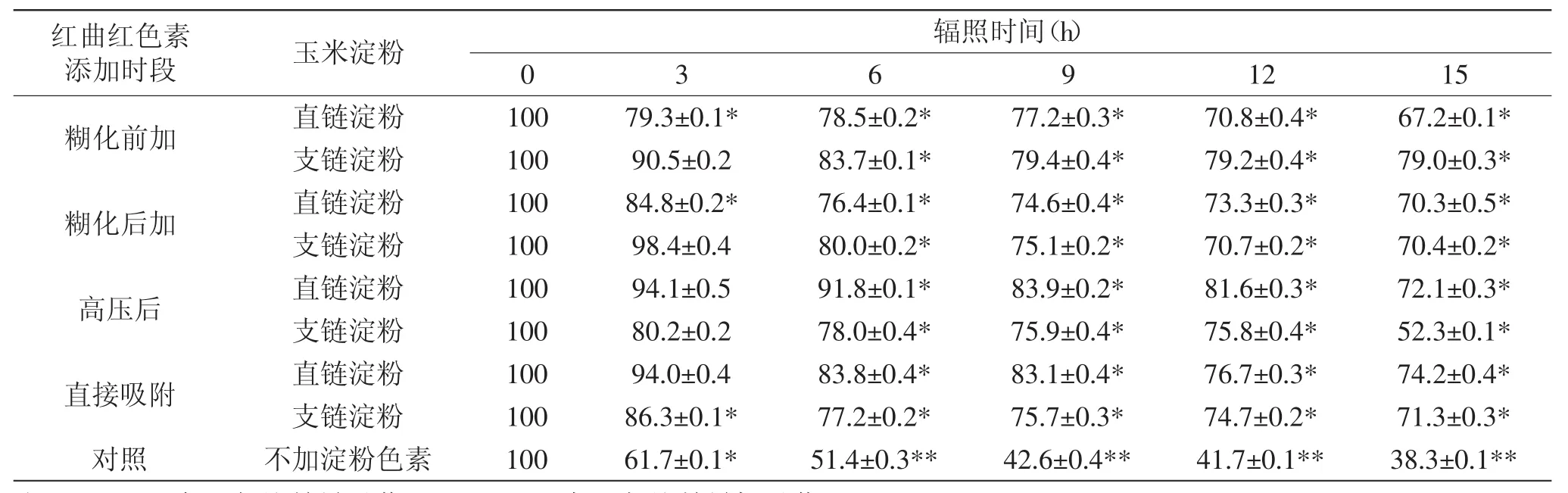
表1 不同辐照时间色素残留率(%)的变化Table 1 The variation of residual pigment(%)at different radiation time
2 结果与讨论
2.1红曲红色素添加方式对回生玉米直链、支链淀粉护色效果的影响
表1为红曲红色素以不同方式添加于玉米直、支链回生淀粉前后淀粉对色素的光护色效果。由表1可知,经15h辐照,对照组的色素残留率降低为38.3%,而其他实验组都在46%以上,最高为糊化前色素加入玉米支链淀粉中所得回生淀粉,残留率达到79.0%。辐照6h高压后添加色素组中直链淀粉组的残留率最高达到91.8%,辐照12h该组色素残留率仍能达到81.6%,显示该组具有很强的护色作用。这是因为所得直、支链淀粉均是从回生淀粉中分离出,链长分布范围较窄,链长更短,所形成的淀粉双螺旋结构更不稳定,这样有利于淀粉链游离出来与色素结合。二者结合后,当紫外光照射时,色素吸附的光能部分通过淀粉分散,从而降低了红曲红色素光降解的比率。对照组中色素主要以物理方式吸附于大豆蛋白、多肽等物质上,不能转换色素吸附的光能,因而光照后色素分解比较快。
2.2玉米直、支链淀粉与红曲红色素混合回生及紫外光辐射的红外图谱
图1为玉米直、支链淀粉与红曲红色素混合回生及紫外光辐射的红外光谱。
由图1a可知,红曲红色素在波数为3309cm-1处有明显红外吸收,此处吸收为羟基伸缩振动,说明色素结构中确实含有羟基。波数1541cm-1处吸收峰为C-N伸缩振动,可能来源于色素结合的氨基酸。当色素与淀粉混合回生时,如图1c和图1f所示,此处吸收消失。说明回生过程淀粉和氨基酸竞争色素的结合部位已将氨基酸替换。波数2930cm-1为亚甲基的C-H伸缩振动,由图1可知,红曲红色素和淀粉均有亚甲基存在,二者混合回生后该处吸收发生微小变化,说明二者之间发生了结合。
由图1b和图1e可知,玉米回生淀粉中的直链和支链淀粉再次回生时,二者的红外吸收基本没有差异,这与文献不同[12]。这主要与本次实验所用直、支链淀粉链长和分子量分布范围比较窄有关,根据文献[12],只有聚合度(DP)为10~60的淀粉才能参与回生,这次所用直、支链淀粉来自回生玉米淀粉,所以当二者分子量差异减小到一定程度,回生过程淀粉链聚合方式就会接近。当淀粉与色素混合回生时(图1c和f),所得回生淀粉红外图谱中明显具有色素的结构吸收。对比图1b、e和c、f可知,含色素回生淀粉在3340cm-1附近处的吸收由平滑变尖锐,说明色素添加使回生淀粉中氢键形成量减小[13]。这样的回生淀粉在碱液中更容易分散和溶解。图1中1618~1636cm-1处吸收峰是水的O-H弯曲振动[14-15],含色素回生淀粉中这些峰强度更大,说明色素使回生淀粉中含水量增大。这可能是色素羟基与淀粉C6形成氢键时,阻碍了淀粉其他部位羟基间形成氢键,这些羟基可以和水形成氢键,这部分水在干燥过程不会被除去。
对比图1d、g和c、f可知,紫外光辐射含色素回生直链和支链淀粉前后,淀粉的红外吸收没有发生变化。光照使淀粉在1401cm-1处的吸收增强,该处吸收是淀粉羟基相连碳原子上C-H弯曲振动,该结构中的氢原子可能是色素羟基形成氢键的一部分,当色素吸收紫外光能量增大时,氢键振动增强引起C-H弯曲振动也增强了。

图1 玉米直、支链淀粉与红曲红色素混合回生及其紫外光辐照的红外光谱Fig.1 IR spectra of retrograded maize amylose/amylopectin mixed with or without monascus red pigments and those samples radiated by ultraviolet light
2.3玉米直、支链淀粉与红曲红色素混合回生的核磁氢谱
图2为玉米直、支链淀粉与红曲红色素混合回生的核磁氢谱。由图2可知,色素的核磁氢谱化学位移范围为0.7~4.7ppm,玉米直链淀粉的为3.3~5.0ppm。其中4.70ppm处的化学位移代表水分子,色素与淀粉混合形成结合物中仍然含有水[16]。色素中含羟基碳原子上氢原子化学位移为3.4~3.7ppm,而淀粉中5.05ppm是C1和C6碳原子上的氢的化学位移,3.69、3.38、3.31ppm分别代表C2、C3、C4、C5上氢的化学位移,其中C3、C2上氢的化学位移可能重叠在一起[16-18]。色素与淀粉结合后,淀粉的核磁氢谱最大的变化是5.05ppm处的化学位移转移到4.94ppm,说明色素与淀粉可能通过C1和C6碳原子形成氢键。
2.4玉米直、支链淀粉与红曲红色素混合回生的X-射线衍射
图3为玉米直、支链淀粉与红曲红色素混合回生的X-射线衍射。由图3a可知,含羟基红曲红色素晶体衍射峰出现在2θ 27°、31°、45°、56°、66°和75°。图3b、c、d中尖锐峰2θ 28°、40°、50°、58°、66°、73°是KCl面心立方晶格的衍射峰[19],这些氯化钾是溶解玉米直、支链淀粉所用氢氧化钾和中和溶液添加盐酸反应后产生的。对比图3b和c,色素与玉米直链淀粉结合回生后,直链淀粉晶体衍射峰(衍射角为19°)衍射强度变弱,没有色素衍射峰,而氯化钾衍射峰增强,说明色素与氯化钾可能竞争玉米直链淀粉的羟基,结合色素的淀粉不容易形成淀粉回生晶体规则衍射峰。图3e中出现了色素的衍射峰,说明色素与玉米支链淀粉结合少,吸附色素在淀粉干燥过程重新结晶析出。结合红外和核磁分析,玉米直、支链淀粉与红曲红色素结合部位应该在C1、C6原子上。色素与淀粉结合后色素光褪色减慢的原因可能跟回生淀粉阻光、阻自由基产生、稳定色素结构有关。

图2 玉米直、支链淀粉与红曲红色素混合回生的核磁氢谱图Fig.2 1H NMR spectra of retrograded maize amylose mixed with or without monascus red pigments

图3 玉米直、支链淀粉与红曲红色素混合回生X射线衍射Fig.3 X-ray diffraction of retrograded maize amylose/amylopectin mixed with or without monascus red pigments
3 结论
含羟基红曲红色素可产生类似金属盐晶体的X-射线衍射。玉米直、支链淀粉在回生过程可以与含羟基的红曲红色素发生氢键结合,将色素固定在回生淀粉中,直链淀粉比支链淀粉固定色素量多。固定色素后的玉米直、支链淀粉可结合更多的水。红曲红色素与玉米直链和支链淀粉结合后,尽管淀粉没有形成规则的晶体结构,但色素与淀粉的结合对红曲红色素起到了很好的光护色作用。本文研究结果揭示回生淀粉可以被用作所有含羟基天然色素的光护色剂。
[1]李谣,周海媚,黄丹丹,等.苦荞红曲保健酒的研制[J].食品工业科技,2014,35(17):201-205.
[2]赵文红,洪泽淳,钱敏,等.红曲色素在碳酸、橙汁饮料中的应用[J].中国酿造,2014,33(4):116-119.
[3]刘国庆,宗凯,张黎利,等.红曲红色素、番茄酱对法兰克福肠发色和风味的影响[J].食品工业科技,2010,31(2):118-121.
[4]张红梅,王静,金征宇.天然红色素在肉制品中的应用[J].中国食品工业,2004(3):50-51.
[5]Laurent Dufossé,Mireille Fouillaud,Yanis Caro,et al. Filamentous fungi are large-scale producers of pigments and colorantsforthefoodindustry[J].CurrentOpinionin Biotechnology,2014,26:56-61.
[6]蒋琼凤,陈莫林,袁志辉.红曲米中红曲色素的提取及稳定性研究[J].中国调味品,2014,39(9):1-3,10.
[7]张晓伟,李培睿,王昌禄,等.温度、pH对红曲米中红曲色素溶解性及稳定性的影响[J].食品科技,2014,265(11):242-245,250.
[8]孙红男,卢义伯,赵立庆,等.三种天然色素稳定性及其护色效果的研究[J].食品工业科技,2010,31(7):308-312.
[9]Gunjan Mukherjee,Sanjay Kumar Singh.Purification and characterization of a new red pigment from Monascus purpureus in submerged fermentation[J].Process Biochemistry,2011,46(1):188-192.
[10]Lian Xijun,Zhang Kunsheng,Luo Qingfeng,et al.A possible structure of retrograded maize starch speculated by UV and IR spectra of it and its components[J].International Journal of Biological Macromolecules,2012,50(1):119-124.
[11]Lian Xijun,Wang Changjun,Zhang Kunsheng,et al.The retrogradation properties of glutinous rice and buckwheat starches as observed with FT-IR,13C NMR and DSC[J].International Journal of Biological Macromolecules,2014,64(3):288-293.
[12]MJ Gidley,D Cooke,AH Darke,et al.Molecular order and structure in enzyme-resistant retrograded starch[J].Carbohydrate Polymers,1995,28(1):23-31.
[13]Kazuo Ogawa,Isao Yamazaki,Toshiaki Yoshimura,et al. Studies on the Retrogradation and Structural Properties of Waxy Corn Starch[J].Bulletin of the Chemical Societ of Japan,1998,71(5):1095-1100.
[14]Zhou Ying,Meng Shaohua Chen,Deyi,et al.Structure characterization and hypoglycemic effects of dual modified resistant starch from indica rice starch[J].Carbohydrate Polymers,2014,103:81-86.
[15]Francesco Secundo,Nicoletta Guerrieri.ATR-FT/IR Study on the Interactions between Gliadins and Dextrin and Their Effects on Protein Secondary Structure[J].Journal of Agriculture and Food Chemistry,2005,53(5):1757-1764.
[16]R A de Graaf,G Lammers,L P B M Janssen,et al.Quantitative AnalysisofChemicallyModifiedStarchesbylH-NMR Spectroscopy[J].Starch/Starke,1995,47(12):469-475.
[17]Matti Elomaaa,Tomas Asplund,Pasi Soininen,et al. Determination of the degree of substitution of acetylated starch by hydrolysis,1H NMR and TGA/IR[J].Carbohydrate Polymers,2004,57(3):261-267.
[18]Benoît Laignel,Christophe Bliard,Georges Massiot,et al. Proton NMR spectroscopy assignment of D-glucose residues in highly acetylated starch[J].Carbohydrate Research,1996,298(4):251-260.
[19]R Saravanan,S K Mohanlal.X-ray investigations on the defect structure of KCl with Cd++impurities[J].Crystal Research and Technology,1995,30(1):55-62.
Discussion of mechanism on monascus red pigments with hydroxyls protected by retrograded maize amylose and amylopectin
DONG Shi-rui1,LIU Li-zeng2,JU Yang3,LIN Xu-hui1,LIAN Xi-jun1,*
(1.The Tianjin Key Laboratory of Food Biotechnology,Department of Biological technology and Food Science,Tianjin University of Commerce,Tianjin 300134,China;2.School of Science,Tianjin University of Commerce,Tianjin 300134,China;3.School of Sports and Health,Tianjin University of Commerce,Tianjin 300134,China)
The effect of the retrogradation of maize amylose,amylopectin and the adding method of monascus red pigment on the color protection were studied by determining the rest monascus red pigment.The protection mechanism of starch was analyzed by IR,NMR and X-ray diffraction.The results showed that the protective effects of retrogradation of maize amylose and amylopectin on the monascus red pigment were obvious and the retention percentage of monascus red pigment was raised from 38.3%to more than 70%under the 15h of the UV irradiation.In three stages of starch retrogradation such as pasting,autoclaving and retrogradation,addition of monascs red pigment after autoclaving got the best results.The results of NMR,IR and X-ray diffractions indicated that the pigment was combined with the retrograded starch at the C1 and C6 during the retrogradation and the retrogradation of amylose got the better protective effects because amylose could combine with more pigments.
retrograded maize starch;monascus red pigment;color-protection;mechanism
TS231
A
1002-0306(2015)12-0302-05
10.13386/j.issn1002-0306.2015.12.055
2014-12-03
董世瑞(1973-),男,博士,研究方向:食品科学。
连喜军(1972-),男,博士,主要从事回生淀粉方面的研究。
国家自然科学基金项目(31271935)资助。

