响应面法优化鲣鱼褐色肉酶解工艺的研究
杨龙方,桑卫国,*,段清源
(1.宁波大学海洋学院,浙江宁波315211;2.宁波市海洋与渔业研究院,浙江宁波315010)
响应面法优化鲣鱼褐色肉酶解工艺的研究
杨龙方1,桑卫国1,*,段清源2
(1.宁波大学海洋学院,浙江宁波315211;2.宁波市海洋与渔业研究院,浙江宁波315010)
研究了碱性蛋白酶酶解鲣鱼褐色肉的工艺条件。在单因素实验的基础上,以初始pH、酶添加量、酶解温度和酶解时间为考察因素,以鲣鱼褐色肉酶解产物的还原能力为响应值,对碱性蛋白酶酶解鲣鱼背褐色肉的工艺条件进行优化。结果表明,以碱性蛋白酶酶解鲣鱼褐色肉,适宜的酶解条件为:初始pH9.9、酶添加量5183U/g、酶解温度49℃、酶解时间4.75h。在该条件下酶解液的还原能力为1.4308/OD700nm,与模型预测值1.4393/OD700nm接近。利用响应面分析法得到的鲣鱼褐色肉酶解工艺参数真实可靠,为鲣鱼褐色肉的开发利用、变废为宝提供了技术支持。
鲣鱼,酶解,碱性蛋白酶,还原能力
鱼肌肉由普通肉和褐色肉构成,普通肉体积较大、分布较广,褐色肉从鱼体脊柱扩展到侧皮下位置,占肌肉体积的2%~30%(鲭鱼、鲣鱼、沙丁鱼等洄游性鱼类为15%~30%,活跃度较低的鱼类为2%~12%),为鱼类的长时间快速游动提供支持[1-2]。由于肉色暗红及易于氧化等原因,褐色肉(尤其是洄游性鱼类的褐色肉)在加工过程中常作为废弃物被丢弃[3],然而,其在营养特性、抗氧化活性等方面的潜在应用价值逐渐引起关注。与普通肉相比,褐色肉含有更多的色蛋白、肌浆蛋白、基质蛋白及铜、铁、硒等金属元素[4],并具有较高的抗氧化酶及谷胱甘肽过氧化酶活性[5]。Hsu等[6]的研究还表明,分离纯化蓝鳍金枪鱼(Thunnus Thynnus)褐色肉酶解物后得到的分子量在390~1400u的肽片段具有较强的抗MCF-7人类乳腺癌细胞扩散活性。
鲣鱼(Skipjack Tuna)是一种主要分布在热带及温带水域的暖水性上层洄游鱼类,生长繁殖快、种群修复能力强[7]。2002年鲣鱼的全球捕获量约200万吨,2007年达到250万吨(Source:FAO 2010),在所有主要贸易鲔类中产量最高。鲣鱼通常被加工成罐头、柴鱼、鱼柳或生鱼片,加工过程中会产生鱼头、鱼皮、鱼骨、内脏等下脚料。目前国内外对于鲣鱼下脚料的研究主要集中在通过提取、分离、纯化等工艺从上述下脚料中获得鱼油[8]、磷脂[9]、生物活性成分[10]等,而对于鲣鱼褐色肉的再利用却鲜有研究。还原力是检验受试物是否具有抗氧化活性的重要指标,本文以酶解液还原力为指标,对鲣鱼褐色肉酶解工艺进行响应面法优化,为进一步制备抗氧化活性肽提供理论依据,以及为鲣鱼褐色肉的变废为宝提供技术支持。
1 材料与方法
1.1材料与仪器
鲣鱼购于宁波水产市场,于-20℃条件下存放直至使用;肌肽标准品纯度99%,Sigma-Aldrich公司;蛋白酶20万U/g,广西南宁庞博生物工程有限公司;其他试剂均为分析纯。
SL-N型电子天平上海民桥精密科学仪器有限公司;XHF-D型高速分散器宁波新芝生物科技有限公司;PHS-2F pH计上海精密科学仪器有限公司;HH-4型数显恒温水浴锅国华电器有限公司;L-550型台式低速离心机湖南湘仪实验室仪器开发有限公司;UV-3300型紫外可见分光光度计上海美普达仪器有限公司。
1.2实验方法
1.2.1鲣鱼褐色肉的酶解鲣鱼于室温下解冻后将褐色肉取下并绞碎,取5.00g肉糜放入三角烧瓶中,1∶10(w/v)加入蒸馏水后匀浆,调节初始pH,加入蛋白酶混匀后于恒温振荡箱(转速150r/min)中酶解。85℃水浴20min灭酶,酶解液冷却至室温后4℃、4500r/min离心20min,收集上清液测定还原能力。
1.2.2鲣鱼褐色肉酶解产物的还原能力的测定研究表明,具还原能力的化合物在脂肪过氧化过程中可作为电子供体减少氧化反应中间体的数量,从而发挥主要或辅助的抗氧化作用[11-12]。
采用铁氰化钾法测定鲣鱼褐色肉酶解产物的还原能力[13]。标准曲线的绘制:准确配制浓度分别为0、1、10、20、50、100mmol/L的肌肽溶液。分别取上述不同浓度肌肽溶液5mL,加入0.2mmol/L磷酸盐缓冲液(pH6.6)2.50mL及1%铁氰化钾2.50mL,混匀后于50℃水浴20min,再加入10%三氯乙酸2.50mL终止反应。将溶液混合均匀,取2.50mL于试管中,加入蒸馏水2.50mL及0.1%三氯化铁溶液0.50mL,混匀后静置10min,测定其在700nm处吸光度值。按照上述方法测定鲣鱼褐色肉酶解产物的还原能力,以蒸馏水代替样品作为空白。每组实验进行3次,结果取平均值。
1.2.3不同蛋白酶对鲣鱼褐色肉酶解产物还原能力的影响采用GB/T 23527-2009福林法测定出各蛋白酶实际酶活分别为:碱性蛋白酶15.62万U/g;复合蛋白酶16.56万U/g;中性蛋白酶18.51万U/g;木瓜蛋白酶16.26万U/g;风味蛋白酶18.21万U/g。以酶解产物的还原能力为指标,在酶解温度50℃及初始pH9.0的条件下,固定料液比1∶10、酶添加量5000U/g及酶解时间5h,考察碱性蛋白酶、复合蛋白酶、中性蛋白酶、木瓜蛋白酶和风味蛋白酶的酶解效果,筛选出适合酶解鲣鱼褐色肉的蛋白酶。
1.2.4单因素实验以还原能力为指标,单因素实验的基本条件为初始pH9.0、酶解温度50℃、酶添加量5000U/g、酶解时间4h,改变其中一个条件,固定其他条件以分别考察酶解时间(2、3、4、5、6h)、酶解温度(30、40、50、60、70℃)、初始pH(7.0、8.0、9.0、10.0、 11.0)及酶添加量(3000、4000、5000、6000、7000U/g)等因素对鲣鱼褐色肉酶解产物还原能力的影响。
1.2.5响应面实验设计在单因素实验的基础上,以初始pH(X1)、酶添加量(X2)、酶解温度(X3)和酶解时间(X4)为因子,以酶解液还原能力为响应值,根据Box-Benhnken中心组合实验设计原理设计四因素三水平的响应面实验,确定最优酶解条件。响应面实验设计因素及水平编码见表1,每组实验进行3次,结果取平均值。

表1 响应面实验的编码值及水平Table 1 The cods and levels of RSM
2 结果与讨论
2.1还原能力标准曲线

图1 还原能力标准曲线Fig.1 Standard curve of reducing power
以肌肽浓度为横坐标、吸光度(OD700nm)为纵坐标绘制标准曲线如图1所示。一般认为,在700nm处的吸光度值越大表示物质还原力越强,图1的标准曲线也表明,吸光度值随抗氧化物浓度的增大而增大,而溶液的总还原力与其中所含的抗氧化成分含量呈量效关系,因此可用700nm处的吸光度值(OD700nm)表示还原力。
2.2不同蛋白酶对鲣鱼褐色肉酶解产物还原能力的影响
蛋白质在酶解过程中产生的氨基酸、二肽、三肽、寡肽或多肽会增加极性基团的数量及酶解液的溶解性,从而改变蛋白质的乳化性、抗氧化性等功能特性,并提高其功能及生物利用率。鲣鱼褐色肉不同蛋白酶酶解产物还原能力的比较如图2所示。实验中所应用的五种酶属于肽链内切酶、肽链外切酶,或兼具内切蛋白酶和外切蛋白酶两种活性,在水解过程中均能将底物蛋白质降解成分子量较小的活性肽。由图2可知,不同酶水解鲣鱼褐色肉制得的酶解液都表现出一定的还原能力,且酶解液还原能力由高到低依次为:碱性蛋白酶>复合蛋白酶>中性蛋白酶>风味蛋白酶>木瓜蛋白酶。在水解过程中,底物、蛋白酶种类、水解条件及水解程度等都会影响酶解产物的理化功能[14],其中,不同种类的酶由于其自身特异性使其各自产生具有不同氨基酸序列、分子量及肽链长度的自由氨基酸和低肽[15],并对水解产物的抗氧化性[16]及疏水性[17]等生物活性产生不同程度的影响,从而造成不同酶解产物还原能力的差异。

图2 酶种类对水解液还原能力的影响Fig.2 Effect of enzyme types on reducing power of hydrolysate
碱性蛋白酶是一种由地衣芽孢杆菌(Bacillus licheniformis)产生的、具有广泛底物特异性的丝氨酸型内切蛋白酶[18],现已成功用于青鱼(Mylopharyngodon piceus)[19]、金枪鱼[20]等鱼蛋白的水解。碱性蛋白酶酶解物中含有可作为供电体的多肽,因而表现出较强的抗氧化性[21]。Chobert等[22]的研究还表明,海鳗(Muraenesox cinereus)肉碱性蛋白酶酶解液中的蛋氨酸、半胱氨酸、甘氨酸、丙氨酸、色氨酸和组氨酸都表现出较强的抗氧化活性[23],其中组氨酸和含肽组氨酸的抗氧化活性可能归因于咪唑环的螯合作用,色氨酸残基则是较强的氢供体[24]。由于碱性蛋白酶的酶解特异性使其酶解液具有较高的还原能力,因此选用碱性蛋白酶对鲣鱼褐色肉进行酶解。
2.3鲣鱼褐色肉酶解的单因素实验
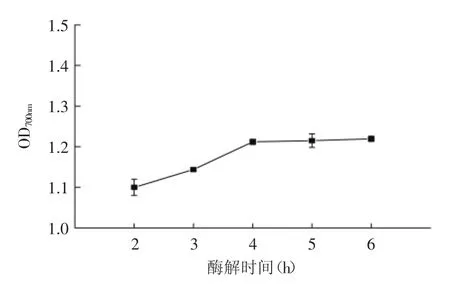
图3 酶解时间对酶解产物还原能力的影响Fig.3 Effect of enzyme time on reducing power of hydrolysate
在初始pH、酶添加量、酶解温度一定时,酶解时间对还原能力的影响如图3。酶解初始阶段,还原能力增加较快并在4h时达到最大,而后随着酶解时间的延长还原能力增加不明显。反应初始阶段,由于底物敏感肽键的快速断裂使非核心蛋白质降解成大量多肽,还原能力迅速增加;随着反应时间的延长,核心蛋白的降解速率较慢、酶活性下降、产物与剩余底物竞争结合位点等原因造成可降解肽键浓度下降,导致还原能力增速减缓[25],因此鲣鱼褐色肉酶解的适宜时间为4h。

图4 酶解温度对酶解产物还原能力的影响Fig.4 Effect of enzyme temperature on reducing power of hydrolysate
初始pH、酶添加量、酶解时间一定时,酶解温度对酶解液还原能力的影响见图4。由图4可知,当温度从30℃升高到50℃时,还原能力逐渐增大,在50℃时还原能力最大,温度继续升高还原能力反而下降。这是由于酶的催化能力与温度有密切关系:温度较低时,酶活性得不到充分发挥,影响蛋白酶催化反应速率;温度过高时,维持酶分子构象的次级键可能发生解体,使酶逐渐失活从而影响酶催化反应的进行。因此鲣鱼褐色肉酶解的适宜温度为50℃。

图5 初始pH对酶解产物还原能力的影响Fig.5 Effect of initial pH on reducing power of hydrolysate
酶添加量、酶解温度、酶解时间一定时,初始pH对酶解还原能力的影响见图5。由图5可知,随着初始pH的上升,酶解液还原能力升高较快,在pH为10.0时酶解液还原能力达到最大。pH高于10.0后,还原能力有所下降。不同初始pH条件下还原能力有所不同,可能是由于在酸-中性条件下,酶的构象发生转变导致酶的活性降低或完全丧失,从而影响酶解反应的进行[26]。
在初始pH、酶解温度、酶解时间一定时,酶添加量对酶解液还原能力的影响见图6。当酶添加量较少时,由于酶添加量不足时底物难以完全水解,故还原能力较低,随着酶添加量的增大还原能力逐渐升高,在酶添加量为5000U/g时还原能力达到最大,之后还原能力随酶添加量的变化不明显。因此,酶添加量应选择5000U/g。
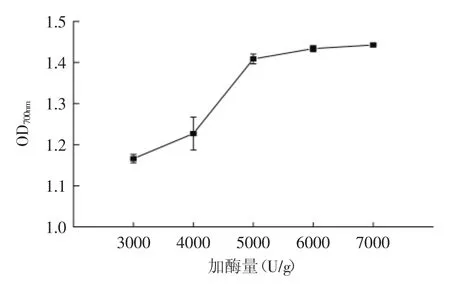
图6 酶添加量对酶解产物还原能力的影响Fig.6 Effect of enzyme dosage on reducing power of hydrolysate
2.4鲣鱼褐色肉酶解条件的响应面优化
2.4.1回归模型的确定在单因素实验基础上,采用Box-Behnken中心实验设计原理,对初始pH、酶添加量、酶解时间、酶解温度四个因素采用响应面分析软件设计四因素三水平的中心组合设计,对碱性蛋白酶酶解鲣鱼褐色肉的条件进行优化,实验设计及结果见表2。

表2 响应面实验方案及结果Table 2 Project and results of RSA experiment
对实验结果进行回归拟合并建立响应面回归模型,得到回归方程为:Y=1.41-0.028X1+0.077X2-0.05X3+ 0.048X4-0.054X1X2-0.081X1X3-0.050X1X4-0.021X2X3+ 0.048X2X4-0.028X3X4-0.15X12-0.014X22-0.016X32-0.16X42。对模型进方差分析,结果见表3。由表3可知,模型的F值为28.12、“p>F”<0.0001表明模型极显著;失拟项p=0.0612>0.05表现为“不显著”,回归方程与实际值可较好拟合;R2=96.57%,表明模型的拟合较好;变异系数(CV)为3.34%,说明实验的精确度高、可靠性强、实验操作可信。因此,拟合二次模型是本研究中评估还原能力的最佳模型。
一次项中酶添加量、酶解温度和酶解时间对响应值的影响最大,达到极显著水平(p<0.01),初始pH达到显著水平(p<0.05);四个二次项因子均达到极显著水平(p<0.01);在交互项中,pH和酶解温度的交互为极显著,pH与酶添加量、pH与酶解时间、酶添加量与酶解时间的交互达到显著水平(p<0.05),酶添加量与酶解温度、酶解温度与酶解时间交互作用不显著。模型表明,所有一次项、二次项及部分交互项都对响应有显著贡献。由此可知,各因子对鲣鱼褐色肉酶解产物还原能力的影响并非简单的线性关系。

表3 响应面二次多项式模型的ANOVA分析结果Table 3 ANOVA for response surface quadratic polynomial models
2.4.2响应面图分析为更直观的表现某两个因素的交互作用,通过令其他因素固定在零水平,将回归方程降维得到的二元二次方程绘制成相应的响应面图如图7~图12所示。

图7 Y=f(X1,X2)的响应面图Fig.7 Response surface plot of Y=f(X1,X2)
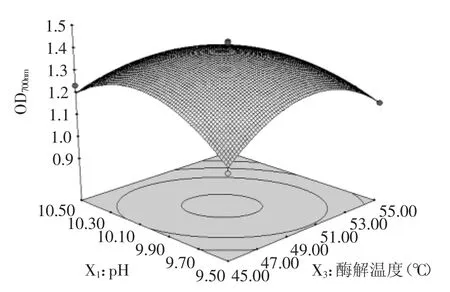
图8 Y=f(X1,X3)的响应面图Fig.8 Response surface plot of Y=f(X1,X3)

图9 Y=f(X1,X4)的响应面图Fig.9 Response surface plot of Y=f(X1,X4)

图10 Y=f(X2,X3)的响应面图Fig.10 Response surface plot of Y=f(X2,X3)

图11 Y=f(X2,X4)的响应面图Fig.11 Response surface plot of Y=f(X2,X4)

图12 Y=f(X3,X4)的响应面图Fig.12 Response surface plot of Y=f(X3,X4)
每对变量的组合效果表明,在鲣鱼褐色肉蛋白的水解物中,随着pH、酶添加量、酶解温度和酶解时间的增加,还原能力也随之增加到一个特定水平,高于该水平后,还原能力值略微下降,可能是由于在较高pH、酶添加量、酶解温度或酶解时间条件下碱性蛋白酶结构发生改变,从而降低了其生物活性[27]。6个响应面图均为开口向下的凸形曲线,且在-1~1区间存在最高点,说明在所涉及的因素水平范围内响应值存在极大值[28],并且该极值位于响应面的最高点,也即等高线中最小椭圆的中心点。除图10、图12外,其他等高线均为椭圆形,且椭圆的轴线与坐标轴之间有一定的角度,表明pH与酶添加量、pH与酶解温度、pH与酶解时间以及酶添加量与酶解时间的交互作用显著,而酶添加量与酶解温度、酶解温度与酶解时间交互图像更接近圆形、交互作用不显著,该结果与方差分析结果一致。
2.4.3响应面优化结果及验证确定单因素、交互影响及二次多项回归模型方程后,对方程进行逐步回归,得到酶解的最优条件为:pH9.92、酶添加量5182.77U/g、酶解温度49.21℃、酶解时间4.74h,预测的还原能力为1.4393/OD700nm。See[29]、Taheri[30]、Benjakul等[31]的研究分别表明,碱性蛋白酶酶解鳕鱼(Gadus)、沙丁鱼(Sardina melamosticta)、大西洋鳕鱼(Gadus morhua)的最佳条件分别为55.3℃、pH8.39,45.62℃、pH8.5,60℃、pH9.5。由于酶添加量及底物蛋白质类型均会对酶解液的组成、肽链长度及生物活性产生影响,因而可能造成同种蛋白酶最适酶解条件的差异[32]。为进一步验证模型的有效性和准确性,考虑到实际操作的可行性,将最优酶解条件修正为pH9.9、酶添加量5183U/g、酶解温度49℃、酶解时间4.75h,在该条件下进行酶解,三次重复实验的结果为1.4322、1.4277和1.4326,平均值为1.4308/OD700nm,与预测结果误差较小。由此可见该模型能较好地用于鲣鱼褐色肉酶解条件的优化。
3 结论
最佳酶解条件为:pH9.9、酶添加量5183U/g、酶解温度49℃、酶解时间4.75h,酶解液的实际还原能力为1.4308/OD700nm,与模型预测值1.4393/OD700nm接近。利用响应面分析法得到的鲣鱼褐色肉酶解工艺参数真实可靠,为鲣鱼褐色肉的开发利用、变废为宝提供了技术支持。
[1]Haard N F.Biochemistry and chemistry of color and color change in seafoods[M].USA:Technomic Publishing Co.,1992:36-39.
[2]Takeshi S,Toshiyuki H,Michizo S.Free imidazole compounds in white and dark muscles of migratory marine fish[J].Comparative Biochemistry and Physiology Part B:Comparative Biochemistry,1987,87(3):615-619.
[3]Chaijan M,Benjakul S,Visessanguan W,et al.Changes of pigments and colour in sardine(Sardinella gibbosa)and mackerel(Rastrelliger kanagurta)muscle during iced storage[J].Food Chemistry,2005,93(4):607-617.
[4]Chaijan M,Benjakul S,Visessanguan W,et al.Characterisation of myoglobin from sardine(Sardinella gibbosa)dark muscle[J]. Food Chemistry,2007,100(1):156-164.
[5]Undeland I,Ekstrand B,Lingnerts H.Lipid oxidation in herring(Clupea harengus)light muscle,dark muscle,and skin,stored separately or as intact fillets[J].Journal of the American Oil Chemists’Society,1998,75(5):581-590.
[6]Hsu K C.Purification of antioxidative peptides prepared from enzymatic hydrolysates of tuna dark muscle by-product[J].Food Chemistry,2010,122(1):42-48.
[7]Kim S K,Mendis E.Bioactive compounds from marine processing byproducts-A review[J].Food Research International,2006,39(4):383-393.
[8]林养坤,林丽清.鲣鱼加工废弃物中鱼油的提取及纯化的工艺研究[J].福建水产,2011,33(1):36-39.
[9]张丽.鲣鱼脑的磷脂提取及活性研究[D].大连:大连海洋大学,2013.
[10]王玉明,武晓琳,李兆杰,等.鲣鱼肝脏酶解物对高果糖大鼠的降压活性研究[J].中国海洋大学学报,2011,41(1):61-64.
[11]谢捷,汤君敏,朱兴一,等.不同硫酸酯基含量硫酸软骨素的体外抗氧化活性[J].浙江工业大学学报,2010,38(6):608-610.
[12]Oyaizus M.Studies on products of browning reaction:Antioxidative activities of products of browning reaction prepared from glucosamine[J].Japanese Journal of Nutrition,1986,44:307-315.
[13]Yildirim A,Mavi A,Karas A A.Determination of antioxidant and antimicrobial activities of Rumex crispus L.extracts[J].Food Chemistry,2001,49(8):4083-4089.
[14]赵培城,韩晓,丁玉庭,等.鱼糜固态发酵工艺与其生化指标动态变化的研究[J].浙江工业大学学报,2013,41(2):165-170.
[15]Shimada K,Fujikawa K,Yahara K,et al.Antioxidative properties of xanthan on the autioxidation of soy-bean oil in cyclodextrin emulsion[J].Food Chemistry,1992,40(6):945-948.
[16]Wu H C,Chens H M Shiau.Free amino acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food Research International,2003,36(9):949-957.
[17]Mullally M,Callaghan D M,FitzGerald J,et al.Zymogen activation in pancreatic endoproteolytic preparations and influence on some whey protein characteristics[J].Food Science,1995,60(2):227-233.
[18]Chalamaiah M,Rao G N,Rao D G,et al.Protein hydrolysates from meriga(Cirrhinus mrigala)egg and evaluation of their functional properties[J].Food Chemistry,2009,120(3):652-657.
[19]Sathivel S,Bechtel J,Babbitt J,et al.Biochemical and functional properties of herring(Clupea harengus)by product hydrolysates[J].Journal of Food Science,2003,68(7):2196-2200.
[20]Guerard F,Guimas L,Binets A.Production of tuna waste hydrolysates by a commercial neutral protease preparation[J]. Journal of Molecular Catalysis B:Enzymatic,2002,19:489-498.
[21]Hyun C K,Shins H K.Utilization of bovine blood plasma protein for the production of angiotensin I converting enzyme inhibitory peptides[J].Process Biochemistry,2000,36(1):65-71.
[22]Chobert J,Bertrand H,Nicolass M C.Solubility and emulsifying properties of caseins and whey proteins modified enzymatically by trypsin[J].Food Chemistry,1988,36(5):883-892.
[23]Riisom T,Sims R,Fioriti J.Effect of amino acids on the autoxidation of safflower oil in emulsions[J].Oil Chemistry,1980,57(10):354-359.
[24]Je J,Park P J,Kims S K.Antioxidant activity of peptide isolated from Alaska pollack(Theragra chalcogramma)frame protein hydrolysate[J].Food Research International,2005,38(1):45-50.
[25]Dong S Y,Zeng M,Wang D,et al.Antioxidant and biochemical properties of protein hydrolysates prepared from silver carp(Hypophthalmichthys molitrix)[J].Food Chemistry,2008,107(4):1485-1493.
[26]Nalinanon S,Benjakul S,Kishimuras H.Collagens from the skin of arabesque greenling(Pleurogrammus azonus)solubilized with the aid of acetic acid and pepsin from albacore tuna(Thunnus alalunga)stomach[J].Food Chemistry,2010,90(9):1492-1500.
[27]Ovissipour M,Taghiof M,Motamedzadegan A,et al. Optimization of enzymatic hydrolysis of visceral waste proteins of beluga sturgeon Huso huso using Alcalase[J].Aquatic Reserch,2009,1(1):31-38.
[28]杨胜利,陈律伸,钱俊青.响应面法优化HPEF杀菌工艺研究[J].浙江工业大学学报,2013,41(1):40-43.
[29]Ovissipour M,Taghiof M,Motamedzadegan A,et al. Optimization of enzymatic hydrolysis of visceral waste proteins of beluga sturgeon Huso huso using Alcalase[J].Aquatic Reserch,2009,1(1):31-38.
[30]Taheri A,Kenari A A,Motamedzadegan A,et al.Optimization of goldstripe sardine(Sardinella gibbosa)protein hydrolysate using Alcalase 2.4L by response surface methodology[J].CyTAJournal of Food,2011,9(2):114-120.
[31]Benjakul S,Morisseys M T.Protein hydrolysate from pacific whiting solid waste[J].Food Chemistry,1997,45(9):3423-3430.
[32]Kristinsson H G,Rascos B A.Fish protein hydrolysates:production,biochemical and functional properties[J].Critical Reviews in Food Science and Nutrition,2000,40(1):43-81.
Study on optimization of enzymatic hydrolysis conditions of dark flesh of Skipjack Tuna by response surface methodology
YANG Long-fang1,SANG Wei-guo1,*,DUAN Qing-yuan2
(1.School of Marine Sciences,Ningbo University,Ningbo 315211,China;2.Marine and Fisheries Research Institute,Ningbo 315010,China)
Enzymatic hydrolysis conditions of Skipjack tuna dark flesh by Alcalase were investigated in this paper. Taking initial pH,enzyme dosage,hydrolysis temperature,hydrolysis time as factors and reducing power of hydrolysate as response,the enzymatic hydrolysis conditions of dark flesh were optimized based on single factor experiments.It turned out that the optimum hydrolytic conditions were Alcalase with a pH9.9,dosage of 5183U/g,temperature 49℃ and hydrolysis for 4.75h,and result in a reducing power of 1.4308/OD700nmwhich was close to the predicted value 1.4393/OD700nm.The parameters of skipjack dark flesh hydrolysate process by response surface methodology were more reliable,providing technique support for development and utilization of Skipjack dark flesh.
Skipjack tuna;enzymatic hydrolysis;alcalase;reducing power
TS254.1
A
1002-0306(2015)12-0175-07
10.13386/j.issn1002-0306.2015.12.028
2014-09-09
杨龙方(1987-),男,硕士研究生,研究方向:食品生物活性提取与应用。
桑卫国(1955-),男,硕士,副教授,研究方向:水产品加工与综合利用。
宁波市农村科技创新创业资金项目(2014C91020);宁波大学开放实验项目(E01069138000)。

