粪肠球菌SK32.001精氨酸脱亚胺酶的分离纯化及酶学性质研究
刘 昕,帅玉英,张 涛,江 波,*,缪 铭,沐万孟
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;2.南通励成生物工程有限公司,江苏南通226010)
粪肠球菌SK32.001精氨酸脱亚胺酶的分离纯化及酶学性质研究
刘昕1,帅玉英2,张涛1,江波1,*,缪铭1,沐万孟1
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;2.南通励成生物工程有限公司,江苏南通226010)
对Enterococcus faecalis SK32.001所产的精氨酸脱亚胺酶(ADI)进行分离纯化并对其酶学性质进行研究。实验结果表明,通过细胞破碎,硫酸铵沉淀,HiPrep Q FF 16/10阴离子交换层析,Sephadex G-75等纯化方法获得电泳纯精氨酸脱亚胺酶,分子量约为42ku,催化最适温度和pH分别为50℃和6.5,在30~40℃和pH5.5~7.5时较稳定。不同浓度的Zn2+对酶活性影响较大。1mmol/L的Zn2+和10mmol/L的Co2+、Ca2+、Mg2+对酶活有较大的促进作用,10mmol/L的Cu2+对酶的抑制作用最强。精氨酸脱亚胺酶在最适反应条件测定其米氏常数为1.33mmol/L,最大反应速度为2.41μmol/min。
粪肠球菌SK32.001,精氨酸脱亚胺酶(ADI),纯化,酶学性质
瓜氨酸的名字来源于拉丁语Citrullus vulgaris,意为西瓜,因为西瓜中含有大量该氨基酸[1]。近年来国内外的众多研究表明,瓜氨酸具有很多重要的生理功能[2-3],如提高免疫系统功能,含丰富的抗氧化剂吸收有害的自由基,治疗类风湿性关节炎等。因此,瓜氨酸正越来越广泛地被用于化妆品、保健食品、食品添加剂以及营养强化剂中。目前,L-瓜氨酸的生产方法有化学法、发酵法和酶法。酶法生产是指在精氨酸脱亚胺酶的作用下,L-精氨酸被转化为L-瓜氨酸[4-6]。酶法合成瓜氨酸生产条件温和,产物浓度高,纯化步骤少,产品中无D-型旋光对映体[7]。精氨酸脱亚胺酶(Arginine Deiminase,EC3.5.3.6,简称ADI)可将精氨酸转化为瓜氨酸和氨,是一种仅发现于微生物中的精氨酸降解酶[8]。ADI最早是由HORN F等于1933年发现于绿脓杆菌细胞中[9]。作为一种精氨酸降解酶,ADI经证实能有效抑制精氨酸缺陷型肿瘤,如黑素瘤和肝细胞癌的增殖[10-11],是一种新型的肿瘤细胞体内体外增殖抑制剂[12]。且在抑制人白血病癌细胞中,ADI比门冬氨酸更具潜力[13]。因此,在国内开展精氨酸脱亚胺酶的分离纯化方法研究,对药物开发具有重要意义[14]。本实验对实验室筛选保藏菌株粪肠球菌SK32.001进行分离纯化,提取精氨酸脱亚胺酶并初步研究其酶学性质。
1 材料与方法
1.1材料与仪器
菌株SK32.001 Enterococcus faecalis本实验室从西瓜大棚的土壤中分离所得;种子培养基(g/L) 葡萄糖10,L-精氨酸5,酵母粉5,鱼粉蛋白胨5,NH4Cl 1.5,K2HPO41.0,NaCl 0.1,pH6.0;发酵培养基(g/L) 葡萄糖10,L-精氨酸10,酵母粉5,鱼粉蛋白胨5,K2HPO41.0,NaCl 0.1,pH6.0;L-精氨酸(L-Arg,纯度99%) 浙江宁波科瑞生物工程有限公司;牛血清蛋白、磷酸氢二钠、磷酸二氢钠、三羟甲基氨基甲烷、硫酸铵、二乙酰一肟、硫代氨基脲、考马斯亮兰、浓硫酸、盐酸、磷酸等国药集团化学试剂有限公司。
Centrifuge5804R高速冷冻离心机德国Eppendorf公司;Alpha-1系紫外可见分光光度计上海谱元仪器有限公司;pH计梅特勒-托利多仪器有限公司;细胞破碎仪宁波新芝生物科技股份有限公司;AKTA蛋白纯化系统Pharmacia公司;电子天平梅特勒-托利多仪器有限公司;SDS-PAGE电泳仪Bio-Rad公司。
1.2实验方法
1.2.1精氨酸脱亚胺酶的分离纯化
1.2.1.1粗酶液的制备发酵液4℃,10000r/min离心15min,收集菌体后用0.9%的生理盐水洗涤。将湿菌体重悬于50mmol/L,pH6.0的磷酸钠缓冲液中,超声破碎20min(功率22W,破碎1s间歇2s)。经4℃,10000r/min离心15min后收集上清液即为粗酶液。
1.2.1.2硫酸铵沉淀将研细的硫酸铵缓慢加入粗酶液中,先加入饱和度50%的硫酸铵,混匀后4℃静置4h,10000r/min离心20min,收集上清液。继续加入硫酸铵至饱和度为80%,离心后收集沉淀,用50mmol/L,pH6.0的磷酸钠缓冲液溶解。透析过夜除去硫酸铵。
1.2.1.3HiPrep Q FF 16/10阴离子交换柱层析HiPrep Q FF 16/10阴离子交换柱用缓冲液(50mmol/L,pH6.2的Tris-HCl缓冲液)预平衡后,上样2mL,用含有0~1mol/L氯化钠的缓冲液进行线性梯度洗脱,收集流速1.4mL/min。
1.2.1.4Sephadex G-75凝胶柱层析收集离子交换层析后具有酶活力的蛋白,透析降低盐离子浓度并用聚乙二醇20000进行浓缩。将约50mL的酶液浓缩至2mL左右,用于凝胶柱上样。流动相为含0.2mol/L NaCl的缓冲液(50mmol/L,pH6.2的Tris-HCl缓冲液),收集流速0.5mL/min。
1.2.2精氨酸脱亚胺酶的酶学性质研究
1.2.2.1精氨酸脱亚胺酶反应条件100g/L,pH6.0精氨酸溶液0.2mL,酶液0.1mL,50mmol/L,pH6.0磷酸钠缓冲液0.7mL构成1mL酶反应体系,于50℃水浴中反应1h。煮沸10min灭酶后离心,用高效液相(HPLC)测定上清液中瓜氨酸的含量。HPLC条件:Angilent1200;色谱柱:Hypersil ODS(5μm,4.0mm×250mm);流动相A:水2L,三水合乙酸钠15g,三乙胺0.44mL,四氢呋喃10mL,pH7.15~7.2;流动相B:2L,三水合乙酸钠15g,水/甲醇/乙腈(1∶2∶2 V/V),pH7.12~7.15;流动相A与流动相B梯度洗脱,流速:1.0mL/min;柱温:40℃;进样量:10μL;检测器:紫外检测器;检测波长:338nm,发射波长:360nm。酶活定义:1min时间内产生1μmol L-瓜氨酸所需的酶量为一个酶单位(1U)。比酶活定义:1mg的蛋白质所含活力单位数(U/mg)。
1.2.2.2温度对精氨酸脱亚胺酶活力及稳定性的影响将酶反应体系分别置于不同温度30、35、40、45、50、55、60℃中,恒温水浴1h后立即煮沸10min终止酶反应,测酶活力。热稳定性研究:将酶液置于不同温度30、35、40、45、50、55、60℃中保温,分别放置10、30、60、120、180、240min后参与酶反应,50℃下测其残余酶活力。
1.2.2.3pH对酶活力及稳定性的影响将处于不同pH5.0、5.5、6.0、6.5、7.0、7.5、8.0的酶反应体系置于50℃恒温水浴1h后立即煮沸10min终止酶反应,测酶活力。pH稳定性研究:取冷冻干燥后的酶粉溶于不同pH5.0、5.5、6.0、6.5、7.0、7.5、8.0的磷酸钠缓冲液中,将不同pH条件下的酶液保存12h后调至pH6.0,酶反应体系置于50℃恒温水浴1h后立即煮沸10min终止酶反应,测酶活力。
1.2.2.4金属离子对酶活力的影响在酶液中加入不同金属离子(终浓度分别为0.1、1.0、10、100mmol/L):Cu2+、Zn2+、Mn2+、Mg2+、Co2+、Ca2+。保温2h后,酶反应体系置于50℃恒温水浴1h后立即煮沸10min终止酶反应,测酶活力。空白对照组为未添加金属离子的酶活力。
1.2.2.5精氨酸脱亚胺酶的米氏常数测定分别配制1、1.25、2、2.5、5、10、20、25、50、100mmol/L的L-精氨酸溶液2mL,加入ADI酶溶液0.1mL,于pH6.5,50℃下测定酶活力。
1.3数据处理
数据处理及图表制作均使用Excel软件。

图1 ADI电泳谱图Fig.1 Electrophoresis map of the ADI
2 结果与讨论
2.1精氨酸脱亚胺酶的纯化结果及SDS-PAGE电泳鉴定
细胞破碎后粗酶液经过硫酸铵沉淀、HiPrep Q FF 16/10阴离子交换柱层析以及SephadexG-75凝胶柱层析后,将每一步纯化后的样品进行SDS-PAGE电泳鉴定,结果如图1所示。可知经凝胶柱层析后的酶液呈现一条蛋白条带,达到电泳纯,其分子量约为42ku。对精氨酸脱亚胺酶的纯化结果如表1所示,最后得到的电泳纯酶液纯化倍数为20.1,回收率仅为1.6%。回收率较低,说明蛋白损失严重,杂蛋白较多,这步损失较多,可能是纯化时温度控制不当造成的。
2.2精氨酸脱亚胺酶的酶学性质研究
2.2.1温度对酶活力及热稳定性的影响温度通常对酶促反应有较大影响。一定范围内的温度升高有利于酶促反应的进行,但是精氨酸脱亚胺酶作为一种蛋白质,温度过高则会使酶失活。由图2可知,精氨酸脱亚胺酶的最适反应温度为50℃。这是由于50℃之前酶活力随着温度上升而提高,温度大于50℃以后,酶蛋白的热变性使酶部分失活,60℃时的酶活力迅速下降到最适温度时的一半。
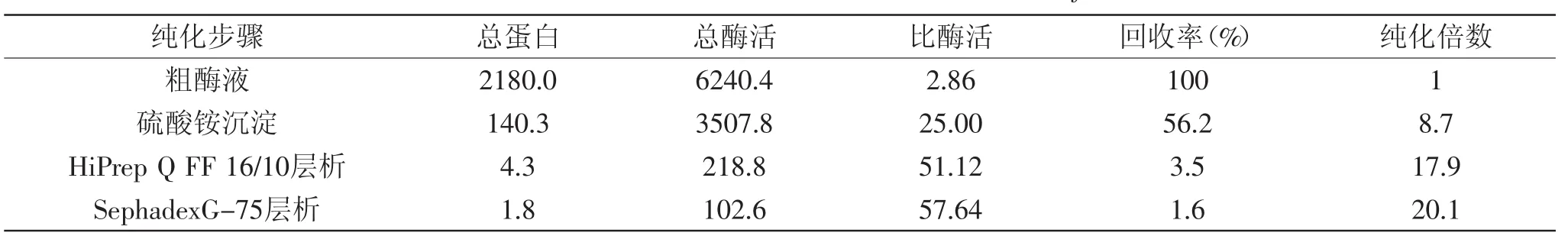
表1 粪肠球菌SK32.001精氨酸脱亚胺酶纯化基本情况Table 1 Purification of ADI from SK32.001 Enterococcus faecalis

图2 温度对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.2 Effect of temperature on the enzyme activity of ADI from SK32.001 Enterococcus faecalis
另外研究了不同温度30、35、40、45、50、55、60℃下精氨酸脱亚胺酶的热稳定性。由图3可知,精氨酸脱亚胺酶在30、35及40℃条件下稳定性较高,保温4h后仍有大于60%的残余酶活;而在45℃以上保存30min酶活便会迅速下降,将其置于最适酶反应温度50℃恒温3h后,残余酶活仅为25%,60℃下保温3h后残余酶活仅剩10%,可见酶的耐热性较差。
2.2.2pH对酶活力及稳定性的影响酶在不同pH体系中,其构象、稳定性以及与底物分子的解离状态会发生改变,从而会影响酶的催化活性。因此需要测定在最适温度下,不同pH对精氨酸脱亚胺酶的酶催化活力的影响。由图4可知,精氨酸脱亚胺酶的最适pH为6.5,在pH为6~6.5之间时,酶促反应速率较大,而pH大于6.5时酶活力明显降低,酶在强酸强碱条件下活力较低。

图3 温度对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.3 Effect of temperature on the enzyme activity of ADI from SK32.001 Enterococcus faecalis

图4 pH对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.4 Effect of pH on the enzyme activity of ADI from SK32.001 Enterococcus faecalis
另外研究了不同pH5.0、5.5、6.0、6.5、7.0、7.5、8.0时精氨酸脱亚胺酶的稳定性。由图5可知,精氨酸脱亚胺酶在pH5.5~7.5之间相对稳定,残余酶活均可保持90%以上。超过7.5时酶活力受pH影响下降较明显,但残余酶活也有原来的80%,说明整体稳定性较好。

图5 pH对粪肠球菌SK32.001精氨酸脱亚胺酶稳定性的影响Fig.5 Effect of pH stability on the enzyme activity of ADI from SK32.001 Enterococcus faecalis
2.2.3金属离子对酶活力的影响金属离子可以通过改变溶液的离子强度和蛋白质的结构来影响酶的催化活性。在最适pH和温度下,考察几种常见二价金属离子对酶活力的影响,金属离子终浓度依次为0.1、1.0、10、100mmol/L。图6为金属离子终浓度为0.1mmol/L时精氨酸脱亚胺酶的相对酶活,并对加入金属离子后精氨酸脱亚胺酶的相对酶活分别与空白组进行差异显著性分析。由图6可知,0.1mmol/L的Cu2+对酶活有较明显的抑制作用(p<0.001),0.1mmol/L的Zn2+对酶活的促进作用最强。而加入0.1mmol/L Mg2+时酶活力与空白比较无显著性差异(p>0.05)。

图6 0.1mmol/L金属离子对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.6 Effect of metal ions of 0.1mmol/L on the activity of ADI from SK32.001 Enterococcus faecalis
图7为金属离子终浓度为1.0mmol/L时精氨酸脱亚胺酶的相对酶活。Zn2+、Mn2+、Co2+、Ca2+对酶活有较显著促进作用(p<0.001),但Cu2+会抑制酶的活性。溶液中加入1.0mmol/L Zn2+会对酶活产生强烈的促进作用,而加入1.0mmol/L Mg2+时酶活力没有明显变化(p>0.05)。

图7 1.0mmol/L金属离子对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.7 Effect of metal ions of 1.0mmol/L on the activity of ADI from SK32.001 Enterococcus faecalis
此外,10mmol/L金属离子的作用效果如图8所示。10mmol/L Co2+对酶活有最强的促进作用,使酶活提高了70%。10mmol/L Mn2+、Ca2+、Mg2+也较显著的提高了酶活(p<0.001)。而10mmol/L Cu2+和Zn2+对酶活有明显抑制作用(p<0.001),其中Cu2+的抑制作用最明显,加入10mmol/L Cu2+后的酶活仅为空白对照的60%。

图8 10mmol/L金属离子对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.8 Effect of metal ions of 10mmol/L on the activity of ADI from SK32.001 Enterococcus faecalis
图9为金属离子终浓度为100mmol/L时精氨酸脱亚胺酶的相对酶活。100mmol/L Mg2+对酶活有最强的促进作用,使酶活提高到了160%。而Cu2+、Zn2+、Mn2+、Co2+和Ca2+对酶活有显著抑制作用(p<0.001),其中加入100mmol/L Cu2+后的酶活仅为空白对照的40%。

图9 100mmol/L金属离子对粪肠球菌SK32.001精氨酸脱亚胺酶活力的影响Fig.9 Effect of metal ions of 100mmol/L on the activity of ADI from SK32.001 Enterococcus faecalis
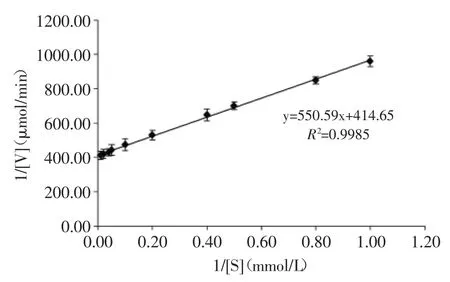
图10 粪肠球菌SK32.001精氨酸脱亚胺酶的酶促反应动力学Fig.10 Kinetic parameters of ADI from SK32.001 Enterococcus faecalis
2.2.4精氨酸脱亚胺酶的米氏常数测定以精氨酸为底物,分别在不同底物浓度下测定酶活性。以底物浓度和产物瓜氨酸生成量作图,以1/[S]为横坐标,1/[V]为纵坐标,得到精氨酸脱亚胺酶的双倒数曲线如图10所示,经米氏方程计算,得到酶的表观米氏常数Km= 1.33mmol/L,Vm=2.41μmol/min。
3 结论
对实验室筛选保藏菌株粪肠球菌SK32.001进行分离纯化,提取精氨酸脱亚胺酶并初步研究其酶学性质。实验结果表明,通过细胞破碎,硫酸铵沉淀,HiPrep Q FF 16/10阴离子交换层析,Sephadex G-75等纯化方法获得电泳纯ADI,分子量约为42ku,催化最适温度和pH分别为50℃和6.5,在30~40℃和pH5.5~7.5时较稳定。不同浓度的Zn2+对酶活性影响较大。1mmol/L的Zn2+和10mmol/L的Co2+、Ca2+、Mg2+对酶活有较大的促进作用,10mmol/L的Cu2+对酶的抑制作用最强。精氨酸脱亚胺酶在最适反应条件测定其米氏常数为1.33mmol/L,最大反应速度为2.41μmol/min。
[1]方佳茂.一株产L-瓜氨酸微生物菌株的鉴定[J].发酵科技通讯,2010(2):16-19.
[2]Lutgens L C,Deutz N E,Gueulette J,et al.Citrulline:a physiologic marker enabling quantitation and monitoring of epithelial radiation-induced small bowel damage[J].Int J Radiat Oncol,2003,57(4):1067-1074.
[3]Wuyts B,Stove V,Goossens L.Critical sample pretreatment in monitoring dried blood spot citrulline[J].Clin Chim Acta,2007,386(1):105-109.
[4]刘梦晗,倪晔,张龙,等.随机突变结合理性设计改进生理pH下精氨酸脱亚胺酶的性质[J].中国生物化学与分子生物学报,2013,29(2):175-182.
[5]曹瑜,李加友,焦庆才.酶法转化制备L-瓜氨酸[J].精细化工,2006,22(10):759-761.
[6]郑璞,倪晔,张文,等.填充床反应器中固定化假单胞菌细胞连续制备L-瓜氨酸[J].食品与生物技术学报,2008,27(5):33-38.
[7]姚海峰,张淑荣,欧成武,等.粪链球菌转化合成L-瓜氨酸的研究[J].食品工业科技,2008(6):256-258.
[8]张媛媛,刘晓蓉,周爱芳.恶臭假单胞菌产精氨酸脱亚胺酶发酵条件及特性的研究[J].中国酿造,2011(7):54-57.
[9]张媛媛.精氨酸脱亚胺酶的研究进展[J].中国酿造,2012,31(6):14-18.
[10]Ensor C M,Holtsberg F W,Bomalaski J S,et al.Pegylated arginine deiminase(ADI-SS PEG20,000 mw)inhibits human melanomas and hepatocellular carcinomas in vitro and in vivo[J]. Cancer Res,2002,62(19):5443-5450.
[11]Shen L J,Beloussow K,Shen W C.Modulation of arginine metabolic pathways as the potential anti-tumor mechanism of recombinant arginine deiminase[J].Cancer Lett,2006,231(1):30-35.
[12]李加友,许平华,焦庆才.精氨酸脱亚胺酶发酵过程特性研究[J].工业微生物,2009,39(1):1-5.
[13]谭玲玲,黄亮,陈博.重组精氨酸脱亚胺酶的表达,纯化及其抗癌活性[J].兰州大学学报:自然科学版,2010,46(2):60-65.
[14]李凯,李成付,李加友,等.双水相体系萃取精氨酸脱亚胺酶[J].精细化工,2008,25(9):865-868.
Purification and characterization of an arginine deiminase from Enterococcus faecalis SK32.001 producing citrulline
LIU Xin1,SHUAI Yu-ying2,ZHANG Tao1,JIANG Bo1,*,MIAO Ming1,MU Wan-meng1
(1.State Key Laboratory of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Nantong Richen Bioengineering Co.,Ltd.,Nantong 226010,China)
The crude enzyme of the arginine deiminase(ADI)from Enterococcus faecalis SK32.001 had been purified and the basic properties of ADI were investigated.The result of SDS-PAGE showed that ADI was purified to homogeneity level by fraction precipitated with ammonium sulfate,HiPrep Q FF 16/10 and Sephadex G-75 gel filtration chromatography.The molecular mass of the purified ADI was estimated to be about 42ku.The optimum temperature and pH of the purified ADI were 50℃ and 6.5,respectively.ADI activity kept stability under the temperature of 30~40℃and at pH range of 5.5~7.5.Among the metal irons,different concentrations of Zn2+could obviously affect the activity.1mmoI/L Zn2+,10mmoI/L Co2+,10mmoI/L Ca2+and 10mmoI/L Mg2+were the effective promoter while 10mmoI/L Cu2+had poor improvement in the activity.The Michaelis constant was 1.33mmoI/L and the maximum velocity was 2.41μmol/min.
Enterococcus faecalis SK32.001;arginine deiminase(ADI);purification;enzymatic properties
TS201.1
A
1002-0306(2015)12-0165-05
10.13386/j.issn1002-0306.2015.12.026
2014-09-12
刘昕(1991-),女,硕士研究生,研究方向:食品加工新技术。
江波(1962-),男,博士,教授,研究方向:食品科学。

