油菜蜂花粉黄酮体外降糖活性研究
孙 岩,郭庆兴,童群义,*
(1.江南大学食品学院,江苏无锡214122;2.百威英博(佛山)啤酒有限公司,广东佛山528100)
油菜蜂花粉黄酮体外降糖活性研究
孙岩1,郭庆兴2,童群义1,*
(1.江南大学食品学院,江苏无锡214122;2.百威英博(佛山)啤酒有限公司,广东佛山528100)
以总黄酮含量为考察指标,利用溶剂萃取和大孔树脂对油菜蜂花粉乙醇提取物进行分离纯化,富集黄酮,然后对不同极性组分进行抑制α-葡萄糖苷酶实验,并利用红外光谱(IR)和液-质联用(LC-MS)对体外降糖活性最高的组分进行化学成分分析。结果表明,黄酮类物质在抑制α-葡萄糖苷酶活性中起主要作用;AB-8大孔树脂纯化得到的PEFS-3组分总黄酮含量为68.77%,IC50为72.16μg/mL,远小于阿卡波糖的IC50(1124.86μg/mL),表明其抑制效果强于阿卡波糖;PEFS-3组分中共鉴定出5种主要物质,其中4种为槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷、山奈酚-3,4’-双-O-β-D-吡喃葡萄糖苷、异鼠李素-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷,第5种推断为亥茅酚苷或黄烷醇,具体结果还需进一步研究。
油菜蜂花粉,α-葡萄糖苷酶,黄酮,液-质联用
α-葡萄糖苷酶是影响饮食中碳水化合物消化和吸收的关键酶,抑制其活性可以延缓人体对碳水化合物的降解及葡萄糖的吸收,从而抑制餐后血糖的快速升高。因此,α-葡萄糖苷酶抑制剂常被用于治疗Ⅱ型糖尿病,可有效降低餐后血糖水平和减少糖尿病并发症的发生。糖尿病尚无理想的治疗方法,传统磺酰脲类和双胍类降糖药,长期食用会产生依赖性和毒副作用[1]。所以,从天然产物中寻找高效的α-葡萄糖苷酶抑制剂成为近年的研究热点,且已报道天然产物如柑橘皮、甘草、桑叶、地榆、胡柚、降香、普洱茶、苦瓜、银杏等大多富含黄酮、多酚、多糖等成分[2-9]。
油菜蜂花粉素有“完全营养库”之称,富含丰富的黄酮、多酚、多糖、多肽、核酸等活性成分,有多种药用价值,能够增强免疫力、抗氧化、抗辐射、降血糖等[10-11]。但鲜有关于油菜蜂花粉黄酮对α-葡萄糖苷酶抑制作用的报道。本文以油菜蜂花粉乙醇提取物不同极性组分进行抑制α-葡萄糖苷酶实验,旨在研究其体外降糖作用,并应用IR和LC-MS对体外降糖活性最高的组分进行鉴定,明确油菜蜂花粉黄酮中体外降糖的主要化学成分,为寻找更好的α-葡萄糖苷酶抑制剂提供理论依据。
1 材料与方法
1.1材料与仪器
油菜蜂花粉烘干粉碎,过100目筛,低温保藏,江苏省庆缘康生物科技有限公司提供;芦丁标准品,≥98%,阿拉丁试剂有限公司;无水乙醇、石油醚(30~60℃)、Al(NO3)3、NaNO2、NaOH、KH2PO4、K2HPO4·3H2O、Na2CO3分析纯,国药试剂有限公司;α-葡萄糖苷酶G-5003 100UN,4-硝基苯-α-D-吡喃葡萄糖苷(PNPG) Sigma公司;阿卡波糖(“拜糖平”批号H19990205) 德国拜耳公司。
CW-2000型超声-微波协同萃取仪超声波固定频率40kHz,功率50W,上海新拓分析仪器科技有限公司;UV-2100型紫外可见分光光度计尤尼柯(上海)仪器有限公司;AB104-N型电子天平Mettler-ToledoInstr(ShangHai)Ltd;FA1004型电子天平上海天平仪器厂;SHZ-D(Ⅲ)型循环水式真空泵巩义市予华仪器有限责任公司;FW-80-I型高速万能粉碎机天津泰斯特仪器有限公司;101-2-BS型电热恒温鼓风干燥箱上海跃进医疗器械厂;HHS型电热恒温水浴锅上海博讯实业有限公司医疗设备厂;ES-2030型冷冻干燥仪日立公司。
1.2实验方法
1.2.1芦丁标准曲线的绘制参照中国药典[12]描述的方法并加以改进测定总黄酮含量。准确称取芦丁标准品30.00mg,用无水乙醇溶解,50W条件下超声10min使其完全溶解,然后转移入100mL容量瓶,用无水乙醇定容至刻度线,配制成0.3000mg/mL的芦丁标准溶液。分别取0、1、2、3、4、5mL芦丁标准溶液,依次加入0~5号25mL容量瓶中,并用蒸馏水补足体积到6mL;加入1mL 5.0%NaNO2,摇匀,静置6min;然后加入1mL 10%Al(NO3)3,摇匀,静置6min;再加入10mL 4.0%NaOH,用50%乙醇定容至刻度,摇匀,静置10min;于510nm下测定吸光值。
1.2.2黄酮的制备及纯化称取2kg过筛的油菜蜂花粉,用超声-微波协同萃取法[13]提取黄酮类物质,过滤提取液,减压浓缩得浸膏,加适量蒸馏水混悬,依次用石油醚、乙酸乙酯、正丁醇溶液萃取,直至有机溶剂层无色,收集有机溶剂层溶液,分别减压浓缩得浸膏,然后加适量水配制成适宜浓度,用AB-8大孔吸附树脂进行纯化,先用去离子水洗脱至流出液无色,再依次用20%、35%、55%、75%、95%的乙醇进行洗脱,分别收集每个梯度的洗脱液,减压浓缩,然后再反复上样,梯度洗脱,最终得20%、35%、55%、75%、95%乙醇洗脱层,减压浓缩得浸膏,分别命名为PEFS-1组分、PEFS-2组分、PEFS-3组分、PEFS-4组分和PEFS-5组分,冷藏备用。
1.2.3黄酮含量的测定按1.2.1方法分别测定石油醚萃余层、乙酸乙酯层、正丁醇层、剩余水层、PEFS-1组分、PEFS-2组分、PEFS-3组分、PEFS-4和PEFS-5组分总黄酮浓度,并取适量溶液依照GB 5009.3-2010[14]测定固体物质干重,并按下式计算提取得到的总黄酮含量。

式中:C—测得提取液浓度,mg/mL;V—干燥提取液体积,mL;M—干燥后样品质量,g。
1.2.4黄酮对α-葡萄糖苷酶活性的影响在苏尧尧[15]的基础上稍做修改,具体方法如下:在一定量0.1mol/L pH6.8的磷酸钾缓冲液中,加入100μL待测样品溶液和100μL的0.5U/mL的α-葡萄糖苷酶(溶解于0.1mol/L pH6.8的磷酸钾缓冲液),混匀后在37℃预热5min,然后加入100μL 4-硝基苯-α-D-吡喃葡萄糖苷(20mmol/L,溶解于0.1mol/L pH6.8的磷酸钾缓冲液),混匀后在37℃反应10min,加入0.1mol/L Na2CO3溶液5mL终止反应,用分光光度计测定反应液在410nm处的吸光值。用等量的0.1mol/L pH6.8的磷酸钾缓冲液代替α-葡萄糖苷酶溶液作为背景组。同时以阿卡波糖作阳性参照物。每个样品做3个平行,取平均值,计算抑制率。

式中:A空白为不加待测样品反应后的吸收值;A样品为加入待测样品反应后的吸收值;A背景为只加待测样品的吸收值。
1.2.5黄酮类物质的IR检测将以上制备PEFS-3组分,经冷冻干燥后取少量于玛瑙研钵中,加入适量溴化钾,研磨至细后压片。把压好的透明薄片放入红外光谱仪中,在400~4000cm-1范围内扫描,记录PEFS-3组分的红外吸收光谱。
1.2.6黄酮类物质的LC-MS检测取适量经冷冻干燥的PEFS-3组分,用色谱纯甲醇溶解,再用0.45μm微孔滤膜过滤,制成澄清透明的液体,用于LC-MS分析。
色谱条件:流速0.3mL/min;进样体积:0.3μL;检测波长:200~400nm;色谱柱:Waters Acquity UPLC BEH Shield RP C18柱(100mm×2.1mm,1.7μm);柱温:45℃;样品温度20℃;流动相:乙腈/0.1%甲酸;梯度洗脱:0~8min,乙腈10%~60%;8~15min,60%~100%。
质谱条件:离子源:ESI电离源;电喷雾离子化负离子采集模式(ESI-);m/z范围:50~1000;毛细管电压:3.0kV;锥孔电压:20.0V;碰撞能量:4.0eV,离子源温度:100℃;脱溶剂温度:400℃。
2 结果与讨论
2.1芦丁标准曲线的绘制
以芦丁溶液浓度为横坐标x,吸光值为纵坐标y,绘制标准曲线。标准曲线为:y=11.4572x-0.0023,R2= 0.9995。
2.2黄酮对α-葡萄糖苷酶的抑制作用
通过实验结果表1可知,使用不同极性的溶剂分级萃取提取液,随着萃取溶剂极性变大,黄酮类化合物的含量逐渐升高,但对α-葡萄糖苷酶的抑制作用无明显规律,可能是因为样品中总黄酮含量较低,其中富含的多糖、皂苷等也起到了一定的作用。其中,正丁醇层的总黄酮含量最高,可知使用正丁醇能充分地富集油菜蜂花粉中的黄酮类化合物。
样品经AB-8大孔吸附树脂进行纯化后,得到的PEFS-1组分、PEFS-2组分、PEFS-3组分总黄酮含量明显提高,并且对α-葡萄糖苷酶的抑制程度与各组分总黄酮含量呈正相关,因此,可认为当油菜蜂花粉提取分离物中总黄酮含量达到一定程度后,对α-葡萄糖苷酶起到主要抑制作用的活性因子为黄酮类物质。PEFS-3组分含量为68.77%,IC50为72.16μg/mL,远小于阿卡波糖的IC50(1124.84μg/mL),表明其抑制效果强于阿卡波糖。
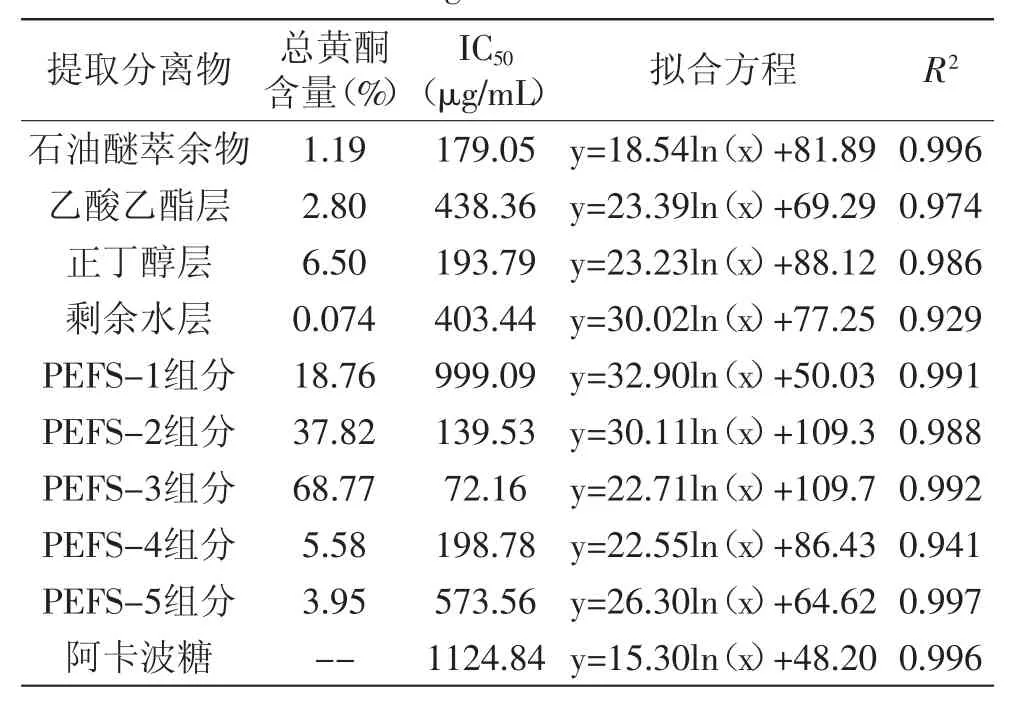
表1 不同含量的黄酮对α-葡萄糖苷酶的抑制作用Table 1 The inhibitory effect of flavonoids in different purity on α-glucosidase
2.3黄酮类物质的IR检测

图1 黄酮的红外光谱图Fig.1 IR Spectrum of flavonoids
由图1可知,3422.83cm-1处宽而强的吸收峰是黄酮类物质中酚羟基或者杂质糖中的羟基的伸缩振动峰,信号值较强说明羟基数目较多;2927.80cm-1处的弱吸收峰是芳环上碳氢键的伸缩振动峰,信号值较弱表明饱和碳上的氢较少;1646.65cm-1处出现羰基的特征吸收峰,这是由于其伸缩振动引起的,信号值强说明伸缩振动较强;1384.36、1155.99、1080.68、1021.51cm-1是碳氧键的伸缩振动峰,信号值较强;1000~600cm-1之间的峰是苯环上取代基位置引起的特征吸收峰[16-18]。
2.4黄酮类物质的LC-MS检测
黄酮类化合物是具有两个苯环(A-环与B-环)通过中央三碳相互连接而成的C6-C3-C6基本结构的天然产物。由于它们的结构特点使得多数黄酮类化合物在紫外区300~350nm和240~285nm有两个特征吸收峰[17-18]。如图2和图3所示,经AB-8纯化的提取液主要含有5种化合物,前4种化合物在284nm和350nm处都有特征吸收峰,可能为黄酮类物质,第5种化合物仅在284nm处有特征吸收峰,可能是异黄酮或二氢黄酮(醇)。

图2 PEFS-3组分的液相图Fig.2 HPLC diagram of PEFS-3
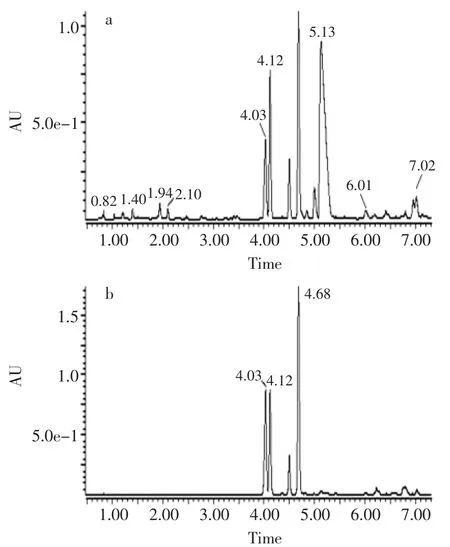
图3 PEFS-3组分在284nm(a)和350nm(b)处的液相图Fig.3 HPLC diagram PEFS-3 at 284nm(a)and 350nm(b)
实验利用飞行时间质谱对液相色谱图中出峰的5种主要物质进行了研究,分别得到其1、2级质谱图(图4~图8)。其化合物1~4的MS图中分子离子峰及特征峰明显,主要是分子离子丢失1个和2个葡萄糖的碎片离子峰,根据阿布拉江·克依木[19]、郭娟丽[20]及本课题组之前的研究报告[13],分析结果如表2所示。
对于化合物5,1级质谱给出准分子离子峰[M-2H]-436.1814,可知该化合物的分子量为438;2级质谱给出[M-2H]-丢失1个葡萄糖的碎片离子峰[(M-3H)-162]-273.1564,推断可能为亥茅酚苷[21-23]或黄烷醇[17]。杨洁[24]、邢建军等[25]也曾从油菜蜂花粉中提取得到该物质,推断为黄酮苷类,并未做出具体判断。目前也鲜有关于从油菜蜂花粉中分离得到亥茅酚苷的报道,具体结果有待进一步研究。

表2 样品的质谱分析结果Table 2 Analysis results of the sample obtained by MS

图4 化合物1的质谱图及结构式Fig.4 The mass spectrum and structural formula of compound 1
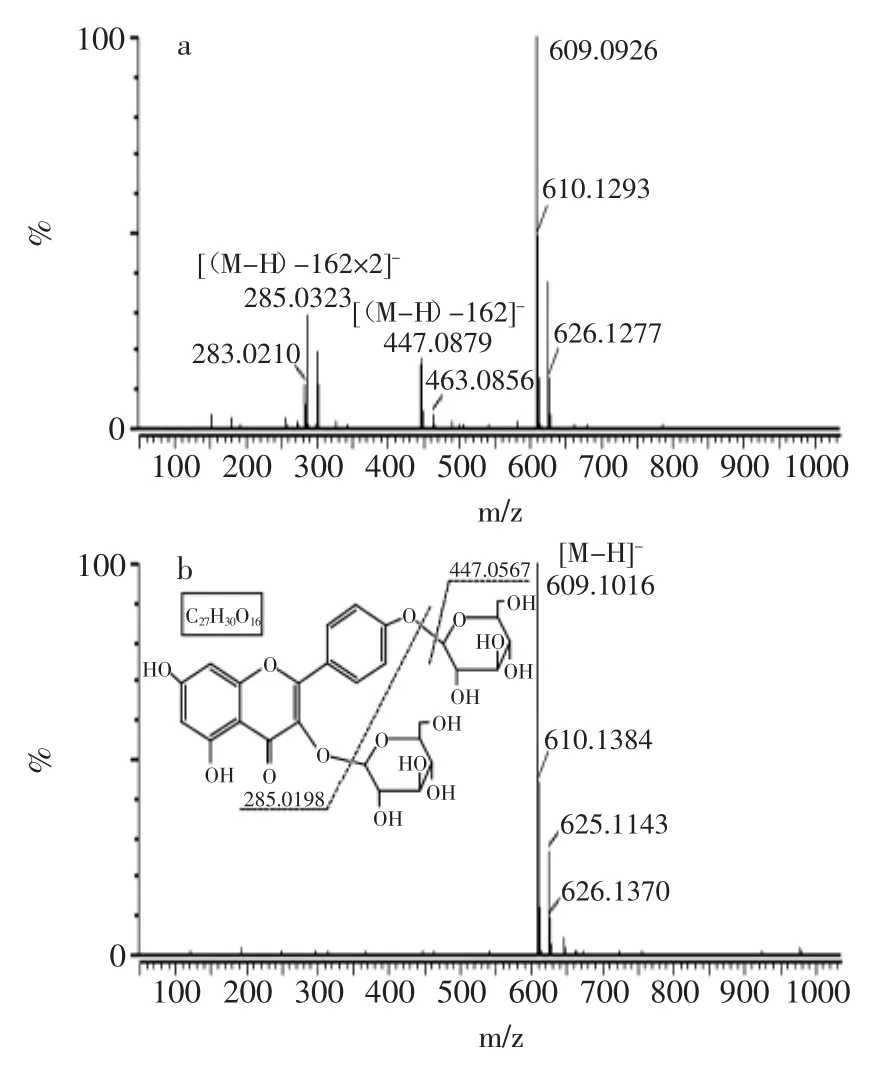
图5 化合物2的质谱图及结构式Fig.5 The mass spectrum and structural formula of compound 2

图6 化合物3的质谱图及结构式Fig.6 The mass spectrum and structural formula of compound 3

图7 化合物4的质谱图及结构式Fig.7 The mass spectrum and structural formula of compound 4

图8 化合物5的质谱图及结构式Fig.8 The mass spectrum and structural formula of compound 5
3 结论
结果表明,正丁醇对油菜蜂花粉黄酮有很好的富集作用;当油菜蜂花粉总黄酮含量达到一定值后,黄酮类物质在抑制α-葡萄糖苷酶活性中起主要作用;AB-8大孔树脂纯化得到的PEFS-3组分总黄酮含量为68.77%,IC50为72.16μg/mL,远小于阿卡波糖的IC50,表明其抑制效果强于阿卡波糖。
利用IR和LC-MS对PEFS-3组分的化学成分进行分析,共推断出5种主要物质,其中4种为槲皮素-3-O-β-D-吡喃葡萄糖基-(1→2)-O-β-D-吡喃葡萄糖苷、山奈酚-3,4’-双-O-β-D-吡喃葡萄糖苷、异鼠李素-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷、山奈酚-3-O-β-D-吡喃葡萄糖基-(1→2)-β-D-吡喃葡萄糖苷,第5种推断为亥茅酚苷或黄烷醇,因目前还未见关于从油菜蜂花粉中分离得到亥茅酚苷或符合该质谱裂解规律的黄烷醇的报道,具体结果还有待进一步研究。
[1]肖更生,万利秀,徐玉娟,等.柑橘皮黄酮降血糖作用的研究[J].现代食品科技,2013,29(4):698-799.
[2]孙佳明,宗颖,雷岱虹,等.甘草乙醇提取物的体外抑制α-葡萄糖、抗氧化活性及HPLC-MS分析[J].中成药,2013,35(9):1943-1946.
[3]罗明琽.桑叶有效部位降血糖作用与JNK信号通路的关系[D].广州:广州中医药大学,2013.
[4]陈丽华,潘自红,曹云丽,等.地榆中α-葡萄糖苷酶抑制活性因子的筛选[J].食品研究与开发,2013,34(9):30-36.
[5]张俊,何静,周锦云,等.胡柚中抑制α-葡萄糖苷酶活性组分的研究[J].中国食品学报,2013,13(2):79-82.
[6]崔秀月.降香乙酸乙酯部分黄酮化学成分及抑制α-葡萄糖苷酶活性研究[D].长春:吉林大学,2013.
[7]陈浩.普洱茶多糖降血糖及抗氧化作用研究[D].杭州:浙江大学,2013.
[8]常怡.苦瓜功能成分制备及降糖效果研究[D].长沙:湖南农业大学,2012.
[9]刘洋,周慧,刘舒,等.银杏叶中α-葡萄糖苷酶抑制剂的超滤质谱筛选[J].高等学校化学学报,2013,34(4):813-818.
[10]郭雪微,卢梃,鲍艳江,等.油菜蜂花粉黄酮类化合物抗氧化等作用的临床观察[J].北京中医药,2011,30(7):488-509.
[11]杨开.蜂花粉成分分析、功能物质提取和体外活性研究[D].杭州:浙江大学,2011.
[12]中国药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2010.
[13]孙岩,郭庆兴,童群义.油菜花粉的化学成分研究[J].食品与发酵工业,2014,40(10):238-244.
[14]中华人民共和国卫生部.GB5009.3-2010食品安全国家标准食品中水分的测定[S].北京:中国标准出版社,2010.
[15]苏尧尧,童群义.超声微波协同萃取垂柳叶中α-葡萄糖苷酶抑制剂的研究[J].食品工业科技,2014,35(2):235-238.
[16]侯留鑫,王华清,郑铁松,等.一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性[J].食品科学,2013,34(21):115-120.
[17]杨梅芳.柚子黄酮类物质提取、分离及生物特性研究[D].广州:华南理工大学,2013.
[18]宋佳.芦笋废弃物中黄酮化合物的纯化及其性质研究[D].无锡:江南大学,2012.
[19]阿布拉江·克依木.黄酮苷类天然产物的质谱分析方法研究[D].北京:中国协和医科大学,2003.
[20]郭娟丽,张培成,张智武.油菜花粉的化学成分研究[J].中国中药杂志,2009,34(10):1235-1237.
[21]Zhao-Guang Zheng,Ru-Shang Wang,Hui-Quan Cheng,et al.Isolated perfused lung extraction and HPLC-ESI-MSn analysis for predicting bioactive components of Saposhnikoviae Radix[J].Journal of Pharmaceutical and Biomedical Analysis,2011,54:614-618.
[22]Yu-Ge Gui,Rong Tsao,Li Li,et al.Preparative separation of chromones in plant extract of Saposhnikovia divaricata by high-performance counter-current chromatography[J].Journal of Separation Science,2011,34(5):520-526.
[23]Li Li,Yu-Ge Gui,Jiang Wang,et al.Preparative separation of chromones in plant extract of saposhnikovia divaricata by reverse-phase medium-pressure liquid chromatography and high performance counter-current chromatography[J].Journal of Liquid Chromatography&Related Technologies,2013,36(8):1043-1053.
[24]杨洁,陈纯,邢建军,等.油菜蜂花粉中黄酮类化合物的提取与鉴[J].食品科学,2010,33(22):273-278.
[25]邢建军,杨洁,郑国伟,等.XAD-2树脂对油菜蜂蜜中黄酮类物质分离条件的优化[J].中国蜂业,2010,61(12):9-12.
Study on hypoglycemic activities of flavonoids of Brassica napus L.bee pollen in vitro
SUN Yan1,GUO Qing-xing2,TONG Qun-yi1,*
(1.College of Food Science and Technology,Jiangnan University,Wuxi 214122,China;2.Anheuser-Busch InBev(Foshan)Brewery Co.,Ltd.,Foshan 528100,China)
The crude alcoholic extract of Brassica napus L.bee pollen was treated by solvent extraction and macroporous resin,and α-glucosidase inhibition test on the depurated flavonoids in vitro was carried out.The components which had the strongest inhibitory effect on α-glucosidase were analyzed by IR and LC-MS. Results showed that the flavonoids played a vital role in inhibiting α-glycosidase enzymes.The purity of PEFS-3 which was made by AB-8 macroporous resin was 68.77%,and its IC50was 72.16μg/mL,far less than the IC50of acarbose(1124.86μg/mL).Based on IR and LC-MS,five main components were identified in PEFS-3,and four kinds among them were flavonoid aglycones:Quercetin-3-O-β-D-pyranoid glucose base-(1→2)-β-D-pyranoid glycosidase,Kaempferol-3,4’-double-O-β-D-pyranoid glycosidase,Isohtamnetin-3-O-β-D-pyranoid glucose base-(1→2)-β-D-pyranoid glycosidase,Kaempferol-3-O-β-D-pyranoid glucose base-(1→2)-β-D-pyranoid glycosidase,and the fifth one was inferred to be sec-O-glucosylhamaudol or flavanol,its specific structure still need further confirmation.
Brassica napus L.bee pollen;α-glucosidase;flavonoids;LC-MS
TS201.1
A
1002-0306(2015)12-0122-05
10.13386/j.issn1002-0306.2015.12.017
2014-09-15
孙岩(1989-),女,硕士研究生,研究方向:碳水化合物科学与工程。
童群义(1963-),男,博士,教授,研究方向:碳水化合物科学与工程。

