桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性
钱 骅,赵伯涛,*,陈 斌,黄晓德,朱羽尧,吕 娟
(1.南京野生植物综合利用研究院,江苏南京210042;2.南京中医药大学,江苏南京210023)
桑黄子实体多糖、黄酮和多酚含量与抗氧化活性相关性
钱骅1,赵伯涛1,*,陈斌1,黄晓德1,朱羽尧1,吕娟2
(1.南京野生植物综合利用研究院,江苏南京210042;2.南京中医药大学,江苏南京210023)
探讨子实体抗氧化的物质基础。通过提取和萃取得到7种组分:水提物(WE)、醇提物(AE)、粗多糖(CP)、醇沉上清干物(RL)和二氯甲烷(MCE)、乙酸乙酯(EAE)、正丁醇(nBE)萃取物,采用FRAP值法测定体外抗氧化能力,分光光度法测定多糖、黄酮和多酚含量。结果表明:抗氧化活性物存在于醇提物中,抗氧化活性和多酚、黄酮含量有关,并呈线性正相关(R2为0.9977和0.9950),多糖在抗氧化中所起作用小,酚类、黄酮类为其主要抗氧化活性物质。
桑黄,抗氧化,多糖,多酚,黄酮,含量
桑黄(Phellinus linteus)功能性成分研究中,多糖抗肿瘤活性最受关注,其次为桑黄的抗氧化作用。体外实验桑黄多糖有自由基清除作用[1],粗多糖和纯化多糖有相似还原力[2-3],可增强体内抗氧化酶SOD活性[4],体内抗氧化活性增强与其免疫增强作用有关[5-6];桑黄黄酮、酚类物有自由基清除作用[7-8],子实体的黄酮含量及体外自由基清除活性均高于菌丝体[3,9],两菌株间抗氧化活性差异与菌株的酚类、黄酮类和多糖含量有关,酚类物质对抗氧化能力可能起着主要的贡献,其次黄酮类,多糖对抗氧化作用的影响最低[10],固体培养菌丝体的醇提物的清除自由基活性最好[11]。目前,桑黄的抗氧化活性成分研究主要集中在水溶性物质(如多糖类[1-2,12-13]和菌丝发酵上清液[7])和醇溶性组分[9-11,14-15](如黄酮类[8])及其他如桑黄色素[16]中,但桑黄多糖、黄酮和多酚含量与还原能力相关性研究报道尚少。
铁离子还原法(FRAP值法)测定还原力,实质上是间接反映活性物质的抗氧化性质,还原力越强其提供电子的能力越强,其供应的电子除了可使Fe3+还原为Fe2+外,也可与自由基反应,使自由基成为更稳定的物质,达到抗氧化目的,而且FRAP值法并非针对某一种自由基清除活性的体外抗氧化活性测定法[17]。
本文以还原力来评价活性物的抗氧化活性,探讨抗氧化活性与各活性成分含量的关系,以期为桑黄的功能性成分提取和桑黄保健产品的开发应用提供依据。
1 材料与方法
1.1材料与仪器
桑黄子实体PL1、桑黄子实体PL2购自亳州药材市场;三吡啶三吖嗪(tripyridyltripyridyl-triazine,即TPTZ) 纯度98%,购自Sigma公司;芦丁中国生物检验所;醋酸钠、冰醋酸、三氯化铁、七水硫酸亚铁、酒石酸钾钠、一水没食子酸、亚硝酸钠、硝酸铝均为分析纯。
752紫外可见分光光度计上海菁华科技仪器有限公司;旋转蒸发RE-52A上海亚荣生化仪器厂。
1.2实验方法
1.2.1样品制备桑黄子实体粉以80%乙醇(料∶液=1∶12.5,1∶10和1∶8)提取3次,2h/次,滤液减压浓缩(60℃/0.09MPa)、真空干燥(60℃/0.09MPa),得醇提物;残渣挥尽乙醇后,95℃水浸提2次(料∶液=1∶15和1∶10),3h/次,滤液减压浓缩至固含物为20%,得浓缩液。浓缩液真空干燥,得水提物。浓缩液70%乙醇沉淀,过滤,沉淀经真空干燥,得粗多糖;滤过液减压浓缩,真空干燥,得醇沉上清干物。
1.2.2萃取分别对醇沉上清干物和醇提物以料∶水=1g∶50mL溶解后,离心(4000r/min,15min)去沉淀,取上清液,依次分级萃取:先进行二氯甲烷等体积萃取,萃取3次后的萃余液进行乙酸乙酯萃取,乙酸乙酯萃余液进行正丁醇萃取,均等体积萃取3次,室温萃取,合并相同萃取液,分别进行常压(40℃,二氯甲烷)和减压(45℃/0.09MPa,乙酸乙酯和70℃/0.09MPa,正丁醇)浓缩,真空干燥,得干物质。
1.2.3测定方法
1.2.3.1抗氧化活性测定采用FRAP值法[17]:即利用Fe3+吡啶三吖嗪可被样品中还原物质还原为Fe2+形式,呈现出蓝色,并于593nm处有最大光吸收,根据吸光度大小计算样品抗氧化活性的强弱。
FeSO4标准曲线:在系列试管中,分别加入FRAP试剂3mL、系列浓度(50~1600μmol/L)的FeSO4标准溶液100μL(参比管以H2O代替FeSO4溶液)、300μL H2O,37℃保温10 min,测定OD593nm,以FeSO4(μmol/L)为横坐标,以OD593nm为纵坐标作标准曲线。以每100g提取物相当于FeSO4的微摩尔数为该提取物的FRAP值(μmol FeSO4/100g),FRAP值越大,由抗氧化物质还原的Fe2+越多,即该物质的抗氧化活性越强。阳性对照为抗坏血酸(VC)。
FRAP值计算:测定样液中OD593nm,由FeSO4标准曲线的回归方程求出反应体系中的FeSO4浓度(μmol/L)。FRAP值(FeSO4mmol/100g)=[反应体系FeSO4浓度(μmol/L)×样液稀释倍数/1000]/[样液浓度(g/L)/100]
1.2.3.2多酚含量测定采用酒石酸亚铁法[18]:分别取213.2μg/mL一水没食子酸溶液0、0.5、1.0、1.5、2.0、2.5mL于6支试管中,加水4mL,酒石酸亚铁液5mL, pH7.5缓冲液定容至25mL,摇匀,于540nm测定OD,以一水没食子酸浓度(μg/mL)为横坐标,OD540nm为纵坐标,作标准曲线。
多酚含量计算:测定样液中OD540nm,由一水没食子酸标准曲线的回归方程求出反应体系中的一水没食子酸浓度(μg/mL)。多酚含量(%)={〔反应体系中一水没食子酸浓度(μg/mL)×稀释倍数/1000〕/样液浓度(mg/mL)}×100
1.2.3.3黄酮含量测定采用亚硝酸钠-硝酸铝法[19]:分别取0.332mg/mL芦丁标准液0、0.2、0.4、0.6、0.8、1.0mL于6支试管中,加入5%NaNO20.3mL摇匀,静置6min;5%Al(NO3)30.3mL摇匀,静置6min;4%NaOH 4mL,H2O定容至15mL摇匀,静置12min,于504nm测定OD值,作标准曲线。
黄酮含量计算:测定样液中OD504nm,由芦丁标准曲线的回归方程求出反应体系中的芦丁浓度(μg/mL)。黄酮含量(%)={〔反应体系中芦丁浓度(μg/mL)×稀释倍数/1000〕/样液浓度(mg/mL)}×100
1.2.3.4总糖含量测定采用硫酸-苯酚法[20]:分别取0.1065mg/mL葡萄糖标准液0、0.2、0.4、0.6、0.8和1.0mL于6支试管中,分别加入1.0、0.0.8、0.6、0.4、0.2和0mL H2O,加5%苯酚1mL,浓H2SO45mL,摇匀,室温放置30min,于490nm处测OD,作标准曲线。
总糖含量计算:测定样液中OD490nm,由葡萄糖标准曲线的回归方程求出反应体系中的葡萄糖浓度(μg/mL)。总糖含量(%)={〔反应体系中葡萄糖浓度(μg/mL)×稀释倍数/1000〕/样液浓度(mg/mL)}×100
1.2.3.5还原糖含量测定采用3,5-二硝基水杨酸法[21]:分别取0、0.2、0.4、0.6、0.8、1.0mL的1%葡萄糖溶液于6支试管中,补蒸馏水至2mL,分别依次加1.5mL DNS试剂,沸水浴5min后立即用冷水冷却,加蒸馏水补至10mL,在540nm处测吸光值,作标准曲线。
还原糖含量计算:测定样液中OD540nm,由葡萄糖标准曲线的回归方程求出反应体系中的葡萄糖浓度(μg/mL)。还原糖含量(%)={〔反应体系中葡萄糖浓度(μg/mL)×稀释倍数/1000〕/样液浓度(mg/mL)}×100
多糖含量计算:水提干物中多糖含量(%)=[(样品中总糖质量-样品中还原糖质量)/样品总质量]× 100=[(样品总质量×总糖含量(%)-样品总质量×还原糖含量(%))]/样品总质量×100;粗多糖样品的总糖含量(%)即为多糖含量(%)。
2 结果与分析
2.1标准曲线制作
根据1.2.2所作FeSO4、芦丁、一水没食子酸、总糖和还原糖标准曲线如图1所示。
2.2抗氧化活性的测定
各提取物抗氧化活性如表1所示,水提物、粗多糖、醇提物和醇沉上清干物均具有抗氧化活性,但与阳性对照VC相比,各提取物的抗氧化活性均较弱。提取物中抗氧化活性最强的是醇提物,如PL2和PL1醇提物分别为355.63和245.23mmol FeSO4/100g,相当于VC的35.6%和24.5%;在水提物、粗多糖、醇提物和醇沉上清干物中,PL2的抗氧化活性均高于PL1;在相同质量浓度下,抗氧化活性由大到小顺序为:醇提物>醇沉上清干物>水提取>粗多糖,即抗氧化活性物存在于醇溶性物中。

图1 标准曲线Fig.1 Standard curve
2.3提取物的黄酮、多酚和多糖含量测定
样品黄酮、多酚和多糖含量测定结果如表2所示,醇提物的黄酮、多酚含量均比醇沉上清干物中的高;PL2的醇提物和醇沉上清干物中黄酮、多酚含量比PL1高;品种间多糖含量差别较小,为5.5%~8.1%;提取物间多糖含量差异较大,如粗多糖中多糖含量比水提物的多糖含量高27.3%~30.5%。
2.4提取物的抗氧化活性与活性物质含量
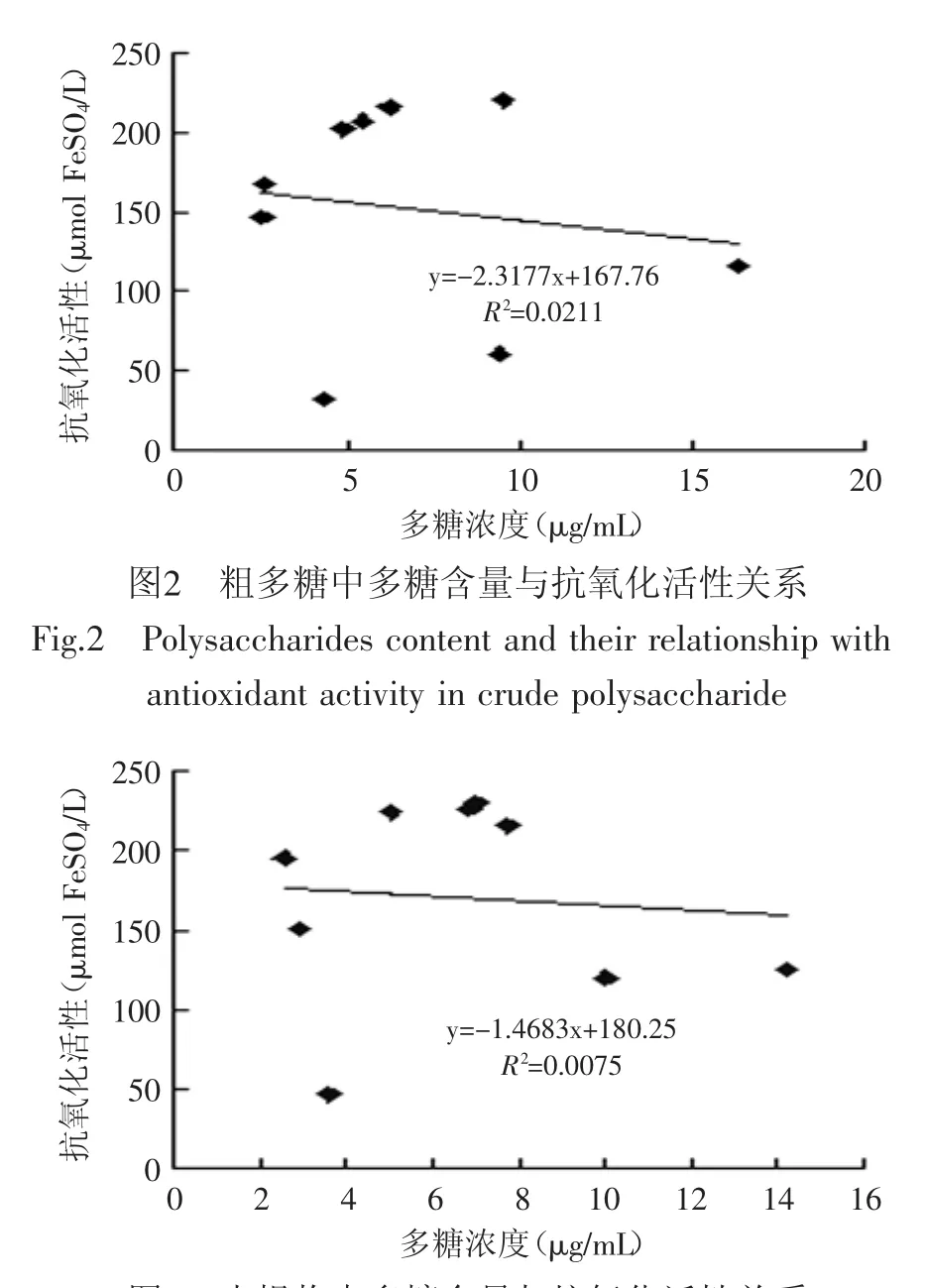
图3 水提物中多糖含量与抗氧化活性关系Fig.3 Polysaccharides content and their relationship with antioxidant activity in water extract
图2和图3可见,粗多糖和水提物中多糖浓度与抗氧化活性不呈正线性相关,其抗氧化活性并未随着多糖浓度的增加而增大;也不呈对数、指数和乘幂相关性(相关系数依次分别为0.1170、-0.0911、-0.1013和0.0013、-0.0713、-0.0752)。在相同质量下,水提物的抗氧化活性高于粗多糖(表1),但粗多糖样品中的多糖含量比水提物样品中的多糖含量高(见表2)。上述结果表明水提物和粗多糖中多糖含量与抗氧化活性无相关性。
图4和图5可见,多酚和黄酮含量与抗氧化活性均具有线性正相关性,抗氧化活性均随着浓度的增加而增加;但比较相同的抗氧化活性时,多酚作用浓度低于黄酮作用浓度,如抗氧化值均为58μmol FeSO4/L时,多酚含量为1.49μg/mL,而黄酮含量为3.34μg/mL。这一相关性在品种间也存在,PL2的多酚和黄酮含量均比PL1高,其抗氧化活性PL2也比PL1高(表1和表2)。
2.5萃取物的抗氧化活性及活性成分含量
利用溶剂的极性梯度进行液-液萃取,以使桑黄子实体提取物中的抗氧化成分按极性分布。表3为各萃取物的抗氧化活性测定结果,抗氧化成分主要集中在乙酸乙酯萃取物中,如醇提物中乙酸乙酯萃取物抗氧化活性比萃取前增加了3倍,而黄酮和多酚比萃取前分别增加了22.15%和11.71%。醇提物的乙酸乙酯萃取物中黄酮和多酚总含量为69.95%。
图6为醇提物中各萃取物配成相同质量浓度梯度下所测得的抗氧化活性,各萃取物均随浓度的增加,其抗氧化活性增加,且均呈线性正相关;在相同质量浓度下,抗氧化活性由大到小顺序为:乙酸乙酯萃取物>萃取前样品>二氯甲烷萃取物>正丁醇萃取物。
结合图6和表3可知,在同一提取物如醇提物和醇沉上清干物中,各萃取物的黄酮和多酚含量分布与抗氧化活性趋势一致,即黄酮和多酚含量由大到小顺序为:乙酸乙酯萃取物>萃取前样品>二氯甲烷萃取物>正丁醇萃取物。
综上所述,多酚类和黄酮类是桑黄子实体抗氧化的主要功效成分。
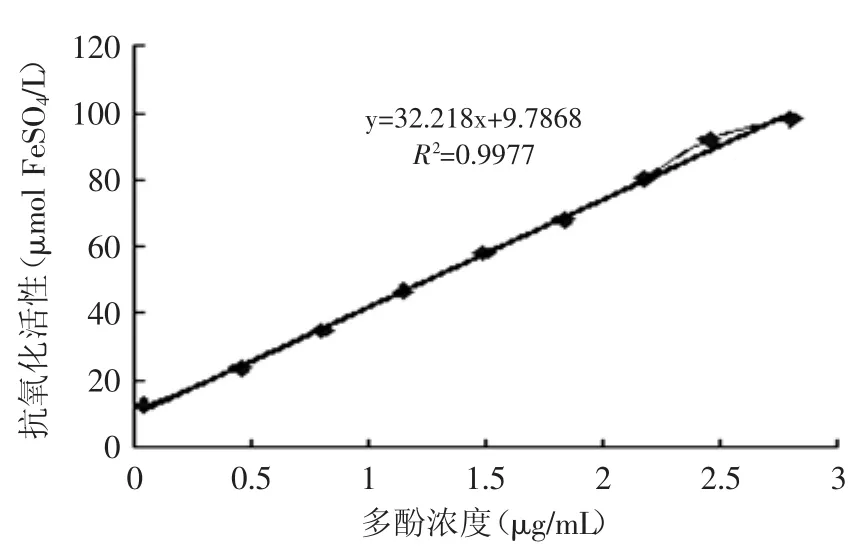
图4 醇提物中多酚含量与抗氧化活性关系Fig.4 Polyphenols content and their relationship with antioxidant activity in alcohol extract

图5 醇提物中黄酮含量与抗氧化活性关系Fig.5 Flavonoids content and their relationship with antioxidant activity in alcohol extract

图6 萃取物抗氧化活性的浓度梯度曲线Fig.6 The curve of concentration gradient of antioxidant components in extracts
表1 提取物的抗氧化活性(±sD,n=3)Table 1 The antioxidative activity of extracts(±sD,n=3)

表1 提取物的抗氧化活性(±sD,n=3)Table 1 The antioxidative activity of extracts(±sD,n=3)
样品 水提物 粗多糖 醇提物 醇沉上清干物 VCPL1 PL2 PL1 PL2 PL1 PL2 PL1 PL2FRAP(mmol FeSO4/100g) 120.71±1.63 124.12±2.45 43.45±2.75 61.64±3.01 245.23±5.96 355.63±7.61 226.43±4.89 242.61±7.63 1000.0±10.59
表2 提取物黄酮、多酚和多糖含量(%±SD,n=3)Table 2 The content of flavonoids,polyphenols and polysaccharides in extracts(x%±SD,n=3)

表2 提取物黄酮、多酚和多糖含量(%±SD,n=3)Table 2 The content of flavonoids,polyphenols and polysaccharides in extracts(x%±SD,n=3)
样品 水提物 粗多糖 醇提物 醇沉上清干物PL1 PL2 PL1 PL2 PL1 PL2 PL1 PL2黄酮含量 34.41±1.74 39.55±2.56 16.61±1.46 22.36±2.10多酚含量 17.35±2.26 19.37±1.87 9.02±3.02 12.64±2.64多糖含量 15.36±2.42 16.61±1.63 20.04±2.75 21.15±3.12
表3 萃取物的抗氧化活性和黄酮、多酚含量(±sD,n=3)Table 3 The antioxidant activity and the content of flavonoids and polyphenols in extracts(±sD,n=3)

表3 萃取物的抗氧化活性和黄酮、多酚含量(±sD,n=3)Table 3 The antioxidant activity and the content of flavonoids and polyphenols in extracts(±sD,n=3)
指标 醇提物 醇沉上清物 VC萃取前 二氯甲烷 乙酸乙酯 正丁醇 萃取前 二氯甲烷 乙酸乙酯 正丁醇FRAP值(mmol FeSO4/100g)355.63±7.61 183.45±3.24 1442.96±2.45 69.43±3.56 242.61±7.63 117.43±3.47 850.02±4.63 56.60±6.24 1000.0±10.59黄酮含量(%) 39.55±2.61 9.66±1.52 48.31±3.23 3.6±1.20 22.36±2.56 5.2±1.06 42.28±3.58 5.1±1.15多酚含量(%) 19.37±2.15 5.3±1.29 21.64±2.08 1.5±1.17 12.64±1.35 2.42±1.12 21.36±2.87 2.3±1.46
3 结论与讨论
桑黄子实体的水提物、粗多糖具有一定的抗氧化活性,但与醇提物和醇沉上清干物相比,它们的抗氧化活性低,相同质量浓度下,抗氧化活性由大到小顺序为:醇提物>醇沉上清干物>水提取>粗多糖,即抗氧化活性物存在于醇提物中;多糖浓度与抗氧化活性不呈正线性相关。
植物的抗氧化活性与黄酮、多酚含量相关性报道的文献有[10,22-24],本实验得到结果与文献[10]有相似之处,即多酚、黄酮类物质在抗氧化中起主导作用,多糖在抗氧化中所起作用小。多酚和黄酮含量与抗氧化活性均呈线性正相关,R2分别为0.9977和0.9950,这点与文献[22,24]抗氧化能力与总酚含量正相关,与黄酮含量相关性不明显有别。多酚抗氧化活性与酚羟基数目和酚羟基的位置有关[25],不同黄酮类物质抗氧化活性是否也有差异有待探讨。桑黄多酚、黄酮含量与抗氧化活性曲线中,比较相同的抗氧化活性时,黄酮含量高于多酚含量,这是否意味着等质量的多酚比黄酮对抗氧化活性贡献大有待进一步探讨。
在相同质量浓度下,各萃取物的抗氧化活性由强至弱依次为:乙酸乙酯>萃取前>二氯甲烷>正丁醇;各萃取物抗氧化活性均随浓度的增加而增加,均呈线性正相关;各萃取物的黄酮和多酚含量分布与各萃取物的抗氧化活性趋势一致,乙酸乙酯萃取物中黄酮和多酚总含量最高达69.95%。
综上所述,多酚类物质和黄酮类化合物是桑黄子实体抗氧化性的主要功效成分。
[1]严红实,金乾坤,李鹏飞,等.桑黄多糖的提取及抗氧化性研究[J].食品科技,2013(6):201-205.
[2]谢丽源,张勇,彭卫红,等.桑黄胞内多糖免疫及抗氧化活性研究[J].食品科学,2011,32(9):276-281.
[3]郝瑞霞,周帅,杨焱,等.不同来源的桑黄子实体醇提物中黄酮含量及生物活性的比较[J].食用菌学报,2008,15(2):23-26.
[4]郑立军,沈业寿,季俊虬,等.桑黄胞内多糖的抗突变和抗氧化作用[J].癌变.畸变.突变,2006,18(6):465-468.
[5]郑立军,沈业寿,季俊虬,等.桑黄胞外多糖药理活性的初步研究[J].食品科学,2007,28(1):318-321.
[6]郑媛,沈业寿.桑黄胞内多糖抗衰老作用的研究[J].中国食用菌,2006,25(3):38-41.
[7]管国强,张玲,黄达明,等.桑黄深层发酵上清液抗氧化活性的研究[J].食品工业科技,2008,29(12):106-108.
[8]回晶,李其久,边媛媛,等.桑黄总黄酮超声提取工艺及其生物活性研究[J].食品科学,2010,31(24):195-198.
[9]吴娜,王钦博,冯娜,等.鲍姆木层孔菌子实体与菌丝体醇提物抗氧化活性的比较[J].食用菌学报,2013,20(1):70-74.
[10]谢丽源,甘炳成,彭卫红,等.抗氧化桑黄真菌筛选及抗氧化能力评价[J].西南农业学报,2014,27(4):1453-1458.
[11]邵倩,张忠,唐传红,等.鲍姆木层孔菌米饭固体发酵条件优化及不同提取方法醇提物的抗氧化活性[J].食用菌学报,2014,21(2):67-70.
[12]程伟.桑黄子实体多糖的提取、纯化与体外抗氧化活性研究[D].西安:陕西科技大学,2013.
[13]张媛.几种“桑黄”类真菌子实体多糖的分离纯化与生物活性研究[D].长春:吉林农业大学,2013.
[14]胡金霞,杨焱,张劲松,等.桑黄醇提物抗氧化和保护神经细胞损伤的研究[J].上海农业学报,2009,25(2):58-61.
[15]汪雯翰,张劲松,杨焱,等.桑黄等十种食药用菌抗氧化和延缓衰老功效的比较研究[J].天然产物研究与开发,2013(8):1027-1032.
[16]何培新,张迎春.火木层孔菌菌丝体胞内色素提取与抗氧化活性初探[J].食品科技,2010,35(4):215-217.
[17]Benziei F F,Strain J J.The ferric reducing ability of plasma(FRAP)as a measure of antioxidant powerd[J].Analytical biochemistry,1996,23(9):70-76.
[18]杜淑霞,欧仕益,徐丽,等.奶茶中茶多酚含量测定方法的改进[J].食品工业科技,2010,31(4):358-361.
[19]刘艳芳,杨焱,贾薇,等.药用真菌桑黄总黄酮测定方法研究[J].食用菌学报,2006,13(2):45-48.
[20]钟方晓,任海华,李岩.多糖含量测定方法比较[J].时珍国医药,2007,18(8):1916-1917.
[21]蔡武城,袁厚积.生物化学实验技术丛书.生物物质常用化学分析法[M].北京:科学出版社,1982:8-9.
[22]陈莺莺,陈炳华,赖京菁,等.不同寄主红花寄生叶提取物抗氧化能力的研究[J].福建师范大学学报:自然科学版,2011,27(2):94-100.
[23]杨文建,李大鹏,李金奎,等.热处理对何首乌抗氧化能力的影响[J].食品与发酵工业,2008,34(11):61-65.
[24]赵国玲,刘承初,谢晶,等.坛紫菜不同溶剂组分的抗氧化活性[J].食品科学,2010,31(17):186-191.
[25]Lucrecia L C,Monica A N.New method to determine antioxidant activity of polyphenols[J].Food Chemistry,2006(54):8397-8402.
Relationship between the content of polysaccharides,flavonoids and polyphenols from the sporocarp of Phellinus linteus and the antioxidant activity
QIAN Hua1,ZHAO Bo-tao1,*,CHAN Bin1,HUANG Xiao-de1,ZHU Yu-yao1,LV Juan2
(1.Nanjing Institute for Comprehensive Utilization of Wild Plants,Nanjing 210042,China;2.Nanjing University of Chinese Medicine,Nanjing 210023,China)
To evaluate the antioxidant activity of active compounds in phellinus linteus,ferric reducing ability of plasma(FRAP)was used to evaluate the antioxidant activity,spectrophotography was used to determine the content of polysaccharides,flavonoids and polyphenols in seven extracts(water extract,alcohol extract,crude polysaccharide,residual liquid after alcohol sink and methylene chloride,ethyl acetate,n-butanol extracts respectively).The results showed that,the antioxidant components were found in alcohol-soluble part,the antioxidant activity appeared positive correlation with the content of polyphenols and flavonoids(R2=0.9977 and 0.9950 respectively),polysaccharides played a less significant role than that of polyphenols and flavonoids,polyphenols and flavonoids were the main antioxidant components.
Phellinus linteus;antioxidant;polysaccharide;polyphenol;flavonoid;content
TS255.1
A
1002-0306(2015)12-0104-05
10.13386/j.issn1002-0306.2015.12.014
2014-10-13
钱骅(1966-),女,硕士研究生,研究员,主要从事植物资源、植物生理等方向的研究与开发工作。
赵伯涛(1962-),男,本科,研究员,主要从事植物资源评价与植物化学方面的研究。
国家高技术研究发展计划(863计划)(2012AA021701)。

