不同方法制备的党参复方多糖的抗氧化活性研究
刘超,张曜武
(青岛科技大学化工学院,山东青岛266042)
不同方法制备的党参复方多糖的抗氧化活性研究
刘超,张曜武
(青岛科技大学化工学院,山东青岛266042)
目的:对不同方法制备的党参复方多糖的抗氧化活性进行研究,并对多糖纯化程度与其活性的相关性进行探索。方法:采用膜分离工艺制备党参复方总多糖,并对得到的总多糖进行脱蛋白、脱色等不同方法的纯化,测定各多糖产物的还原能力、清除羟基自由基、DPPH·自由基及超氧阴离子自由基的能力。结果:不同方法制备的三种党参复方多糖样品均呈现体外抗氧化活性,并且具有良好的量效关系;总多糖经脱蛋白、脱色等纯化步骤后体外抗氧化活性减弱。结论:该党参复方总多糖具有较好的体外抗氧化活性,制备活性多糖时,不应盲目脱蛋白、脱色。
党参复方;多糖;纯化;抗氧化;自由基
多糖在自然界中广泛存在,是构成生命的基本生物大分子之一。近年来,从天然产物中提取得到的多糖在生物活性方面引起关注[1]。现有研究表明,多糖在免疫调节、细胞识别、细胞间物质运输等方面起到重要作用,具有增强免疫功能、抗病毒、抗肿瘤等多种生物活性[2~4]。除上述之外,现有研究还发现许多植物多糖对各种活性氧具有清除作用,表现出多途经的抗氧化活性,有关植物多糖抗氧化作用的研究目前多侧重于单一药材的多糖成分[5,6],对中药复方多糖成分抗氧化活性的研究鲜有报道[7]。
党参是中医临床常用的滋补药材,药理学研究发现党参具有抗肿瘤、抗氧化等多种生物活性[8,9],党参与其它中药配伍组成复方使用要比单味党参药材的应用在中医临床中更为多见。本实验对党参复方多糖的抗氧化活性进行研究,并对党参复方多糖的纯化程度与其活性的关系进行探讨,对不同纯化步骤制备的三种党参复方多糖样品的还原能力、清除·OH自由基、DPPH·自由基和·自由基能力进行测定,并对总多糖经脱蛋白、脱色等纯化前后的活性差异进行比较,在确认本实验所用的党参复方多糖是否具有抗氧化活性的同时,对多糖纯化程度与其活性的相关性进一步积累规律性认识,并为中药复方多糖的活性研究提供参考依据。
1 实验部分
1.1试剂与仪器
磷酸二氢钠、磷酸氢二钠、铁氰化钾、乙醇(95%)、三氯乙酸、水杨酸、硫酸亚铁、双氧水、三氯化铁、DPPH、邻苯三酚、抗坏血酸等均为分析纯。
UV-1000紫外分光光度仪(北京莱伯泰科仪器有限公司);RE-52旋转式蒸发仪(上海亚荣生物仪器厂);FA1004N分析天平(上海精密科学仪器有限公司);中空纤维膜组件(天津膜天膜科技股份有限公司);GZX-9240MBE数显鼓风干燥箱(上海博讯实业有限公司医疗设备厂);TDL-802B台式离心机(上海安亭科技仪器厂);SHB-Ⅲ型循环水式多用真空泵(郑州长城科工贸有限公司)。
1.2党参复方多糖的制备
取党参、黄精、三七等药材粉碎,加水煎煮,煎液浓缩、过滤,所得滤液进行活性炭吸附、微滤等处理后,再用截留相对分子质量为6kDa的超滤膜分离,渗出液经浓缩、醇沉、干燥得膜分离工艺总多糖。此后采用木瓜蛋白酶结合Sevage法脱蛋白,脱蛋白后的样品液经醇沉、干燥得脱蛋白多糖。再经D101大孔树脂吸附脱色,静态吸附4h,抽滤,滤液醇沉、干燥得脱蛋白脱色多糖。
1.3抗氧化活性
1.3.1还原能力测定
精密量取1mL不同质量浓度的多糖样品液,加入2.5mL磷酸盐缓冲液(0.2mol/L,pH7.4),2.5mL铁氰化钾溶液(1.0%),混合均匀后置于50℃恒温水浴中保温20min,取出,迅速冷却,加入2.5mL三氯乙酸溶液(10%),混合均匀,于3000r/min离心10min,吸取上清液2.5mL于另一试管中,加入2.5mL蒸馏水和0.5mL三氯化铁溶液(0.1%),混匀后静置10min,于700 nm处测定吸光度,吸光度值越大,表明其还原能力越强。以抗坏血酸Vc为对照。
1.3.2清除羟基自由基能力测定
反应体系中依次加入9×10-3mol/LFeSO4溶液1mL,9×10-3mol/L水杨酸-乙醇溶液1mL,及1mL不同质量浓度的多糖样品液,最后加6×10-3mol/LH2O21mL,启动反应,37℃水浴中反应0.5 h,在510nm下测定各样品的吸光度,空白组以相同体积蒸馏水代替样品溶液。以Vc作对照,按下式计算样品对·OH的清除率:
·OH清除率(%)=[A0-(AX-AX0)]/A0×100%
式中:A0:为空白对照液的吸光度;
AX:为加入红松松子壳多糖样品液后的吸光度;AX0:为不加H2O2时红松松子壳多糖溶液的本底吸光度。
1.3.3清除DPPH·能力测定
取不同质量浓度的多糖待测液2mL,分别加入1×10-4mol/L的DPPH·溶液2mL,摇匀,室温避光静置30min,以蒸馏水代替样品液为空白,在517nm处测定吸光度。以Vc为对照,按下式计算各个样品对DPPH·自由基的清除率(%):
DPPH·自由基清除率(%)=[A0-(Ai-Aj)/A0]×100%
式中:A0:蒸馏水加DPPH·溶液的吸光值;
Ai:多糖样品液加DPPH·溶液的吸光值;
Aj:多糖样品液的本底吸光值。
1.3.4清除超氧阴离子自由基能力测定
采用邻苯三酚自氧化法,取5mL浓度为0.05mol/L的Tris-HC1缓冲液(pH=8.2)于试管中,分别加入4mL不同质量浓度的样品液,置于25℃水浴中预热20min,再加1mL3mmol/L邻苯三酚溶液,混匀,25℃水浴反应4min,迅速加入1mL10mol/L的HCL终止反应,在325nm波长处测吸光度,以Vc为对照。按下式计算清除率:
式中:A0:为空白对照液的吸光度;
AX:为加入邻苯三酚样品液的吸光度;
AX0:为不加邻苯三酚样品液的本底吸光度。
2 结果与分析
2.1还原能力
一般情况下,还原能力可以间接反映抗氧化能力,党参复方多糖样品及Vc的还原能力测定结果见图1。由该图可知,党参复方多糖各样品均表现出较强的还原能力,其中总多糖的还原能力最强,脱蛋白多糖和脱蛋白脱色多糖的还原能力依次减弱,各多糖样品的活性均弱于Vc。在本实验浓度范围内,多糖浓度与其还原能力呈正相关。
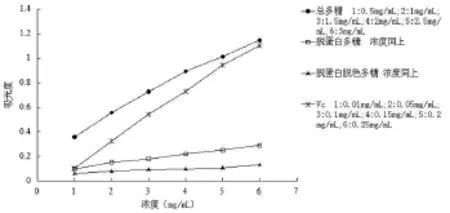
图1 样品和Vc的还原能力
2.2对·OH的清除作用
各样品对·OH的清除作用见图2,由图可知,随着多糖浓度的增加,各多糖样品清除·OH能力逐步增强,其中总多糖作用最强,经脱蛋白、脱色后其清除作用减弱。虽然该三种多糖样品的清除·OH活性弱于Vc,但仍表现出较好的清除作用。
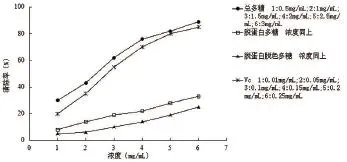
图2 样品和Vc对·OH的清除能力
2.3对DPPH·的清除作用
对DPPH·清除作用的测定结果如图3所示,由该图可知,各多糖样品清除DPPH·的作用趋势与上述清除·OH大致相同,总多糖活性最强,经脱蛋白、脱色等纯化后的多糖对DPPH·的清除作用减弱。在本实验浓度范围内,多糖浓度与DPPH·清除作用呈现明显的量效关系。
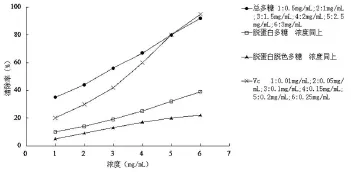
图3 样品和Vc对DPPH·的清除能力
2.4对超氧阴离子自由基的清除作用
对超氧阴离子自由基的清除作用如图4所示,由图可知,各多糖样品清除超氧阴离子自由基()的作用趋势与上述清除·OH和DPPH·大致相同,总多糖活性最强,经脱蛋白、脱色纯化后的多糖对超氧阴离子自由基的清除作用减弱。在本实验浓度范围内,随着多糖浓度增加清除作用逐渐增强。
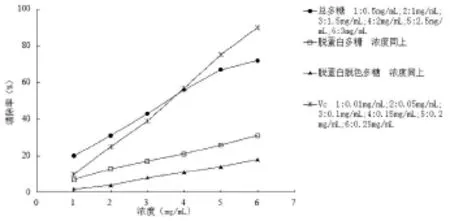
图4 样品和Vc对O-2·的清除能力
3 讨论
以上结果表明,从本实验所用的党参复方中提取的多糖成分经还原能力、清除·OH自由基、DPPH·自由基和O-2·自由基等多指标的测定,均呈现较好的体外抗氧化能力,不同纯化方法得到的党参复方多糖之间的抗氧化活性存在差异,膜分离工艺制得的总多糖的抗氧化活性最强,经脱蛋白、脱色等方法纯化后其多个指标的体外抗氧化活性均呈降低,由此推测党参复方多糖中与其共存的蛋白质、色素等成分可能与其活性相关。由本实验结果可知,党参复方多糖的活性随其纯化程度的增加而减弱。因此,当开发利用多糖的活性时,不应沿袭纯化学工作思路盲目进行脱蛋白、脱色。
综上可知,党参复方多糖的抗氧化活性,以及多糖活性与纯化程度的相关性值得关注,有必要进一步深入研究。与单味药材的多糖成分相比,中药复方中多糖成分的活性研究显著偏少,然而中药复方中的药材配伍使用,君臣佐使协同增效是中医药的重要特色和优势,因此重视复方活性成分的研究正是中药现代化研究和天然药材纯化学研究的本质区别,由此而言,中药复方中多糖成分或其它成分的活性研究意义更为突出,相关工作亟需加强。
[1]Yang Liqun,Zhang LiMing.Chemical structural and chain conformational characterization ofsome bioactive polysaccharides isolated from natural sources[J].Carbohydrate Polymers,2009,76(3):349-361.
[2]Hua Yanglin,Gao Qing,Wen Lingrong,eta1.Structural characterisation of acid and alkali-soluble polysaccharides in the fruiting body ofDictyophora indusiata and their immunomodulatory activi-ties[J].Food Chemistry,2012,132(2):739-743.
[3]Rhimou Bouhlal,Camille Haslin,eta1.Antiviralactivitiesofsulfatedpolysaccharidesisolatedfrom sphaerococcuscoronopifolius(Rhodophytha, Gigartinales) and Boergeseniellathuyoides(Rhodophyta,Ceramiales)[J].Marine Drugs,2011,9(7),1187-1209.
[4]Chen Ruizhan,Meng Fanlei,Liu Zhiqiang,etal.Antitumoractivities ofdifferentfractions ofpolysaccharide purified from Ornithogalum caudatum Ait[J].Carbohydrate Polymers,2010,80(3):845-851.
[5]黄六容,张笑宇,等.和田枣中黄酮与多糖的超声提取及抗氧化分析[J].湖北农业科学,2014,53(15):3606-3608.
[6]施晓丹,等.夏枯草水溶性多糖体外抗氧化活性研究[J].食品安全质量检测学报,2014,5(6):1596-1601.
[7]陈韩英,张波,刘雯霞,等.复方免疫散多糖及其拆方的体外抗氧化作用[J].华西药学杂志,2010,25(5):539-541.
[8]Ng T.B,LIU F,WANGH.X.The antioxidanteffects ofaqueousand organic extracts of Panax quinquefolium,Panax notoginseng,Codonopsispilosula,Pseudostellaria heterophylla and Glehnia littoralis[J].JournalofEthnopharmacology,2004,93(2/3):285-288.
[9]杨瑾,袁德培,等.板桥党参多糖抗肿瘤活性实验研究[J].湖北民族学院学报,2014,31(1):6-8.
Study on antioxidantactivity ofpolysaccharidesfrom compound codonopsispilosula produced by differentm ethods
LIU Chao,ZHANG Yao-wu
(CollegeofChemicalEngineering,Qingdao University ofScienceand Technology,Shangdong Qingdao 266042,China)
Objective:To study the antioxidant activities of Codonopsis pilosula compound polysaccharides prepared by differentmethods,and explore the relationship between polysaccharide purification and its activity. Methods:Codonopsis pilosula compound polysaccharideswere isolated bymembrane separation,purified furtherby removing the protein and pigment.The antioxidant activities ofall polysaccharide productswere investigated using various assays in vitro,including reducing power and scavenging ability on hydroxyl radicals,DPPH radicals,superoxide radicals.Results:All the polysaccharides prepared by differentmethods showed antioxidant activity in vitro and good dose-effect relationships.The antioxidant activity of total polysaccharides became weaker after purifing by deproteinization and decoloration.Conclusion:Codonopsis pilosula compound polysaccharides had better antioxidant activity in vitro.When preparing active polysaccharide,proteins and pigments shouldn’t be removed blindly.
codonopsispilosula compound;polysaccharide;purification;antioxidantactivity;free radical
10.3969/j.issn.1008-1267.2015.05.006
TQ224.6
A
1008-1267(2015)05-0019-04
2015-04-28
刘超(1988),女,硕士研究生,研究方向:天然产物提取分离和中药制剂现代化。

