IMP3、IGF2在人脑胶质瘤中的表达及与预后的关系☆
谢欣 易韦 于燕妮 陈祎 张著学 杨迎春 文安智 褚明亮
IMP3、IGF2在人脑胶质瘤中的表达及与预后的关系☆
谢欣*易韦*于燕妮△陈祎*张著学*杨迎春*文安智*褚明亮*
目的探讨胰岛素样生长因子IImRNA结合蛋白3(insulin-like growth factor-II mRNA-binding protein 3,IMP3)及胰岛素样生长因子-2(Insulin-like growth factor-2,IGF2)在胶质瘤中的表达及对临床预后的影响。方法 采用免疫组化S-P法检测171例脑胶质瘤组织及20例非瘤脑组织中IMP3、IGF2及Ki-67的表达情况;分析IMP3、IGF2及Ki-67表达强度间的相关性;Kaplan-Meier生存分析及多变量Cox比例风险回归模型分析胶质瘤患者生存状况的影响因素。结果 非瘤脑组织、胶质瘤组织中IMP3、IGF2和Ki-67的表达水平差异均有统计学意义(P均<0.05)。且胶质瘤组织中IMP3、IGF2蛋白及Ki-67表达均随肿瘤病理级别升高而增高(P均<0.05)。Spearman相关分析显示,IMP3、IGF2与Ki-67表达水平皆呈正相关,且IMP3蛋白的表达与IGF2蛋白的表达水平呈正相关(P均<0.05)。Kaplan-Meier分析结果显示IMP3、IGF2的表达与临床预后密切相关(P<0.05)。Cox比例风险回归模型分析示,肿瘤病理分级、IMP3、IGF2及Ki-67均为胶质瘤患者预后的独立危险因素(P均<0.05)。结论 IMP3和IGF2蛋白的表达与胶质瘤的组织病理分级、肿瘤细胞增殖及患者临床预后密切相关,针对二者的靶点治疗有望成为胶质瘤的有效治疗方案。
人脑胶质瘤 免疫组化 IGF2 IMP3 Ki-67
脑胶质瘤约占全部颅内肿瘤40%~50%[1]。成人发病率约为3/10万~6/10万,仅有5%的患者生存时间超过5年[2]。因其早期就已呈浸润性生长并向周围脑组织侵袭,手术难以完全切除,故术后多与放、化疗相结合,但治疗效果仍不乐观。胰岛素样生长因子IImRNA结合蛋白3(insulin-like growth factor-II mRNA-binding protein 3,IMP3)是癌胚mRNA结合蛋白,为VICKZ家族[3]成员,其在胚胎早期组织中高度表达,但于成人正常组织中表达极低。胰岛素样生长因子2(Insulin-like growth factor-2,IGF2)是一种胚胎生长因子,在胚胎时期高表达,出生后随即降低甚至消失[4]。在肿瘤发展中,IMP3是IGF-IImRNA的翻译激活子,通过上调IGF-IImRNA的翻译进而促进肿瘤细胞的增殖[5]。研究表明,IGF2为IMP3的作用靶点,其在胶质瘤发展中其转录水平无明显改变,仅在翻译水平上有所提高[6]。Ki-67与细胞增殖密切相关,是目前公认的可准确反映肿瘤细胞增殖活性状态的肿瘤增殖标志物之一[7]。本实验通过免疫组化检测胶质瘤组织中IMP3、IGF2蛋白及Ki-67的表达,探讨IMP3和IGF2蛋白的表达与胶质瘤病理分级、肿瘤细胞增殖及患者临床预后的关系。
1 资料与方法
1.1一般资料 收集2008年1月至2013年12月贵州省人民医院病理科胶质瘤石蜡组织标本171例,其中男105例,女66例。年龄6~75岁,中位年龄48岁。患者术前均未行放、化疗。按2007年WHO中枢神经系统肿瘤分级标准,分为低级别组(I-II级)77例,高级别组(III-IV级)94例。另取因脑血管畸形手术切除中的非瘤脑组织(白质)20例作为对照组。联系贵州省人民医院脑外科收集2012年至2013年临床胶质瘤患者65例临床资料进行随访,入组标准:胶质瘤初发病例,诊断明确,临床资料完整;手术镜下全切除;术后未行化疗。排除标准:确诊胶质瘤,同时患有其他系统严重疾病;胶质瘤组织石蜡标本过小的病例。随访内容包括:一般情况,临床症状,术后是否接受放疗、化疗,是否复发及复发后是否继续治疗。本实验获医学伦理委员会批准。
1.2免疫组化方法 采用S-P二步法检测低级别组、高级别组及对照组中IMP3、IGF2蛋白及Ki-67的表达情况,主要试剂:兔抗人IMP3多克隆抗体(工作浓度1:100)、兔抗人IGF2多克隆抗体(工作浓度1:100)、兔抗人Ki-67单克隆抗体(工作浓度1: 100)购自北京博奥森生物技术有限公司。以PBS代替一抗作为阴性对照,试剂公司提供阳性对照。
1.3结果判断 IMP3蛋白和IGF2蛋白阳性信号均定位在肿瘤细胞胞质内,为棕黄色颗粒。根据着色强度及阳性百分比进行评分[8]:无色为0分,淡黄色(弱阳性)为1分,棕黄色(中等强度)为2分,棕褐色(强阳性)为3分;阳性细胞≤10%为1分,>10%~50%为2分,>50%~75%为3分,>75%为4分。两者相乘为免疫组化半定量评价标准:0~2分为阴性(-),3~4分为弱阳性(+),5~6分为中等阳性(++),>6分为强阳性(+++),根据结果<4分为低表达,≥4分为高表达。Ki-67阳性着色定位于细胞核,着色棕黄色。以阳性细胞数≤5%为低增殖活性,>5%为高增值活性。
1.4随访方法 采用电话联系方式进行随访,截止时间2015年5月。总生存期计算从患者第一次手术时间开始到随访截止日期或患者死亡的日期为止。共获访65例,随访截止共有54例患者死亡,11例生存,无失访病例。
1.5统计学方法 采用SPSS19.0处理数据,差异性分析采用χ2检验,关联性分析采用Spearman等级相关分析,采用Kaplan-Meier生存分析及多变量Cox比例风险回归分析生存情况的影响因素,检验水准α=0.05。
2 结果
2.1IMP3、IGF2及Ki-67在胶质瘤组织和非瘤脑组织中的表达情况 IMP3、IGF2、Ki-67在20例非瘤脑组织中均有少量表达,三者在171例胶质瘤组织中阳性表达均明显高于非瘤脑组织中的阳性表达(χ2=5.326,χ2=7.425,χ2=5.326,P均<0.05)。
2.2IMP3、IGF2蛋白及Ki-67在低级别组和高级别组胶质瘤中的表达情况 胶质瘤组织中IMP3、IGF2蛋白及Ki-67表达均随肿瘤病理级别升高而增高(rs=0.522,rs=0.301,rs=0.538,P均<0.05),在低级别和高级别组中的表达差异均有统计学意义(χ2=18.93,χ2=4.395,χ2=16.19,P均<0.05,见表1)。

表1 各组IMP3、IGF2及K i-67的表达情况
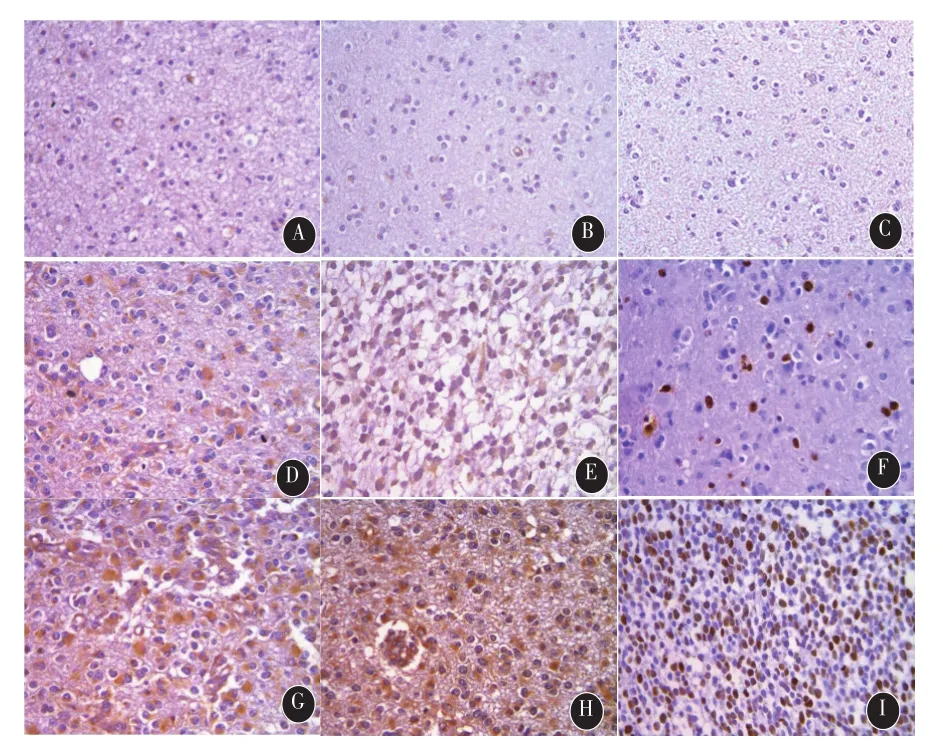
图1 免疫组化染色检测IMP3、IGF2和Ki-67在人脑胶质瘤中的表达(×400)。A:IMP3在非瘤脑组织中阴性表达;B:IGF2在非瘤脑组织中阴性表达;C:Ki-67在非瘤脑组织中阴性表达;D:IMP3在低级别胶质瘤中弱表达;E:IGF2在低级别胶质瘤中弱表达;F:Ki-67在低级别胶质瘤中的低表达;G:IMP3在高级别胶质瘤中高表达;H:IGF2在高级别胶质瘤中高表达;I:Ki-67在高级别胶质瘤中高表达
2.3IMP3、IGF2及Ki-67表达强度间的相关性分析 Spearman相关性分析显示,IMP3、IGF2与Ki-67表达水平皆呈正相关(rs=0.310,rs=0.228,P均<0.05),且IMP3蛋白表达与IGF2蛋白表达水平呈正相关(rs=0.203,P<0.05)。
2.4IMP3和IGF2表达对患者生存期的影响Kaplan-Meier生存分析显示,65例随访患者中,IMP3、IGF2高表达的患者总生存时间均显著低于低表达患者(Log-rank=10.088,Log-rank=9.958,P均<0.01,图2A,图2B)。且两者共同高表达的患者生存时间最短,较两者同时低表达者生存时间显著缩短(Log-rank=17.542,P<0.001),较两者单独高表达差异亦有统计学意义(Log-rank=5.987,Log-rank=5.731,P均<0.05,图2C)。
2.5Cox比例风险逐步回归分析影响胶质瘤预后的危险因素运用多变量Cox比例风险回归分析影响胶质瘤预后的危险因素显示,胶质瘤患者的预后与年龄和性别无关,与肿瘤病理分级、IMP3、 IGF2及Ki-67均有关(P均<0.05,见表2,表3)。
3 讨论
IGF2基因为内源性印记基因,其表达、调控不遵循孟德尔定律,正常情况下多为母源印记[9],即为父源等位基因表达。其基因的印迹丢失(Loss of impringting,LOI)已经在肺癌、结肠癌、乳腺癌等多种肿瘤中被发现,在IGF2转基因的小鼠中,这些肿瘤发生率是明显增高的[10]。本研究结果显示,IGF2蛋白在胶质瘤组织中阳性表达较高,明显高于在非瘤脑组织中的表达,且低级别组、高级别组中表达差异明显(χ2=4.395,P<0.05),与此同时,Spearman相关性分析也显示,IGF2蛋白阳性程度与胶质瘤级别呈明显正相关(rs= 0.301,P<0.05),这与王文斐等[11]的研究结果相一致,进一步提示IGF2蛋白的表达随肿瘤恶性程度的增高而增高,与胶质瘤的病理级别及肿瘤的发展密切相关,充分说明了IGF2对胶质瘤的发生、发展发挥一定的作用。

图2 胶质瘤组织中IMP3和IGF2蛋白表达与患者生存时间关系A:IMP3高表达患者生存时间明显低于低表达患者;B:IGF2高表达患者生存时间明显低于低表达患者;C:IMP3与IGF2共同高表达的患者生存时间明显低于其他各组

表2 Cox回归自变量赋值情况
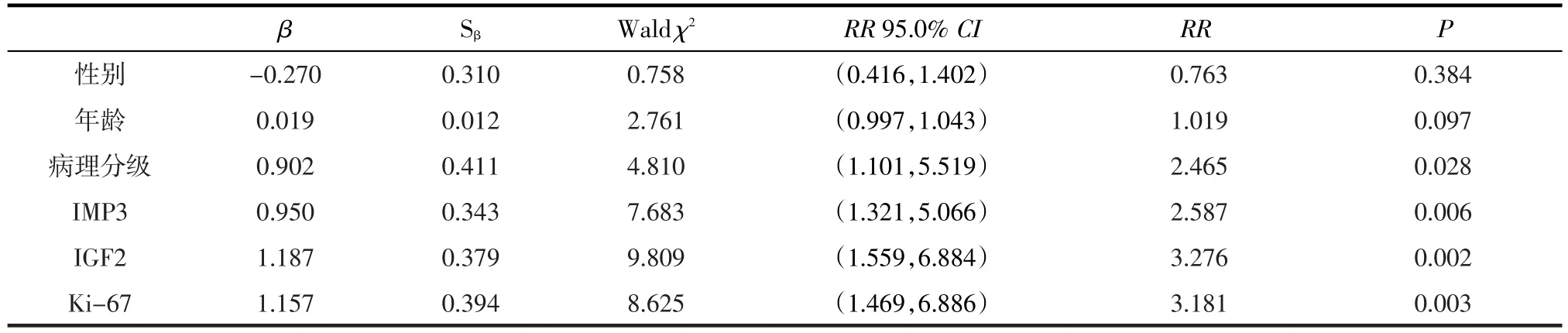
表3 Cox比例风险回归模型结果
IMP3基因编码产物可通过结合目的信使RNA如ACTB(β-Actin),IGF-2,MYC等调控RNA的转录以及转录后控制[12]。目前已有研究者在肺癌,宫颈鳞状细胞癌,肝细胞癌[13-15]等肿瘤组织中检测出IMP3的高表达。本研究亦显示,IMP3蛋白在胶质瘤组织呈高表达,明显高于非瘤脑组织中的阳性表达(χ2=5.326,P<0.05),在低级别组与高级别组中的表达有显著差异(χ2=18.93,P<0.001),提示IMP3在胶质瘤恶性增殖过程中起着重要作用,与胶质瘤的恶性转化有关,恶性程度越高其表达越强。据此认为,在胶质瘤的临床病理中,IMP3蛋白的检测有助于其临床辅助诊断。作IMP3与IGF2相关性分析发现,两者呈明显正相关,这在Suvasini等[6]研究的基础上,进一步佐证IMP2激活IGF2mRNA的机制。
Ki-67是一种核增殖抗原,本研究拟引用Ki-67作为肿瘤核增殖情况的判断指标。结果显示Ki-67的表达很好的反应了胶质瘤的增殖状态,其与胶质瘤恶性程度呈明显著正相关(rs=0.538,P<0.01),这与江晓珍等[16]研究结果相一致。同时,Spearman相关分析显示,IMP3、IGF2分别与Ki-67的表达水平呈明显正相关(rs=0.310,rs=0.228,P均<0.05),从而推测IMP3及IGF2蛋白的表达在肿瘤细胞核增殖中发挥重要作用。
胶质瘤术后易复发,预后不甚满意。随着对胶质瘤发生和进展相关的细胞信号传导通路的研究,小分子靶向药物治疗也逐渐被推上医疗前线。目前在GBM(glioblastoma)的临床靶向治疗领域中,贝伐株单抗被列为较为重要的药物应用于复发患者,特别是于病程较晚阶段使用,虽不能提高患者总体生存期,但可延长患者无进展生存期3~4月[17],对患者预后有一定影响。本研究Kaplan-Meier生存分析显示,IMP3及IGF2蛋白高表达的患者总生存时间均明显低于低表达的患者(Log-rank=10.088,Log-rank=9.958,P均<0.01)。联合IMP3和IGF2检测发现,二者同时呈高表达的患者生存时间最短,较两者单独低表达者有明显差异(P均<0.05)。进一步作多变量Cox比例风险回归分析结果显示IMP3、IGF2均为胶质瘤预后的独立影响因素(P均<0.05)。这些均充分说明IMP3和IGF2蛋白表达对胶质瘤患者预后有显著影响。同时本研究结果还显示,肿瘤病理级别和Ki-67的表达亦为胶质瘤患者预后的独立影响因素,这与文献报道相符[16]。
综上所述,IMP3和IGF2蛋白与胶质瘤的病理分级、肿瘤细胞增殖及预后关系密切,二者联合检测可能成为胶质瘤生物标记的新指标,可能成为胶质瘤基因治疗的潜在靶点,为临床制定更为合理和有效的治疗方案提供依据。
[1]Fabi A,Metro G,Russillo M,et al.Treatment of recurrent malignant gliomas with fotemustine monotherapy:impact of dose and correlation with MGMT promoter methylation[J].BMC Cancer,2009,31(9):101.
[2]Adair JE,Beard BC,Trobridge GD,et al.Extended survival of glioblastoma patients after chemoprotective HSC gene therapy[J].Sci Transl Med,2012,4(133):133-157.
[3]Yisraeli JK.VICKZ proteins:a multi-talented family of regulatory RNA-binding proteins[J].Biol Cell,2005,97(1):87-96.
[4]Malaguarnera R,Belfiore A.The emerging role of insulin and insulin-like growth factor signaling in cancer stem cells[J].Front Endocrinol(Lausanne),2014,5(5):10.
[5]Beljan PR,Durdov MG,Capkun V,et al.IMP3 can predict aggressive behaviour of lung adenocarcinoma[J].Diagn Pathol,2012,7(1):165.
[6]Suvasini R,Shruti B,Thota B,et al.Insulin growth factor-2 binding protein 3(IGF2BP3)is a glioblastoma-specific marker that activates phosphatidylinositol 3-kinase/mitogen-activated protein kinase(PI3K/MAPK)pathways by modulating IGF-2[J]. J Biol Chem,2011,286(29):25882-25890.
[7]姜振富,李梅,韦鸿,等.脑胶质瘤中Ki-67、Kras和Braf蛋白的表达及临床意义[J].现代肿瘤医学,2013,21(3):507-510.
[8]许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
[9]Dindot SV,Kent KC,Evers B,et al.Conservation of genomic imprinting at the XIST,IGF2,and GTL2 loci in the bovine[J]. Mamm Genome,2004,15(12):966-974.
[10]Sun FL,Dean WL,Kelsey G,et al.Transactivation of Igf2 in a mouse model of Beckwith-Wiedemann syndrome[J].Nature,1997,389(6653):809-815.
[11]王文斐,刘文庆,尚明华,等.胰岛素样生长因子-2在胶质瘤中表达的意义[J].宁夏医科大学学报,2014,36(10): 1076-1078.
[12]Li C,Zota V,Woda BA,et al.Expression of a novel oncofetal mRNA-binding protein IMP3 in endometrial carcinomas:diagnostic significance and clinicopathologic correlations[J].Mod Pathol,2007,20(12):1263-1268.
[13]Samanta S,Sharma VM,Khan A,et al.Regulation of IMP3 by EGFR signaling and repression by ERbeta:implications for triplenegativebreastcancer[J].Oncogene,2012,31(44):4689-4697.
[14]张亚军,蒋欣,江月,等.子宫颈鳞状细胞癌中IMP3表达与MVD的相关性分析[J].临床与实验病理学杂志,2014,31(44): 996-999.
[15]林黎娟,金政,林贞花,等.肝细胞癌组织中IMP3蛋白的表达及意义[J].临床与实验病理学杂志,2012,28(1):87-89.
[16]江晓珍,王小冰,邓葵,等.巨噬细胞移动抑制因子促进肿瘤进展并影响胶质瘤预后[J].中国神经精神疾病杂志,2013,39(4):236-240.
[17]Mannas JP,Lightner DD,Defrates SR,et al.Long-term treatment with temozolomide in malignant glioma[J].Journal of Clinical Neuroscience,2014,21(1):121-123.
Expressions of IM P3 and IGF2 in human brain glioma and their relationships w ith the prognosis.
XIE Xin,YI Wei,YU Yanni,CHEN Yi,ZHANG Zhuxue,YANG Yingchun,WEN Anzhi,CHU Mingliang.Department of Pathology,People's Hospital of Guizhou Province,Guiyang 550002,China.Tel:0851-85923917.
Objective To investigate the expression of IMP3 and IGF2 and their influence on the prognosis of human brain glioma.M ethods Expression of IMP3,IGF2 and Ki-67 protein was examined using S-P immunohistochemsitry in 171 cases of gliomas and 20 cases of normal brain tissues.Kaplan-Meier and multivariate analysis of Variance were used to analysis the survival rate of patients with gliomas.Results Positive Expression levels of IMP3,IGF2 and Ki-67 in glioma tissue were significantly higher than those in normal brain tissue(both P<0.05).The expression levels of IMP3,IGF2 and Ki-67 were positively correlated with the pathologic stage(P<0.05).Meanwhile,there was a significantly positive correlation between IMP3 and IGF2(rs=0.203,P<0.05).Further analysis of the results showed that both IMP3 and IGF2 positive expression levels were significantly associated with decreased overall survival(both P<0.05).Moreover,the expression of IMP3 and IGF2-positivity was a poor prognostic indicator for overall survival.Histological grading and expression of IMP3,IGF2 and Ki-67 were the independent risk factors of prognosis of gliomas(both P<0.05).Conclu-sion:IMP3 and IGF2 contribute to the progression of gliomas and influence the prognosis of patients with gliomas and the detection of IMP3 and IGF2 may be helpful to evaluate the course of disease and prognosis.They might be possible novel targets for molecular treatment of gliomas.
Glioma Immunohistochemistry IMP3 IGF2 Ki-67
R739.41
A
2015-06-18)
(责任编辑:甘章平)
10.3969/j.issn.1002-0152.2015.12.002
☆ 贵州省科技厅项目(编号:黔科合字LH[2014]7017号)资助
*贵州省人民医院病理科(贵阳 550002)
△贵州医科大学病理学教研室

