保加利亚乳杆菌与嗜热链球菌抗噬菌体菌株的原生质体制备及融合
王慕华,潘佩平,赵玉明,2,苏槟楠,蔡颖慧,李海涛,2
(1.山西省生物研究所,山西 太原 030006;2.山西维尔生物乳制品有限公司,山西 太原 030006)
保加利亚乳杆菌与嗜热链球菌抗噬菌体菌株的原生质体制备及融合
王慕华1,潘佩平1,赵玉明1,2,苏槟楠1,蔡颖慧1,李海涛1,2
(1.山西省生物研究所,山西 太原030006;2.山西维尔生物乳制品有限公司,山西 太原030006)
为获得具有抗噬菌体功能且发酵性能优良的乳酸菌融合子,采用单亲灭活及正交分析方法,研究了保加利亚乳杆菌与嗜热链球菌抗噬菌 体菌株的原生质体制备及融合条件。结果表明:保加利亚乳杆菌原生质体制备的最适条件是以磷酸盐缓冲液和甘露醇制作的高渗溶液为原生质体稳定剂,1.0 mg/mL的溶菌酶36 ℃处理30 min,原生质体的形成率为(89.02±2.31)%,再生率为(4.62±0.22)%。嗜热链球菌抗噬菌体菌株原生质体制备的最适条件是以Tris-HCl和蔗糖制作的高渗溶液为原生质体稳定剂,0.1 mg/mL的溶菌酶42 ℃处理30 min,原生质体的形成率为(99.15±0.23)%,再生率为(5.79±0.17)%。单亲灭活保加利亚乳杆菌与嗜热链球菌抗噬菌体菌株原生质体融合的最适条件为聚乙二醇6000(质量浓度为400 g/L,添加0.01 mol/L CaCl2、0.02 mol/L MgCl2)40 ℃促融2 min,融合率可达(1.85±0.12)×10-6。所得融合子各项性能优良,适合于酸奶生产。
保加利亚乳杆菌;嗜热链球菌抗噬菌体菌株;原生质体制备;原生质体融合
原生质体融合因其具有重组频率高[1]、遗传稳定、可实现远缘杂交[2]、可集合双亲优良性状等优点,在微生物育种领域得到广泛应用[3-5]。保加利亚乳杆菌与嗜热链球菌作为酸奶生产的主要菌株,通常认为二者具有互惠共生关系[6],在牛奶发酵过程中协同作用,使得牛乳凝固时间缩短,产品黏度增加,产品风味增强[7-8]。近年来也有学者认为某些嗜热链球菌与保加利亚乳杆菌之间也存在拮抗抑制作用[9],混合发酵时菌体量的比例不合适或条件控制不当就会直接影响到酸奶的生产时间与品质。同时,噬菌体污染一直是困扰乳品发酵业的一大难题,为酸奶发酵选育出既具有抗噬菌体功能又具有优良生产性状的菌株,成为乳制品企业目前亟待解决的问题[10-12]。
本实验从生产实际出发,研究了保加利亚乳杆菌与嗜热链球菌抗噬菌体菌株的原生质体制备与再生条件,以及二者的融合条件与融合子的筛选。得到的融合子一方面保持了嗜热链球菌的噬菌体抗性,另一方面又结合了保加利亚乳杆菌的优良性状且融合子易于培养,有望实现酸奶发酵时单一菌株发酵,为酸奶发酵菌株的选育提供一条新途径。
1 材料与方法
1.1材料与试剂
1.1.1菌株
嗜热链球菌抗噬菌体菌株(Streptococcus thermophilus,S. t)由山西省生物研究所选育、保藏。
保加利亚乳杆菌(Lactobacillus bulgaricus,L. b)由山西维尔生物乳制品有限公司提供,山西省生物研究所保藏。
噬菌体:3 种噬菌体混合液,由山西省生物研究所分离、保藏。
1.1.2溶液与试剂
高渗溶液Ⅰ[13]:0.5 mol/L蔗糖溶液中加入0.02 mol/L顺丁烯二酸,调整pH值为6.5,再加入0.02 mol/L MgCl2。
高渗溶液Ⅱ[14-15]:10 mmol/L Tris-HCl中加入0.5 mol/L蔗糖和0.02 mol/L MgCl2,用4 mol/L HCl溶液调节pH值至6.5。
高渗溶液Ⅲ[16]:0.2 mol/L磷酸盐缓冲液(265 mL 0.2 mol/L Na2HPO4+735 mL 0.2 mol/L NaH2PO4,pH 6.4)中加入0.8 mol/L甘露醇。
聚乙二醇(polyethylene glycol,PEG)6000:高渗溶液配制为400 g/L,并向其中加入0.01 mol/L CaCl2、0.02 mol/L MgCl2。
溶菌酶液:高渗溶液配制为10 mg/mL的酶原液,现用现配,过滤除菌。
溶菌酶(22 800 U/mg)美国BBI公司;其他常规试剂均为国产分析纯。
1.1.3培养基
MRS培养基[17]:蛋白胨10 g、牛肉膏10 g、酵母提取物5 g、柠檬酸二铵2 g、乙酸钠5 g、葡萄糖20 g、吐温-80 l mL、MgSO4·7H2O 0.58 g、MnSO4·4H2O 0.25 g,蒸馏水1 000 mL,pH 6.2~6.4,固体培养基添加15 g的琼脂,用于保加利亚乳杆菌的培养。
M17培养基[17]:植质蛋白胨5.0 g、聚蛋白胨5.0 g、酵母提取物5.0 g、牛肉浸膏2.5 g、抗坏血酸0.5 g、β-甘油磷酸二钠19.0 g、1.0 mol/L MgSO4·7H2O 1.0 mL,蒸馏水1 000 mL,pH 6.8,固体培养基添加15 g的琼脂,用于嗜热链球菌抗噬菌体菌株的培养。
原生质体再生培养基[13]:MRS、M17再生培养基为在其原有配方的基础上添加0.5 mol/L蔗糖,0.02 mol/L MgCl2。
脱脂乳培养基:牛乳脱脂后115 ℃灭菌15 min,冷却后置于冰箱冷藏备用,用于菌种的活化和菌株发酵性能的研究。
1.2仪器与设备
PHS-3C雷磁pH计上海精密科学仪器有限公司;NDJ-1型旋转黏度计上海天平仪器厂;SLJ-Ⅰ型离心机沈阳理化仪器厂;722PC可见分光光度计上海佑科仪器仪表有限公司;WS2-134-75电热恒温培养箱连云港医疗器械设备厂;XMTD-4000电热恒温水浴锅北京市永光明医疗仪器厂;JT-型超净工作台常州第二航海仪器厂。
1.3方法
1.3.1指标测定方法
噬菌体效价:采用双层琼脂平板法[18]测定;酸奶中酸度:按GB 5409—85《牛乳检验方法》中滴定法测定;pH值:采用雷磁PHS-3C精密酸度计于室温测定;黏度:采用NDJ-1型旋转黏度计,取牛乳发酵后冷藏过夜的样品进行测定。
1.3.2保加利亚乳杆菌L. b及嗜热链球菌抗噬菌体菌株S. t的培养
1.3.2.1菌体活化培养
将菌株从保存管中取出,以3%的接种量接种于脱脂乳培养基中,菌株S. t 42 ℃培养4~6 h,菌株L. b 40 ℃培养10~12 h,连续活化2 代。
1.3.2.2菌体生长曲线的测定
菌种活化后,将菌株S. t接入M17液体培养基中,42 ℃培养24 h;将菌株L. b接入MRS液体培养基中,40 ℃培养24 h。每隔2 h取样,稀释后涂平板、计数,以培养时间为横坐标,相应的活菌体数为纵坐标,绘制生长量变化曲线。
1.3.3原生质体的制备及再生[19]
影响原生质体制备及再生的因素除菌体菌龄及合适的酶系外[20],还与维持原生质体稳定的高渗溶液、酶质量浓度、酶解温度、酶解时间等有关[16],在保加利亚乳杆菌和嗜热链球菌抗噬菌体菌株的原生质体制备中采用溶菌酶作为去璧酶系,设计正交试验确定其他酶解条件。
取菌株L. b和菌株S. t对数生长期的培养菌液15 mL,4 000 r/min离心10 min,去上清液。用5 mL高渗溶液反复洗涤两次,去上清液。最后用15 mL高渗溶液悬浮即得菌体悬浮液,调整菌体浓度为109CFU/mL,分别取1 mL稀释后涂MRS、M17平板,计数。另取1 mL调整好的菌体悬浮液,加入终质量浓度分别为0.1、0.5、1.0 mg/mL的溶菌酶,于30、36、42 ℃恒温酶解30、40、50 min。酶解后的菌液用高渗溶液洗涤两次,用1 mL高渗溶液悬浮得到原生质体液。将菌株L. b的原生质体液用高渗溶液适当稀释后分别涂布于MRS及MRS再生培养基,40 ℃恒温培养3~5 d。将菌株S. t的原生质体液用高渗溶液适当稀释后分别涂布于M17及M17再生培养基,42 ℃恒温培养3~5 d,测定菌株L. b和菌株S. t原生质体的形成率和再生率。
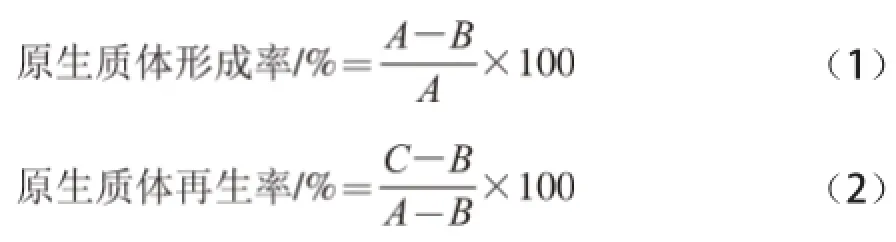
式中:A为酶解前的总菌落数/(CFU/mL),通过菌体悬浮液涂皿计数所得;B为未形成原生质体的菌落数/(CFU/mL),通过原生质体液涂皿计数所得;C为酶解后的再生菌菌落数/(CFU/mL),通过原生质体液涂再生培养基平皿计数所得。
1.3.4保加利亚乳杆菌L. b的原生质体灭活[21]
取菌株L. b对数生长期MRS培养菌液30 mL,4 000 r/min离心10 min,去上清液。用10 mL高渗溶液反复洗涤两次,去上清液。最后用30 mL高渗溶液悬浮,在合适条件下溶菌酶酶解,进行原生质体制备。酶解结束后将原生质体液适当稀释,涂MRS再生培养基平皿,40 ℃培养3~5 d后计数。同时将原生质体液分为3 份,每份8 mL,分别于60、70、80 ℃进行原生质体灭活。每隔10 min取样,显微镜观察原生质体形态并适当稀释后涂MRS再生培养基平皿,40 ℃培养3~5 d后计数。
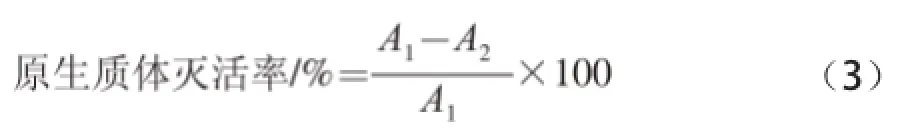
式中:A1为灭活前长出的菌落数/(CFU/mL);A2为灭活后长出的菌落数/(CFU/mL)。
1.3.5保加利亚乳杆菌L. b和嗜热链球菌抗噬菌体菌株S. t的原生质体融合
1.3.5.1原生质体的融合
取等量的菌株L. b原生质体灭活液和菌株S. t原生质体液混合,取样分别涂M17、M17再生平皿,混合后放置5 min,2 500 r/min离心10 min,收集原生质体,于沉淀中加入0.2 mL高渗溶液充分悬浮,再加入1.8 mL PEG 6000溶液,混匀后分别于30、35、40、45 ℃处理2、5、10 min,2 500 r/min离心10 min后,除去上清,沉淀悬浮于2 mL高渗溶液中,将悬浮液适当稀释后涂MRS再生平皿。M17平皿42 ℃,培养48 h后计数;M17、MRS再生平皿42 ℃,培养3~5 d后计数。
1.3.5.2融合子的筛选
菌株L. b可以在MRS、M17培养基上生长且对本实验用到的噬菌体敏感,嗜热链球菌抗噬菌体菌株S. t在MRS培养基上非厌氧培养时不生长。融合前将菌株L. b的原生质体进行灭活,对融合后得到的在MRS培养基生长的菌株进行噬菌体抗性检测,能在MRS培养基上生长且具有噬菌体抗性的菌株即为融合子。
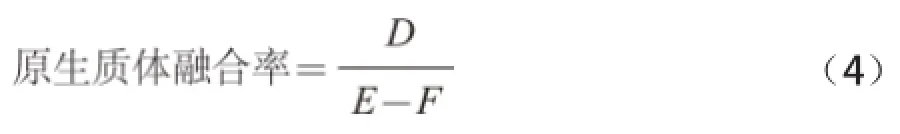
式中:D为融合子数;E为融合前在M17再生培养基上长出的菌落数/(CFU/mL);F为融合前在M17培养基上长出的菌落数/(CFU/mL)。
1.3.5.3融合子的稳定性实验
将获得的融合子以3%接种量与1%噬菌体(109PFU/mL)在牛乳培养基中共同传代15 代,取第5、10、15代适当稀释后涂MRS培养基平皿普通培养,计算活菌数并在传代后观察融合子的菌体形态,测定融合子的稳定性。
1.3.5.4融合子的发酵特性
将所获得的融合子以3%的接种量接入150 mL灭菌牛乳中,42 ℃培养,每隔2 h测定其活菌数及pH值。以菌株L. b、S. t及L. b与S. t混合发酵为对照,发酵结束后,统计融合子的凝乳时间、黏度及滴定酸度。
2 结果与分析
2.1菌体生长情况
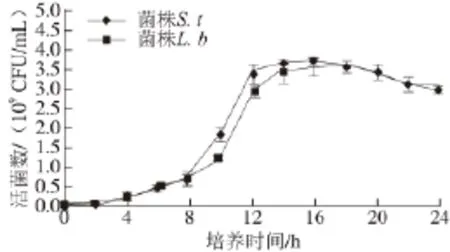
图1 菌株生长曲线Fig.1 Growth curves of L. bulgaricus and S. thermophilus
对菌株S. t和L. b的菌体生长情况进行测定,其生长曲线如图1所示,菌株S. t和L. b均为培养5 h后进入对数生长期。菌株S. t培养12 h后进入对数生长后期,14~16 h达到稳定期;菌株L. b培养14 h后进入对数生长后期,16~18 h达到稳定期。一般原生质体制备时选用对数生长早、中期的细胞,此时细胞壁对酶解敏感,原生质体形成率高[22],因而选用培养10 h的菌株S. t、培养12 h的菌株L. b用于原生质体的制备。
2.2保加利亚乳杆菌L. b的原生质体制备及再生
2.2.1最佳原生质体制备条件的确定
通过正交试验确定菌株L. b的最佳酶解条件,每个试验号重复3 次,其正交试验方案及结果见表1。影响菌株L. b原生质体形成的主要因素为溶菌酶的质量浓度,其次为酶解温度,原生质体稳定液和酶解时间影响不是很大。从正交表得出的最佳酶解条件为:A2B3C2D2,即原生质体稳定液选择高渗溶液Ⅱ、酶质量浓度为1.0 mg/mL、酶解温度为36 ℃、酶解时间为40 min,在此条件下进行菌株L. b的原生质体制备,原生质体形成率为(91.50±2.62)%。
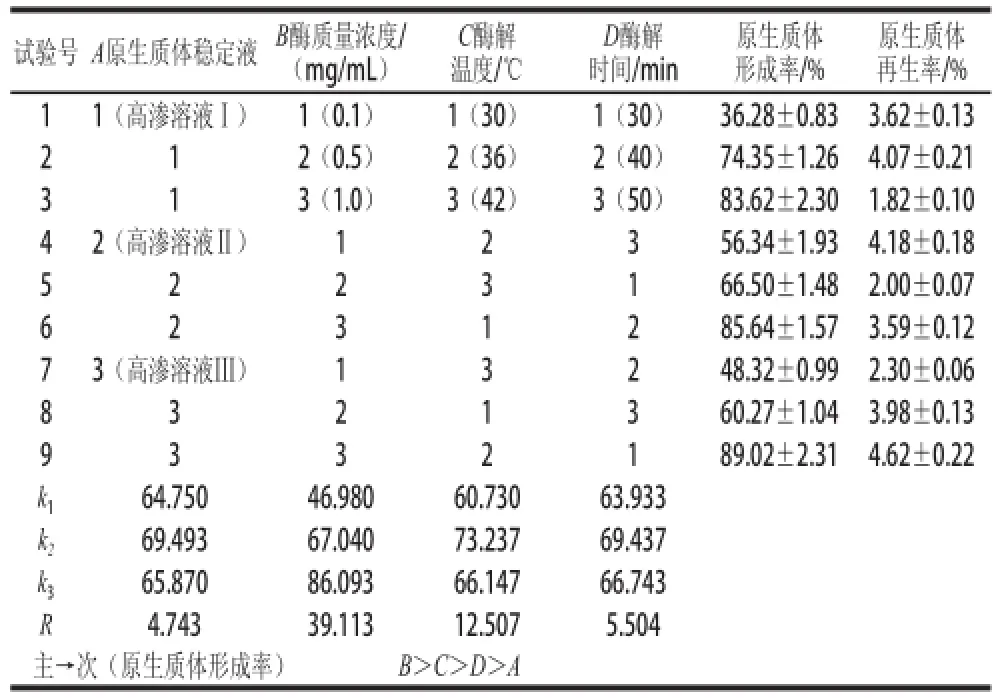
表1 菌株L. b原生质体制备条件的正交试验设计方案及结果Table 1 Orthogonal array design with experimental results on protoplast formation of L. bulgaricus
2.2.2原生质体形成率与再生率的关系
由表1可知,原生质体的形成率与再生率并不成正比,3号原生质体的形成率比较高,而再生率低,究其原因可能是因为3号原生质体制备时酶解温度比较高、酶解时间比较长,这些虽然有利于原生质体的形成,但有可能在这种条件下菌体去壁后,菌体内的其他成分或结构也遭到破坏,抑制了原生质体的再生。相比而言9号原生质体的形成率与再生率都比较高,其酶解条件为:原生质体稳定液选择高渗溶液Ⅲ、酶质量浓度为1.0 mg/mL、酶解温度为36 ℃、酶解时间为30 min。与正交试验得到的最佳酶解条件相比,原生质体稳定液不同,酶解时间缩短。通过正交极差分析,原生质体稳定液和酶解时间不是影响原生质体形成的主要显著因素,因此,综合考虑得出菌株L. b的最优原生质体制备条件为:原生质体稳定液选择高渗溶液Ⅲ、酶质量浓度为1.0 mg/mL、酶解温度为36 ℃、酶解时间为30 min。这时原生质体的形成率为(89.02±2.31)%,再生率为(4.62±0.22)%。
2.2.3保加利亚乳杆菌L. b原生质体形态
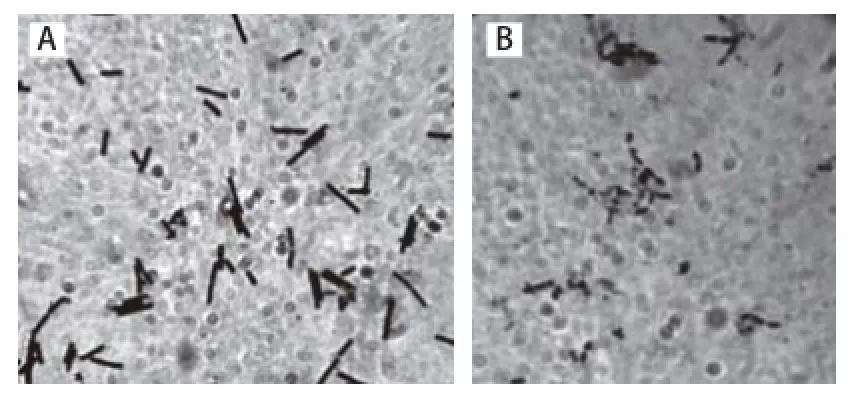
图2 菌株L. b(A)与其原生质体(B)形态图(×1 000)Fig.2 Micrograph of L. bulgaricus (A) and its protoplast (B) ( 1 000)
菌株L. b原生质体制备后的菌体形态如图2,菌株L. b为杆状,原生质体呈圆形或椭圆形且染色较浅。
2.3保加利亚乳杆菌L. b的原生质体灭活
在细胞融合之前对菌株L. b的原生质体进行灭活,原生质体灭活的方式通常有紫外线照射和高温处理[23]。高温处理对遗传物质的伤害比较小,破坏作用主要在细胞质中的蛋白和核糖体,原生质体中的染色体仍具有复制、重组功能,可以起到遗传物质的载体作用[24]。在不同温度条件下菌株L. b原生质体的灭活率随时间变化的关系见图3。
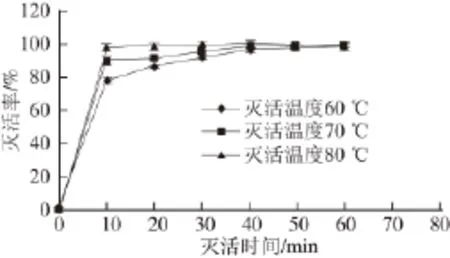
图3 菌株L. b原生质体灭活温度和时间对灭活率的影响Fig.3 Effect of inactivation time and temperature on inactivation rate of L. bulgaricus protoplasts
由图3可知,灭活40 min后菌株L. b的原生质体灭活率都可达到98%以上,一般认为DNA的变性温度为80 ℃,考虑到温度越高,对遗传物质的破坏越大,所以采用60 ℃、50 min作为保加利亚乳杆菌原生质体的灭活条件。此条件下,原生质体的灭活率为(98.64±0.52)%。
2.4嗜热链球菌抗噬菌体菌株S. t的原生质体制备及再生
2.4.1最佳原生质体制备条件的确定
通过正交试验确定菌株S. t的最佳酶解条件,每个试验号重复3 次,其正交试验方案及结果见表2。

表2 菌株S. t原生质体制备条件的正交试验设计方案及结果Table 2 Orthogonal array design with experimental results on protoplast formation of S. thermophilus
由表2可知,影响菌株S. t原生质体形成的主要因素为酶解温度和原生质体稳定液,溶菌酶的质量浓度影响不是很大,酶解时间几乎没有影响。从正交表得出的最佳酶解条件为:A2B1C3D1,即原生质体稳定液选择高渗溶液Ⅱ、酶质量浓度为0.1 mg/mL、酶解温度为42 ℃、酶解时间为30 min,在此条件下进行菌株S. t的原生质体制备,原生质体形成率为(99.15±0.23)%。菌株S. t在温度比较高的情况下,较低的酶质量浓度、较短的酶解时间即可完成原生质体的形成。其中在高渗溶液Ⅱ中原生质体的形成率比较高的原因还不是很清楚。
2.4.2原生质体形成率与再生率的关系
同时由表2可知,正交试验中的3号原生质体的形成率比较高,而再生率低。在酶解时3号的酶解条件为:原生质体稳定液选择高渗溶液Ⅰ、酶质量浓度1.0 mg/mL、酶解温度42 ℃、酶解时间50 min,不利于原生质体的再生。比较而言,4、5、6号原生质体形成率、再生率都比较高,其共同点为以高渗溶液Ⅱ作为原生质体稳定液,因而可以认为高渗溶液Ⅱ有益于嗜热链球菌抗噬菌体菌株原生质体的形成与再生。综合考虑确定菌株S. t原生质体制备的最优条件为:原生质体稳定液选择高渗溶液Ⅱ、酶质量浓度为0.1 mg/mL、酶解温度为42 ℃、酶解时间为30 min。这时原生质体的形成率为(99.15±0.23)%,再生率为(5.79±0.17)%。
2.4.3嗜热链球菌抗噬菌体菌株S. t原生质体形态
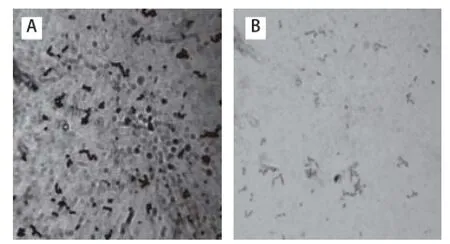
图4 菌株S. t(A)与其原生质体(B)形态图(×1 000)Fig.4 Micrograph of bacteriophage-resistant S. thermophiles and its protoplast (B) ( 1 000)
菌株S. t原生质体制备后的菌体形态如图4所示,菌株S. t为链状球菌,原生质体呈圆形且染色较浅。
2.5保加利亚乳杆菌L. b与嗜热链球菌抗噬菌体菌株S. t原生质体融合条件的确定
在原生质体制备时,菌株L. b选用高渗溶液Ⅲ,菌株S. t选用高渗溶液Ⅱ作为原生质体稳定液。因为原生质体稳定液对菌株L. b原生质体的制备与再生影响不大,所以融合时采用高渗溶液Ⅱ作为共同的原生质体稳定液。温度及融合时间对融合率的影响见图5。
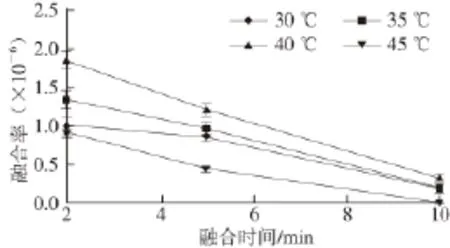
图5 融合温度和时间对原生质体融合率的影响Fig.5 Effects of temperature and time on protoplast fusion rate
由图5可知,温度高或低都不利于原生质体的融合。温度高的情况下,虽有利于菌体的流动性及通透性,但在高温时,温度及外界环境中PEG等对原生质体的损伤也加剧,不利于融合子的再生;温度低的情况下,菌体的活性及融合环境的流动性较弱,不利于菌体的接触与融合。从图中可知融合时间也不宜太长,随着融合时间的增加,融合率逐渐降低,这可能是PEG处理时间过长,会对原生质体造成一定的毒性,从而导致其失活[24]。最佳融合条件为:40 ℃,融合2 min,此时融合率为(1.85±0.12)×10-6。
2.6融合子的检出及稳定性检测
融合后MRS再生培养基上长出20 株再生菌落,经噬菌体检测后挑出12 株融合子,对12 株融合子进行传代稳定性实验,其中3 株传15 代后仍具有噬菌体抗性且在MRS培养基上生长良好,3 株融合子传代后在MRS培养基上的生长情况如表3所示,以Rh6在MRS培养基上生长最好,其菌体形态如图6所示。与出发菌株相比,融合子Rh6呈椭圆形近似短杆,而菌株L. b为长杆状,菌株S. t为圆形。
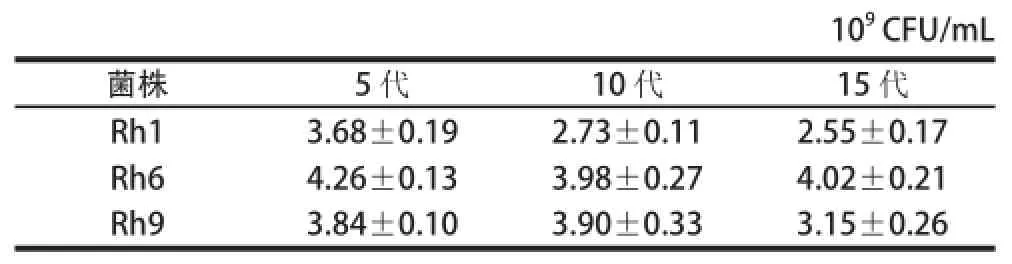
表3 融合子在MRS培养基上的生长情况Table 3 Growth status of fusants in MRS culture medium 109 CFU
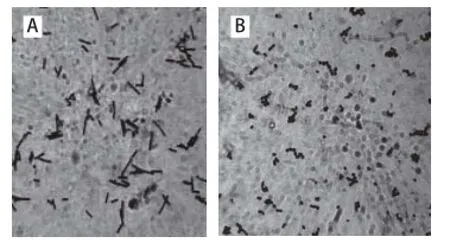

图6 融合前后菌体形态(×1 0000)Fig.6 Micrograph of L. bulgaricus and S. thermophilus as well as their fusants (×11 000000)
由表3、图6可知,融合子Rh6与噬菌体共同传代15 代后仍具有噬菌体抗性,在牛乳培养基中可正常生长、凝乳,将传15 代后的融合子涂布于MRS培养基上仍生长良好,菌体形态与刚筛选到时一致且异于出发菌株,因此可认为筛选到的融合子Rh6具有遗传稳定性。
2.7融合子的发酵特性
2.7.1融合子Rh6牛乳发酵过程中的活菌数及pH值
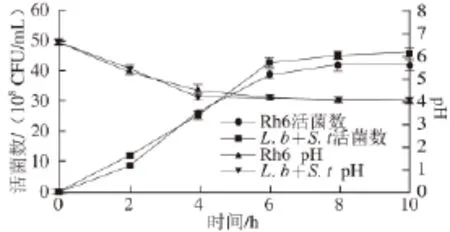
图7 发酵过程中的活菌数及ppHH值Fig.7 Number of viable bacteria and pH during fermentation
由图7可知,融合子Rh6在牛乳发酵过程中的活菌数和pH值与通常酸奶发酵过程中使用两种菌的差异不大,融合子的发酵条件比较好控制且不存在如何在发酵中控制两种菌比例的问题。
2.7.2融合子Rh6的发酵结果及感官风味评价
对融合子Rh6进行牛乳发酵实验。3%接种量,42 ℃酸奶发酵,发酵结果如表4所示,发酵后的酸奶细腻黏稠,乳香浓郁,酸甜适中,稍有乳清析出。从理化指标及感官风味评价,融合子适合于酸奶生产。

表4 融合子Rh6牛乳发酵结果Table 4 Fermentation performance of fusion Rh6
3 结 论
保加利亚乳杆菌L. b在原生质体制备时酶质量浓度的影响比较大,这与菌株L. b细胞壁比较致密且对溶菌酶不是很敏感[19]有关,在酶解过程中需要较高的酶质量浓度。在较高酶质量浓度的情况下,随着酶解时间的延长,原生质体的形成率虽可提高,但再生率会有所下降。对嗜热链球菌抗噬菌体菌株S. t而言,比较高的温度有益于原生质体的形成,在以高渗溶液Ⅱ为原生质体稳定液时,菌株S. t原生质体的形成率和再生率最高,这可能与菌株S. t自身的细胞及细胞壁结构有关,具体原因尚不明确。
关于保加利亚乳杆菌L. b与嗜热链球菌S. t原生质体的融合曾献春等[16,25]曾有报道,本实验通过单亲灭活及嗜热链球菌抗噬菌体菌株S. t在MRS培养基上不生长的特性筛选融合子,避免了筛选的盲目性。同时融合子未引入外源基因且集合了双亲的优良性状,筛选到的融合子没有安全隐患、具有抗噬菌体功能、在进行酸奶发酵时发酵特性优良,可以用于酸奶生产。
[1]BALTZ R H. Genetic recombination by protoplast fusion in Streptomyces[J]. Journal of Industrial Microbiology & Biotechnology,1999, 22(4): 460-471.
[2]BADR-ELDEN A M, NOWER A, NASR M I, et al. Isolation and fusion of protoplasts in sugar beet (Beta vulgaris L.)[J]. Sugar Tech,2010, 12(1): 53-58.
[3]赵春苗, 徐春厚. 原生质体融合技术及在微生物育种中的应用[J].中国微生态学杂志, 2012, 24(4): 379-382.
[4]王登宇, 臧威, 孙剑秋, 等. 细菌原生质体融合育种技术及其应用进展[J]. 中国酿造, 2008, 27(7): 1-5.
[5]邱静, 罗水忠, 姜绍通, 等. 高产L-乳酸米根霉的原生质体制备与再生条件研究[J]. 食品科学, 2011, 32(9): 174-178.
[6]COURTIN P, RUL F. Interactions between microorganisms in a simple ecosystem: yogurt bacteria as a study model[J]. Le Lait, 2003,84(1/2): 125-134.
[7]TAMIME A Y, ROBINSON R K. Yoghurt: science and technology[M]. 2nd ed. Cambridge: Woodhead Publishing Limited, 1999: 358.
[8]包维臣, 陈霞, 邵玉宇, 等. 保加利亚乳杆菌与嗜热链球菌共生机理的研究进展[J]. 中国乳品工业, 2011, 39(12): 20-23.
[9]吴荣荣, 马静, 裴家伟, 等. 保加利亚乳杆菌和嗜热链球菌相互作用的研究[J]. 中国乳品工业, 2003, 31(4): 9-13.
[10] 李亚蕾, 杨波, 李文霞, 等. 抗噬菌体嗜热链球菌突变菌株Streptococcus thermophilus-21UD的选育[J]. 食品工业科技, 2008,29(11): 118-121.
[11] 方伟, 魏冉冉, 孙懿琳, 等. 德氏乳杆菌保加利亚亚种自发突变抗噬菌体菌株的选育及其特性[J]. 食品科技, 2012, 37(12): 2-6.
[12] 王慕华, 潘佩平, 赵玉明, 等. 嗜热链球菌抗噬菌体菌株的选育及其发酵特性的研究[J]. 食品与发酵工业, 2014, 40(3): 92-96.
[13] 杜连祥. 工业微生物学实验技术[M]. 天津: 天津科学技术出版社,1992: 229.
[14] SINGHVI M, JOSHI D, GAIKAIWARI S, et al. Protoplast formation and regeneration in Lactobacillus delbrueckii[J]. Indian Journal of Microbiology, 2010, 50(1): 97-100.
[15] 韩璞, 田洪涛, 苑社强. 罗伊氏乳杆菌原生质体的制备与再生条件的研究[J]. 中国食品学报, 2010, 10(1): 10-18.
[16] 曾献春, 孟冬丽, 葛风伟. 乳酸菌原生质体融合筛选[J]. 中国酿造,2008, 27(3): 26-28.
[17] 杨洁彬, 郭新华, 张篪, 等. 乳酸菌: 生物学基础及应用[M]. 北京: 中国轻工业出版社, 1996: 78.
[18] 赵峰梅, 孙文敬, 王慕华, 等. 2-酮基-D-葡萄糖酸产生菌荧光假单胞菌K1005抗噬菌体菌株的选育[J]. 工业微生物, 2000, 30(4): 45-49.
[19] 李丽, 房杰, 黄洁洁, 等. 单亲灭活德氏乳杆菌和乳酸乳球菌原生质体融合条件优化[J]. 食品科学, 2012, 33(5): 193-198.
[20] 张莉滟, 陈林, 张德. 保加利亚乳杆菌原生质体的制备与回复研究[J].中国微生态学杂志, 2004, 16(2): 73-74.
[21] 易弋, 黎娅, 程谦伟, 等. 双亲灭活原生质体融合选育高性能酒精酵母菌的研究[J]. 中国酿造, 2012, 31(4): 75-78.
[22] 白毓谦, 方善康, 高东, 等. 微生物实验技术[M]. 济南: 山东大学出版社, 1987: 385.
[23] KUCSERA J, PFEIFFER I, FERENCZY L. A novel method for hybridization of Saccharomyces species without genetic markers[J]. Canadian Journal of Microbiology, 1998, 44(10): 959-964.
[24] 陈志刚. 抗酸奶后酸化乳酸菌株的选育[D]. 乌鲁木齐: 新疆农业大学, 2009.
[25] 曾献春, 孟冬丽. 乳酸菌原生质体制备与再生研究[J]. 食品科学,2006, 27(10): 269-272.
Protoplast Formation and Fusion between Lactobacillus bulgaricus and Bacteriophage-Resistant Mutant of Streptococcus thermophilus
WANG Muhua1, PAN Peiping1, ZHAO Yuming1,2, SU Binnan1, CAI Yinghui1, LI Haitao1,2
(1. Biology Institute of Shanxi, Taiyuan030006, China; 2. Shanxi Veal Biological Dairy Products Co. Ltd., Taiyuan030006, China)
Primary factors affecting protoplast formation and regeneration of Lactobacillus bulgaricus and Streptococcus thermophilus were investigated using orthogonal array design to obtain fusants with bacteriophage resistance and superior fermentation performance. The results showed that the optimal preparation conditions for L. bulgaricus protoplasts were achieved by treatment with 1.0 mg/mL lysozyme for 30 min at 36 ℃ in the presence of hypertonic solution with phosphate buffer and mannitol. Under these conditions, the protoplast formation and regeneration rates reached(89.02 ± 2.31)% and (4.62 ± 0.22)%, respectively. The protoplast formation and regeneration rates of bacteriophage-resistant S. thermophilus were up to (99.15 ± 0.23)% and (5.79 ± 0.17)% after treatment with 0.1 mg/mL lysozyme for 30 min in the presence of hypertonic solution with Tris-HCl buffer and sucrose. The fusion rate of protoplasts between L. bulgaricus and S. thermophilus reached (1.85 ± 0.12) × 10-6after infusion for 2 min at 40 ℃ in the presence of 400 g/L PEG6000,0.01 mol/L CaCl2and 0.02 mol/L MgCl2. The performance of the fusant is stable and it is applicable to yoghurt production.
Lactobacillus bulgaricus; bacteriophage-resistant mutant of Streptococcus thermophilus; protoplast formation;protoplast fusion
Q813.2;Q939.117
A
1002-6630(2015)23-0189-06
10.7506/spkx1002-6630-201523035
2015-01-04
山西省农业科技攻关计划项目(20120311030)
王慕华(1975—),女,副研究员,硕士,研究方向为工业微生物,乳品发酵。E-mail:wang_muhua@126.com

