生物素间接竞争酶联免疫方法的建立
葛文亮,胥传来
(1.无锡市第二人民医院,江苏无锡214002;2.江南大学食品学院,江苏无锡214122)
生物素间接竞争酶联免疫方法的建立
葛文亮1,胥传来2
(1.无锡市第二人民医院,江苏无锡214002;2.江南大学食品学院,江苏无锡214122)
利用不同方法合成的生物素免疫原免疫小鼠,利用所得到的单克隆抗体建立针对生物素的间接竞争酶联吸附测定方法。所建立的间接竞争酶联吸附测定方法对生物素具有良好的特异性与较高的灵敏度,其对生物素半抑制率质量浓度为2.01 ng/mL,最低检测限为0.32 ng/mL,并且对液态奶、奶粉等样品中的生物素含量具有准确的检出性。与国标相比,所建立的间接竞争酶联吸附测定方法具有结果稳定,操作方便和高灵敏度高特异性等优点,对实际样品的检测具有重要意义。
乳制品;生物素;间接竞争酶联吸附测定法
生物素,又被称为辅酶R、维生素B7、维生素H以及W因子[1],属于水溶性B族维生素中的一种。作为参与蛋白质、脂肪与碳水化合物代谢过程的一个必不可少的辅助因子,生物素是影响动植物生长发育的关键物质,在生物体的各种活动中扮演着十分重要的角色[2]。
尽管生物素对人体的生长,发育和健康有着十分重演的作用,但人体并不能自身合成这种维生素,而只能从日常饮食中摄取,例如蛋黄、动物内脏、一些蔬菜和乳制品,一些肠道微生物也可以帮助人体进行合成[3-4]。
一般人群很少会出现生物素缺乏的情况,只有少数生物酶缺乏人群[5],肠炎患者[6]以及大量酗酒者[7]会出现生物素缺乏的现象。生物素缺乏会导致皮肤干燥、皮疹、毛发无光泽。有动物实验已经证明孕期生物素缺乏会导致胚胎生长迟缓,胎儿先天性畸形与死亡[8]。特别是婴幼儿,由于肠道功能较弱而容易导致生物素缺乏现象,可能会引起严重的神经系统病症,甚至于婴幼儿的猝死[8]。因此,在婴幼儿食品中添加一定量的生物素是十分必要的[9]。
仪器检测方法和微生物学鉴定法,都是常用的生物素检测方法。仪器检测方法虽然结果准确但存在样品准备过程复杂繁琐,需要专业人员操作等弊端。微生物学鉴定法检测结果灵敏,并且在世界范围内广泛使用,属于各国检测的标准方法。但是微生物菌株的活性在传代过程中会发生变化,而且试剂盒价格高昂,很难得到大范围的推广。
酶联免疫方法(ELISA)是一基于抗原-抗体反应的简便,灵敏,价格低廉的检测方法,将会成为一种食品中生物素含量快速检测的理想方法[10]。
在作者的研究中,生物素被耦联在不同的载体蛋白表面,分别作为免疫原与包被原使用。通过小鼠免疫与脾脏融合过程获得了针对生物素的单克隆抗体,并以此为基础建立了间接竞争酶联免疫方法(Ic-ELISA),可将其应用于乳制品中的生物素含量的检测。
1 材料与方法
1.1材料与试剂
生物素,生物素-N-羟基琥珀酰亚胺酯(Biotin-NHS),以及其余维生素标准品,6-氨基己酸(6-ACA),牛血清白蛋白(BSA),鸡卵白蛋白(OVA),碳化二亚胺(EDC),氮羟基琥珀酸(NHS),弗氏完全佐剂和弗氏不完全佐剂,3,3',5,5'-四甲基联苯胺(TMB),明胶:购于Sigma公司;辣根过氧化酶标记的羊抗鼠IgG:康成生物工程公司产品;其余试剂均购自国药集团化学试剂有限公司。
1.2主要仪器
Thermo MK3酶标仪:热电公司产品;伯乐电泳槽与电泳仪:伯乐公司产品;DHG-9070A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司产品;高吸附性96孔酶标板:无锡国盛生物工程有限公司产品;FR-980A生物电泳图像分析系统:上海复日科技有限公司产品。
1.3试验方法
1.3.1生物素免疫原的合成为获得合格的生物素抗体,经实验合成了两种不同的免疫原:
免疫原1:通过活化酯法将Biotin-NHS与BSA进行耦联。Biotin-NHS首先溶解于N,N-二甲基甲酰胺溶剂中,质量浓度为5 mg/mL;BSA溶解于0.1 mol/L碳酸盐缓冲液中(CB,pH 9.6),质量浓度为10 mg/mL。一定量的Biotin-NHS缓慢滴加至BSA溶液中,室温下反应2 h。反应液中加入一定量2 mol/L的NH4Cl溶液(m(NH4Cl)∶m(Biotin-NHS)=2∶1),室温反应10 min。反应液随后使用磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.4)透析72 h。
因为抗体的亲和力与特异性会受到载体蛋白与半抗原之间空间位置大小的影响[11-12]。因此在免疫原2的合成过程中引入了6-氨基己酸。
免疫原2:BSA溶解在去离子水中,质量浓度为10 mg/mL,m(BSA)∶m(6-氨基己酸)∶m(EDC)=5∶10∶3),反应液在室温反应4 h,用0.01 mol/L磷酸盐缓冲液透析72 h,获得6-ACA-BSA。生物素耦联过程与免疫原1中一致。
两种免疫原的合成路径见图1。包被原的合成方法与免疫原1一致,将Biotin-NHS与OVA进行耦联。
1.3.2免疫原与包被原的电泳表征合成的免疫原与包被原分别使用SDS-PAGE表征,实验方案参照Laemmli方案[13]。系统分别使用质量分数5%的浓缩胶与8%的分离胶。样品稀释至质量浓度为0.3 mg/mL,分别与等体积的上样缓冲液混合,100℃煮沸10 min,上样时每孔10 μL,120 V电压下90 min。体积分数10%的三氯乙酸固定后考马斯亮蓝染色生物电泳图像分析系统中拍照保存。
1.3.3单克隆抗体的制备每一个免疫原分别免疫5只6~8周龄的雌性BALB/c小鼠。首次免疫时20 μg免疫原溶解于100 μL生理盐水,与弗氏完全佐剂等体积混合,乳化至形成油包水结构后皮下多点注射免疫,每次免疫间隔3周,之后使用弗氏不完全佐剂。至间接ELISA法检测获得高效价与低半抑制浓度(IC50)小鼠血清。小鼠脾脏融合与细胞株筛选参照之前方案[14]。制备获得细胞株的腹水,并采用辛酸饱和硫酸铵法纯化得到单克隆抗体。

图1 不同免疫原合成路径Fig.1Synthesis of biotin immunogens
1.3.4Ic-ELISA的建立间接竞争酶联吸附测定方法的操作过程与传统方法一致[15]。包被原由碳酸盐缓冲溶液(pH 9.6)稀释,100 μL/孔包被至96孔酶标板上。在实验过程中分别优化了以下因素:包被原种类(不同反应的Biotin-NHS与OVA);标准品稀释液中氯化钠含量[16]。在优化后的最佳条件下,以生物素标准品浓度为横坐标,对应的OD450值作为纵坐标,建立标准抑制曲线,并确定检测线性范围与IC50值。
1.3.5Ic-ELISA检测生物素的特异性常见的部分B族维生素以及维生素A,D,E分别作为标准品使用建立的间接竞争酶联吸附测定方法进行检测。交叉率(CR)由以下公式计算得出:
CR(%)=(生物素IC50值/其余维生素IC50值)× 100[17]
1.3.6实际样品的检测与添加回收实验鲜奶,纯牛奶,婴幼儿奶粉,全脂奶粉分别购买自天资乳业与超市。样品中生物素含量依据国标使用微生物鉴定法确定:GB 5413.19-2010。
液态奶样品4℃,5 000 g离心15 min后除去上层脂肪,下层样品去离子水使用标准品稀释液稀释10倍后待测。奶粉样品按料液质量体积比1∶9比例溶于去离子水,60℃水浴30 min,4℃,5 000 g离心15 min后除去上层脂肪,下层样品去离子水使用标准品稀释液稀释10倍后待测。
在样品处理前,液态奶样品中分别添加20,40,80 ng/mL生物素标准品,奶粉中分别添加200,400,800 ng/g生物素标准品,进行样品添加回收实验。每个样品检测重复3次。
2 结果与分析
2.1免疫原与包被原的合成
两种免疫原分别应用于小鼠免疫。免疫原1的合成中应用4个不同的质量比:1∶5,1∶10,1∶20,1∶40。免疫原2的合成中,BSA首先与6-ACA以1∶2的反应比(w∶w)进行耦联,透析后m(BSA)∶m(Biotin-NHS)分别以1∶5,1∶10,1∶20,1∶40反应比耦联生物素。包被原合成路线与免疫原1一致,反应比m(OVA)∶m(Biotin-NHS)分别为1∶1,1∶2和1∶4。
2.2免疫原与包被原的表征
所合成的免疫原与包被原均由SDS-PAGE方法表征,表征结果如图2。当蛋白成功耦联上生物素小分子后,蛋白条带的位置在胶上会出现明显的偏移,蛋白上耦联的小分子越多,偏移越明显。不同反应比的免疫原与包被原在胶上可以明显区分开。
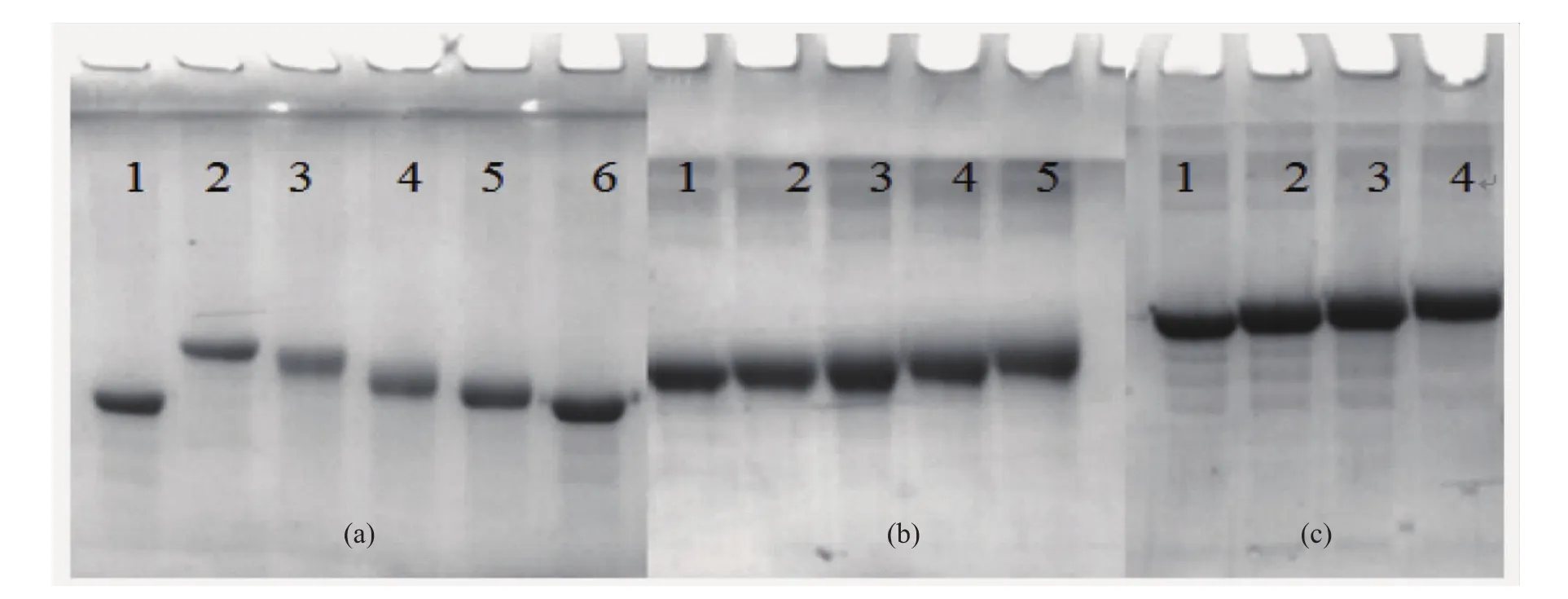
图2 不同免疫原与包被原电泳表征Fig.2SDS-page characterization of immunogens and coating antigen
2.3单克隆抗体的制备与表征
免疫小鼠三免后断尾采血间接ELISA法检测血清。不同免疫原免疫小鼠检测结果比较,免疫原2免疫小鼠具有较低的IC50值,其中反应比1∶10的免疫原效果最佳:反应比1∶5免疫原免疫小鼠IC50过高,反应比1∶20与1∶40免疫原免疫小鼠死亡率过高。同时具有高效价与较低IC50的小鼠被选择进行脾脏融合实验,得到细胞株3C2并选择其建立间接竞争酶联吸附测定方法。
2.4Ic-ELISA的建立与优化
不同反应比的包被原对抗体效价与IC50的影响十分明显。在Ic-ELISA的优化过程中使用了3个不同反应比的包被原,每个包被原选用3个不同包被质量浓度(0.3,0.1,0.03 μg/mL)检测抗体效价(图3)。依据抗体效价选择合适工作点分别检测生物素IC50值(表1)。
检测结果显示反应比越高的包被原在相同的包被浓度下检测的抗体效价越高。但当反应比太高或者太低的时候,抗体的IC50值均不理想。只有当在合适的反应比条件下合成的包被原既可以提供较高的抗体效价,又具有较低的抗体IC50值。结果表明,当反应比m(OVA)∶m(Biotin)为1∶2时,合成的包被原效果最佳。最佳工作点条件为包被质量浓度0.03 μg/mL,抗体质量浓度为0.3 μg/mL。
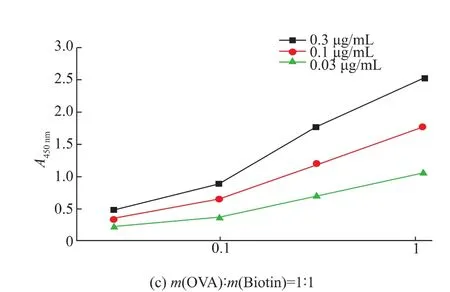
图3 不同包被原检测抗体效价Fig.3Atibody titer detection for different kinds of coating antigens

表1 不同包被原检测IC50值(n=7)Table 1IC50values for different kinds of coating antigen(n=7)
不同质量分数(0%,0.4%,0.8%,1.6%,3.2%)氯化钠的标准品稀释液体系具有不同的离子强度。抗体决定簇与抗原决定簇表面的离子键对抗原抗体反应具有一定的抑制作用,从而会影响抗体的最大吸光值和IC50值。不同质量分数氯化钠含量的标准品稀释液检测结果如图4。当氯化钠质量分数在1.6%以下时,最大的光密度值(A450nm)基本保持在一个稳定的水平上,当氯化钠质量分数高于1.6%时,A450nm值出现较大的下降。这可能是由于当氯化钠质量分数上升时,抗体与包被原的吸附结合能力受到影响。当氯化钠质量分数为0.8%时,检测得到的IC50值最低。
图5中显示综合实验结果,在最优的Ic-ELISA条件下,生物素检测标准曲线方程为Y=0.112+ 1.432/[1+(x/2.32.)1.834],R2值为0.996,IC50值为2.01 ng/mL,最低检测限为0.32 ng/mL(IC10)。
2.5特异性检测
在最优的Ic-ELISA条件下,乳制品中常见的部分维生素被用来进行抗体的特异性检测,包括:维生素A,C,D,E,K1以及维生素B1(硫胺素),B2(核黄素),B3(烟酸),B5(泛酸),B6(吡多胺),B9(叶酸),B12(钴胺素)。实验结果表明建立的Ic-ELISA方法对生物素的检测具有很好的特异性,对乳制品中其余常见维生素均没有交叉。
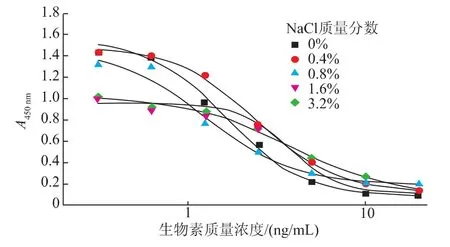
图4 标准品稀释液中离子强度的影响(n=7)Fig.4Effects of ionic strength in assay butter on Ic-ELISA performance(n=7)
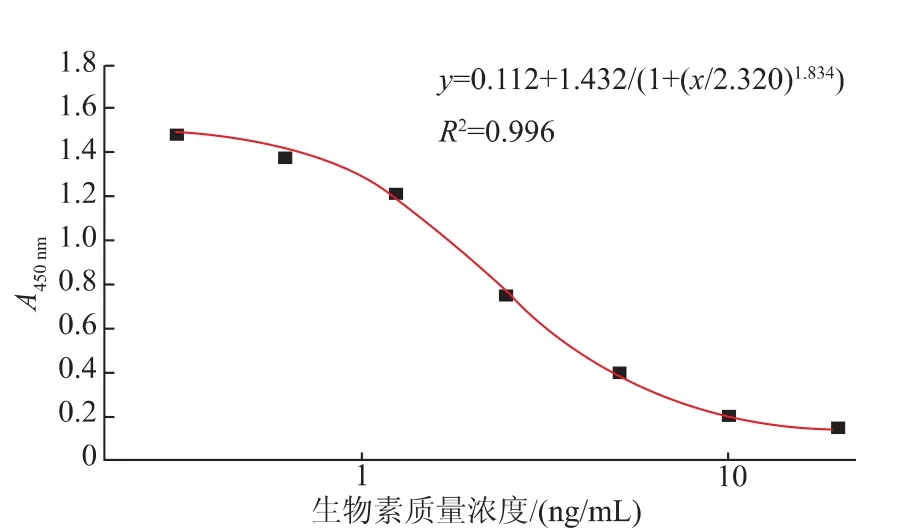
图5 最优条件下生物素抑制曲线(n=7)Fig.5Optimized inhibition standard curve for biotin analysis by Ic-ELISA(n=7)
2.6实际样品检测与添加回收
实验中所使用鲜奶,纯牛奶,婴幼儿奶粉,全脂奶粉样品样品分别依据国标(GB 5413.19-2010)微生物鉴定法与所建立Ic-ELISA方法进行检测,结果如表2所示。Ic-ELISA方法检测生物素含量为国标法检测含量的82%与91%之间。
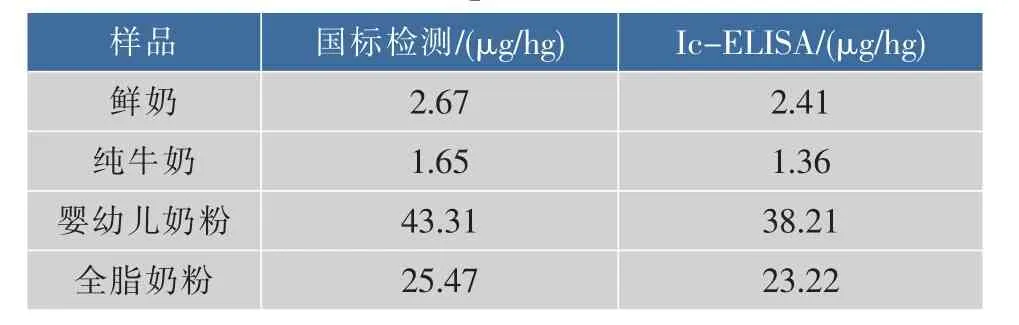
表2 样品检测(n=3)Table 2Sample detection(n=3)
在液态奶与奶粉样品中分别各自添加3个不同含量的生物素标准品,使用Ic-ELISA方法进行检测。所有样品中3个生物素添加量均可被检测出,回收率在93%与120%之间。实验结果显示:利用获得的高灵敏度抗体所建立的Ic-ELISA方法对液态奶与奶粉中的生物素含量检测具有较好检出结果。
3 结语
在作者的研究中,利用不同方案合成的生物素免疫原免疫小鼠,经过检测与细胞融合实验获得的对生物素具有高灵敏度与高特异性的单克隆抗体,并以此为基础建立了Ic-ELISA方法,并对所建立的Ic-ELISA方法中的检测条件进行了优化。运用所建立生物素Ic-ELISA方法对鲜奶与奶粉等乳制品中的生物素含量进行了检测,检测结果显示此方法对鲜奶与奶粉中的生物素质量浓度具有良好的检测效果,其检出数值与国标检出数值相比,符合率达到82%~91%,对添加样品的检测也具有很好的回收率,达到93%~120%。与国标相比,所建立的Ic-ELISA方法具有结果稳定,操作方便和灵敏度高等优点。
[1]Christodoulou V,Bampidis V A,Lymberopoulos A G,et al.Effect of supplemental dietary biotin on performance of lactating ewes[J].Animal Feed Science and Technology,130(3):268-76.
[2]Kramer T R,Briske-Anderson M,Johnson S B,et al.Effects of biotin deficiency on polyunsaturated fatty acid metabolism in rats[J].J Nutr,1984,114(11):2047-52.
[3]Mccormick Donald B.The vitamins:fundamental aspects in nutrition and health[J].The American Journal of Clinical Nutrition,1999,70(3):426.
[4]Mcmahon Robert J.Bitin in metabolism and Molecular biology[J].Annual Review of Nutrition,2002,22(1):221-39.
[5]Wolf B,Feldman G L The biotin-dependent carboxylase deficiencies[J].American Journal of Human Genetics,1982,34(5):699-716.
[6]Fernandez-Banares F,Abad-Lacruz A,Xiol X,et al.Vitamin status in patients with inflammatory bowel disease[J].The American Journal of Gastroenterology,1989,84(7):744-748.
[7]Bonjour J P.Vitamins and alcoholism.V.Riboflavin,VI.Niacin,VII.Pantothenic acid,and VIII.Biotin[J].International Journal for Vitamin and Nutrition Research Internationale Zeitschrift fur Vitamin-Und Ernahrungsforschung Journal International de Vitaminologie et de Nutrition,1980,50(4):425-440.
[8]Mock D M,Mock N I,Stewart C W,et al.Marginal biotin deficiency is teratogenic in ICR mice[J].Journal of Nutrition,2003,133(8):2519-2525.
[9]Indyk Harvey E,Gill Brendon D,Woollard David C.Biotin content of paediatric formulae,early lactation milk and seasonal bovine milk powders by biosensor immunoassay[J].International Dairy Journal,2014,35(1):25-31.
[10]Wellenberg G J,Banks J N.Enzyme-linked sorbent assay to quantify d-biotin in blood[J].Journal of the Science of Food and Agriculture,1993,63(1):1-5.
[11]Castro A,Prieto I.Nicotine antibody production:comparison of two nicotine conjugates in different animal species[J]. Biochemical and Biophysical Research Communications,1975,67(2):583-589.
[12]Dassarma J,Duttagupta C,Ali E,et al.Antibody to folic-acid-increased specificity and sensitivity in elisa by using epsilon-aminocaproic acid modified bsa as the carrier protein[J].Journal of Immunological Methods,1995,184(1):1-6.
[13]Laemmli U.K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680-685.
[14]Wang Chunmei,Liu Yihua,Guo Yirong,et al.Development of a McAb-based immunoassay for parathion and influence of the competitor structure[J].Food Chemistry,2009,115(1):365-370.
[15]Peng Chi-Fang,Chen Yong-Wei,Chen Wei,et al.Development of a sensitive heterologous ELISA method for analysis of acetylgestagen residues in animal fat[J].Food Chemistry,2008,109(3):647-653.
[16]Kuang Hua,Xu Liguang,Cui Gang,et al.Development of determination of di-n-octyl phthalate(DOP)residue by an indirect enzyme-linked immunosorbent assay[J].Food and Agricultural Immunology,2010,21(3):265-277.
An Indirect Competitive Enzyme-Linked Immunosorbent Method for the Detection of Biotin
GE Wenliang1,XU Chuanlai2
(1.Wuxi No.2 People's Hospital,Wuxi 214002,China;2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Different kinds of biotin immunogens were synthesized for mice immunization and the obtained monoclone antibody was used for the development of indirect competitive enzyme-linked immunosorbent assay.With the method of high specificity and sensitivity,the half inhibition concentration of biotin was 2.01 ng/mL and the detection limit was 0.32 ng/mL,and the biotin content in liquid milk and milk powder samples could be accurately detected.Compared with the national standard,the method was sufficiently stable,convenient,sensitive and accurate for the analysis of biotin in real samples.
dairy products,biotin,indirect competitiveenzyme-linkedimmunosorbentassay(Ic-ELISA)
R 392.33
A
1673—1689(2015)10—1045—06
2014-12-11
国家“十二五”科技支撑计划项目(2012BAD29B04)。
葛文亮(1965—),男,江苏无锡人,主任技师,主要从事临床医学检验与免疫学研究。E-mail:2324999898@qq.com

