响应面优化孔雀草悬浮细胞总黄酮的提取工艺
袁云香
(渭南师范学院化学与生命科学学院,陕西渭南714099)
响应面优化孔雀草悬浮细胞总黄酮的提取工艺
袁云香
(渭南师范学院化学与生命科学学院,陕西渭南714099)
以孔雀草叶片为外植体诱导愈伤组织并进行悬浮培养,测定了悬浮细胞的总黄酮含量。通过单因素实验及响应面分析,研究了固液比、乙醇浓度、提取温度和提取时间对黄酮产量的影响。实验结果表明,从孔雀草悬浮细胞中提取总黄酮的最佳优化工艺条件为:以72%乙醇为浸提溶剂,固液比1∶25g/mL,提取时间3.2h,提取温度59℃,在此条件下总黄酮得率理论值为21.49%,验证值为21.37%,验证值与理论值间的相对误差为0.12%。
孔雀草,愈伤组织,悬浮培养,黄酮
近年来,随着人们对黄酮类化合物研究的深入,开发利用植物资源提取黄酮类化合物的研究较多。孔雀草作为万寿菊属的常规栽培观赏花卉,其药用价值逐渐被关注[1]。孔雀草具有药用和保健价值,其全草含有精油及黄酮类色素,入药有清热解毒、消炎补血等功效,在食品、医药及禽类饲料生产中应用广泛[2-4]。
与孔雀草同属的其他花卉如万寿菊研究的比较多。李娜对万寿菊花总黄酮提取进行了研究[5],张瑞等采用响应面法优化了万寿菊中类胡萝卜素的提取工艺[6],李刚刚对万寿菊颗粒残渣中总黄酮进行了提取[7]。而关于孔雀草黄酮类化合物的提取,目前主要是集中在对其花叶的提取,张瑞等对孔雀草干花瓣进行了黄酮类色素提取,确定了干花中黄酮提取的最佳提取条件[8]。但由于孔雀草的种植受季节的影响,只能春种、夏秋收获,且易受病虫害影响,致使在利用孔雀草花瓣提取黄酮类色素时原料相对不足。为解决这一难题,本实验利用植物组织培养技术具有不受季节、气候、空间的限制,细胞生长迅速、周期短、产量高等的优点,进行细胞培养生产黄酮类色素。目前植物组织培养技术在红豆杉、雪莲等制备药用成分研究中应用广泛,是植物天然产物工业化生产的重要手段。采用孔雀草愈伤组织进行悬浮细胞培养生产黄酮类化合物,国内外尚未见报道。本实验以孔雀草叶片为外植体诱导愈伤组织建立孔雀草悬浮培养体系,并测定悬浮细胞中总黄酮含量,确定了提取工艺的最佳条件,为大规模开展孔雀草细胞培养生产黄酮类物质提供科学依据,为缓解药用植物资源不足、开发可持续利用的药用资源另辟蹊径。
1 材料与方法
1.1材料与仪器
孔雀草种子实生苗采自陕西秦岭山区;芦丁标准品中国药品生物制品检定所,纯度98%;乙醇,NaNO2,Al(NO3)3·9H2O,NaOH上海生化制品有限公司,分析纯;6-BA(6-苄基氨基嘌呤)、NAA(萘乙酸)、琼脂中国医药(集团)上海化学试剂公司;培养基MS培养基。
755B紫外可见分光光度计、雷磁pH计上海精密科学仪器有限公司;MC京制电子天平赛多利斯科学仪器有限公司;HH-8数字恒温水浴锅国华电器有限公司;LDZX-50KAS立式压力灭菌锅上海申安医疗器械厂;BCM-1000A生物洁净工作台苏州安泰空气技术有限公司;THZ-82B气浴恒温振荡器江苏正基仪器有限公司;Anke DI-4000B离心机上海安亭科学仪器厂。
1.2实验方法
1.2.1孔雀草愈伤组织的诱导及悬浮细胞培养孔雀草悬浮细胞系由孔雀草种子萌发的无菌苗叶片诱导愈伤组织,诱导的培养基为MS+1.0mg/L 6-BA+ 0.8mg/L NAA+7g/L琼脂+30g/L蔗糖[9],pH为5.8(下同),培养温度为(22±1)℃、光照强度为1500~2000Lx、每天光照时间12h。将诱导的愈伤组织转移至B5+ 0.5mg/L NAA+1.0mg/L 6-BA+30g/L蔗糖的液体培养基上,于摇床中进行悬浮培养。温度为(25±2)℃,转速160r/min,继代培养时加入等量的新鲜培养液,每7~10d继代1次,经过3~4继代培养可得到无性细胞系。将悬浮培养细胞经滤纸过滤,蒸馏水洗涤3次,称其鲜重;在45℃下烘干至恒重,称其干重,研钵研磨后过40目筛网备用。
1.2.2标准曲线的制作采用NaNO2-Al(NO)3-NaOH显色法测定标准曲线[10]。将芦丁标准品置于105℃下,恒温烘至恒重。精密称取芦丁标准品20mg置于100mL容量瓶中,加60%的乙醇溶解,定容至刻度,其浓度为0.2mg/mL,作为贮备液。精密移取2.5mL置于25mL容量瓶中加质量分数为5%的亚硝酸钠1mL,混匀,放置6min,加质量分数为10%硝酸铝1mL混匀,放置6min,加质量分数为4%NaOH 10mL,再加水至刻度,摇匀,放置15min,以不加标准品为空白对照,在310~600nm波长进行扫描,在510nm波长处有最大吸收。
精密吸取贮备液0、1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0mL分别置于25mL容量瓶中加质量分数为5%的亚硝酸钠1mL,混匀,放置6min,加质量分数为10%硝酸铝1mL混匀,放置6min,加质量分数为4%NaOH 10mL,再加水至刻度,摇匀,放置15min,以加芦丁为0的样品为空白,在510nm处测吸光度。以吸光度A为纵坐标,浓度C(mg/mL)为横坐标,绘制标准曲线,求出线性回归方程。
1.2.3孔雀草悬浮细胞总黄酮的提取称取研碎的孔雀草悬浮细胞0.1g置于25mL的容量瓶中,加入一定体积分数的乙醇提取,离心取上清,加蒸馏水定容至刻度。精确吸取2.5mL样品,加入质量分数为5%的亚硝酸钠1mL,混匀,放置6min,加质量分数为10%硝酸铝1mL混匀,放置6min,加质量分数为4%NaOH 10mL,再加水至25mL,摇匀放置15min,于510nm波长处测定吸光度;重复3次求平均值。根据回归方程计算提取物中总黄酮含量,并按下式计算孔雀草悬浮细胞中总黄酮得率。总黄酮得率(%)=(提取液中总黄酮的浓度×提取液的体积)/孔雀草悬浮细胞质量×100
1.2.4单因素实验设计按照1.2.3中的方法进行单因素提取实验,研究不同固液比、乙醇浓度、提取温度、提取时间分别对孔雀草悬浮细胞总黄酮得率的影响。
1.2.4.1固液比对孔雀草悬浮细胞总黄酮得率的影响准确称取0.1g孔雀草悬浮细胞5份,分别以1∶20、1∶25、1∶30、1∶35、1∶40g/mL为固液比,加入60%的乙醇,在50℃水浴中浸提2h,测定固液比对孔雀草悬浮细胞总黄酮得率的影响。
1.2.4.2乙醇浓度对孔雀草悬浮细胞总黄酮得率的影响准确称取0.1g孔雀草悬浮细胞5份,以1∶25为固液比,在50℃下,分别采用体积分数为40%、50%、60%、70%、80%的乙醇为浸提剂,浸提2h,测定不同乙醇浓度对孔雀草悬浮细胞总黄酮得率的影响。
1.2.4.3提取温度对孔雀草悬浮细胞总黄酮得率的影响准确称取0.1g孔雀草悬浮细胞5份,以1∶25固液比,加入70%的乙醇,分别在40、50、60、70、80℃下浸提2h,测定不同提取温度对孔雀草悬浮细胞黄酮得率的影响。
1.2.4.4提取时间对孔雀草悬浮细胞总黄酮得率的影响准确称取0.1g孔雀草悬浮细胞5份,固液比为1∶25,乙醇浓度70%,在60℃水浴下分别浸提1、2、3、4、5h,测定不同提取时间的对孔雀草悬浮细胞黄酮得率的影响。
1.2.5响应面法对孔雀草悬浮细胞总黄酮提取工艺的优化在单因素实验结果的基础上,利用响应面法确定影响水平,根据Box-Benhnken的中心组合实验设计[11],采用四因素三水平进行实验,得到最佳提取条件,以提高总黄酮的产量,实验设计如表1。
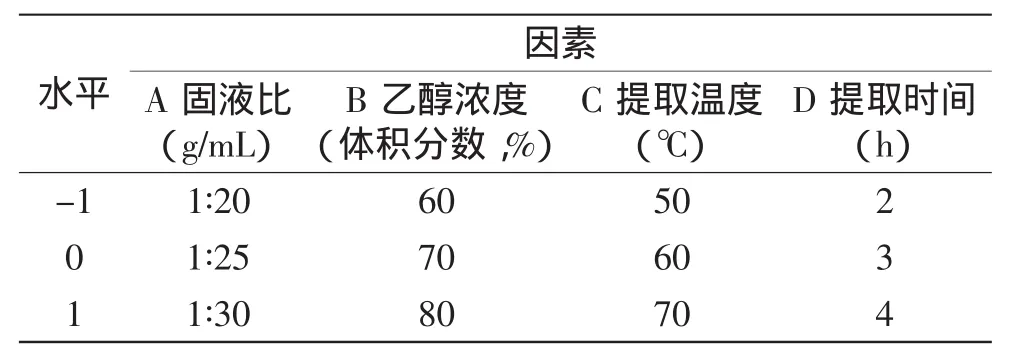
表1 响应面实验因素与水平Table 1 Factors and levels of response surface experiment
1.3数据处理
单因素实验数据采用Excel 2007进行分析,每组实验均平行重复三次。实验结果以平均值±标准误(M±SE)表示。响应面分析采用Design-Expert V8.0.6.1软件进行数据处理。
2 结果与分析
2.1标准曲线回归方程
按照芦丁标准曲线的绘制方法得到芦丁吸光度的标准曲线,结果如图1所示。其回归方程为:y= 11.554x+0.0135,相关系数R2=0.9992,线性关系良好。
2.2单因素实验结果与分析
2.2.1不同固液比对孔雀草悬浮细胞总黄酮得率的影响不同固液比的浸提效果如图2所示,固液比在1∶20~1∶25时,总黄酮的得率呈上升趋势,1∶25时得率最高,超过1∶25后总黄酮的得率呈现下降趋势。造成这种趋势的可能原因是在一定的固液比范围内,孔雀草悬浮细胞中的黄酮类物质溶出,随着固液比的增大而增加,当固液比达到1∶25时,黄酮类物质溶出速度达最大。黄酮达到溶解平衡后再提高固液比不会促进黄酮的提取,反而会增大杂质的溶出而影响提取结果。考虑到实验成本,故选取固液比为1∶25为宜。
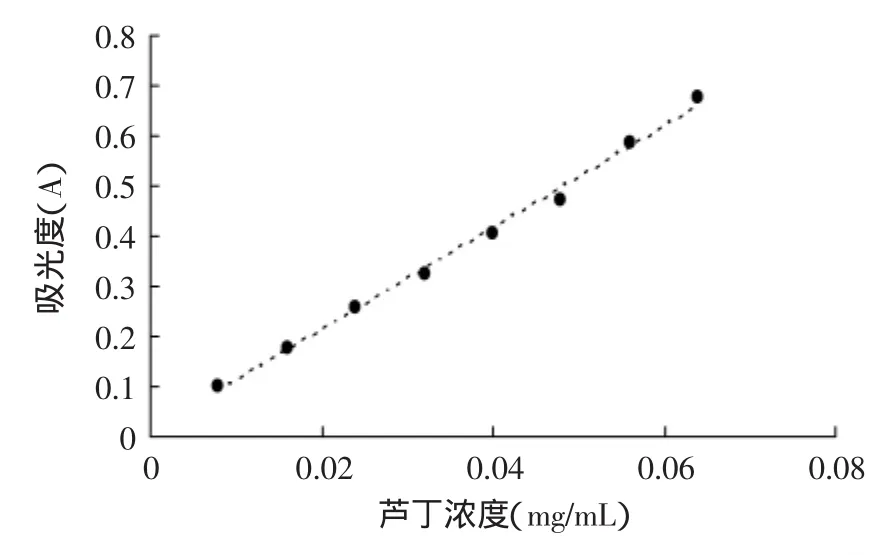
图1 芦丁标准曲线Fig.1 Calibration curve of rutin

图2 固液比对黄酮得率的影响Fig.2 Influence of liquid/solid ration on extraction rate of total flavonoids
2.2.2不同乙醇浓度对总黄酮得率的影响从图3可以看出,随着乙醇浓度的增大,黄酮得率逐渐增加,乙醇浓度70%时黄酮得率达最高,之后增加乙醇浓度,提取效果反而下降。这可能由于乙醇浓度较低时,随着乙醇浓度的增大黄酮类化合物的溶解度也增加;但乙醇浓度过高时,一些脂溶性杂质的浸出量也增多,这使黄酮类化合物的溶解度降低,从而导致总黄酮得率下降,所以最终确定乙醇浓度为70%。

图3 乙醇浓度对黄酮得率的影响Fig.3 Influence of ethanol concentration on extraction rate of total flavonoids
2.2.3不同提取温度对总黄酮得率的影响由图4的结果可知,孔雀草悬浮细胞黄酮的得率在40~60℃时,黄酮得率随温度的升高而增加,但超过70℃后,随温度的升高得率反而降低。这可能是由于温度的升高,促进了黄酮类化合物的溶解,但温度过高会使黄酮类化合物氧化,因此本实验适宜提取温度60℃。
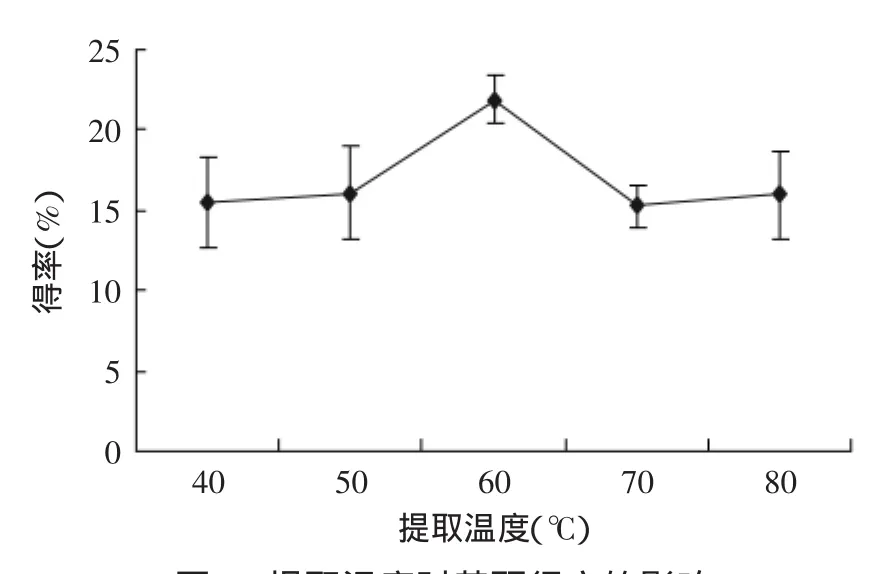
图4 提取温度对黄酮得率的影响Fig.4 Influence of extraction temperature on extraction rate of total flavonoids
2.2.4不同提取时间对总黄酮得率的影响从图5可知,孔雀草悬浮细胞黄酮得率在1~3h之间时,随着提取时间的增加而增加,提取3h时达最高,3h后随着时间的延长得率反而降低。这可能是由于在一定的提取时间内,黄酮类化合物已充分溶出,延长提取时间反而使黄酮类物质被氧化分解导致黄酮得率下降,故适宜的取提取时间3h。
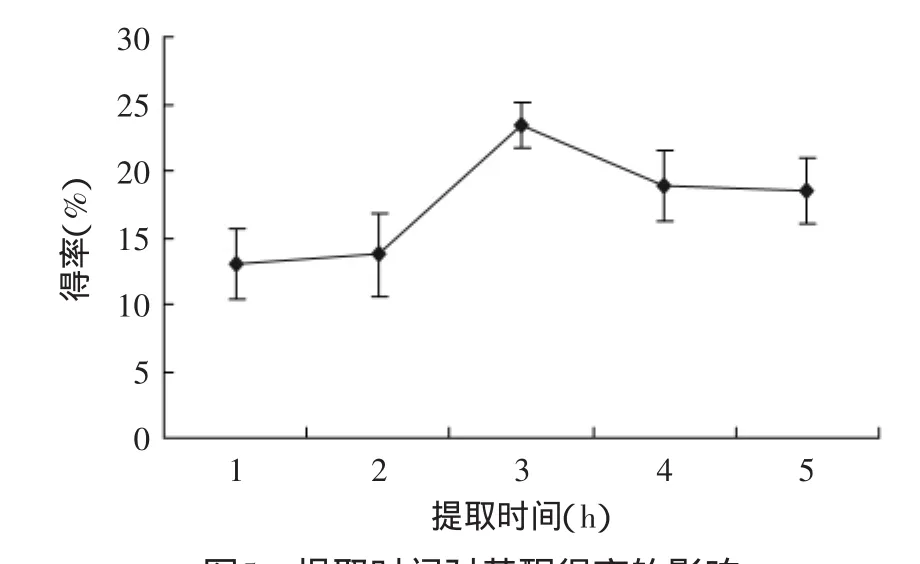
图5 提取时间对黄酮得率的影响Fig.5 Influence of extraction time on extraction rate of total flavonoids
2.3孔雀草悬浮细胞总黄酮提取响应面优化分析
2.3.1模型的建立及显著性检验采用Design-Expert V8.0.6.1软件处理数据,以黄酮得率为响应面值,对表2数据进行多项式回归分析,得到以孔雀草悬浮细胞黄酮的得率的二次多元回归方程:Y=-154.89175+4.76867A+1.42168B+1.37580C+16.22067D-5.00000× 104AB+1.00000×103AC-0.103505AD+2.45000×103BC+2.50000×103BD-0.015500CD-0.090760A2-0.010852B2-0.012953C2-2.00900D2。

表2 响应面设计方案及响应值Table 2 Experiment design and result of response surface method analysis
由表3可以看出,该模型高度显著(p<0.0001),失拟项不显著(p=0.0574>0.01),相关系数较高(R2= 0.9696),表明该模型可以解释96.96%的实验;变异系数(CV)反映模型的精确度,CV值越低,模型的可靠性越高。本实验的CV为2.09%,说明其置信度较高,能够较好地反映真实的实验值,可用此模型分析响应值的变化。
由表3还可以看出,在四个因素中,一次项A、C和交互作用项AD的影响差异显著(p<0.05),一次项B和D、二次项A2、B2、C2和D2的影响差异极显著(p<0.01),其余均不显著(p>0.05)。各因素按影响大小排序为:提取时间D>乙醇浓度B>提取温度C>固液比A。
2.3.2响应面交互作用的分析与优化通过Design Expert软件对各因素之间的交互作用进行响应面分析,绘制响应面曲线图。响应面坡度可反映单因素对总黄酮得率的影响,坡度越陡,影响越显著。等高线图可直观反映各因素间交互作用的显著程度,其中椭圆形表示两因素间交互作用显著,圆形表示两因素间交互作用弱。在同一椭圆型的区域内总黄酮得率相同,椭圆形中心总黄酮得率最高,往边缘得率随之减少;椭圆排列密集表明该因素的变化对总黄酮得率影响越大[12]。图6~图11分别显示6组以总黄酮得率为响应值的趋势图。
由图6可知固液比对响应值的影响大于乙醇浓度。在固液比一定时,总黄酮得率随着乙醇浓度的提高而增大;超过75%后总黄酮得率略有下降。乙醇浓度一定时,总黄酮得率随固液比的增大而增大,超过1∶28后总黄酮得率略有下降。

表3 回归模型的方差分析Table 3 Variance analysis of regression model

图6 乙醇浓度和固液比对总黄酮得率的影响Fig.6 Effect of ethanol concentration and liquid/solid ratio on extraction rate of total flavonoids
从图7可知,固液比在1∶20~1∶26时,固液比增大黄酮得率亦上升,超过1∶26后得率下降;在固液比一定时,延长提取时间黄酮得率亦提高,达到最高值后下降。
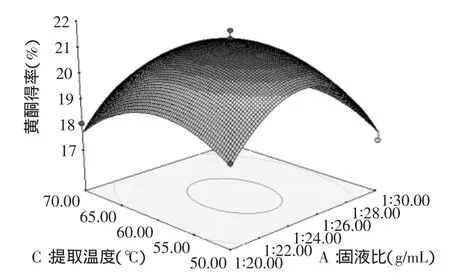
图7 提取温度和固液比对总黄酮得率的影响Fig.7 Effect of extraction temperature and liquid/solid ratio on extraction rate of total flavonoids
由图8可以看出,响应面的坡度很陡,提取时间和固液比的交互作用显著,提取时间对响应值的影响大于固液比。在固液比一定时,随提取时间的增加得率增加明显,黄酮得率达到最高值后下降。

图8 提取时间和固液比对总黄酮得率的影响Fig.8 Effect of extraction time and liquid/solid ratio on extraction rate of total flavonoids
由图9可知,响应面的坡度较缓,提取温度和乙醇浓度的交互作用较弱,对总黄酮得率的影响不显著。

图9 提取温度和乙醇浓度对总黄酮得率的影响Fig.9 Effect of extraction temperature and ethanol concentration on extraction rate of total flavonoids
图10表明,总黄酮得率随提取时间的增加和乙醇浓度的提高增加,达最高后下降,提取时间对总黄酮得率的影响比乙醇浓度影响大。

图10 提取时间和乙醇浓度对总黄酮得率的影响Fig.10 Effect of extraction time and ethanol concentration on extraction rate of total flavonoids
图11中等高线呈圆形,表明提取时间和提取温度的交互作用不显著,提取时间对黄酮得率的影响比提取温度大。随着提取时间和提取温度的增加黄酮得率呈上升趋势,适当的延长提取时间有利于黄酮充分的扩散和浸出,且温度的升高可以促使分子解吸,加快扩散速度,从而提高总黄酮的得率;但温度过高和时间过长使总黄酮被氧化,导致得率降低[12]。

图11 提取时间和提取温度对总黄酮得率的影响Fig.11 Effect of extraction time and extraction temperature on extraction rate of total flavonoids
2.3.3验证实验通过软件分析,得到孔雀草悬浮细胞总黄酮的提取工艺最佳条件为:固液比为1∶24.56(g/mL),乙醇浓度为71.96%,提取温度为58.93℃,提取时间为3.22h。为检验该提取工艺的可靠性,考虑到实际操作的方便性,采用固液比为1∶25,乙醇浓度为72%,提取温度为59℃,提取时间为3.2h,在此条件下进行3次平行实验,实际测得孔雀草悬浮细胞总黄酮的得率平均值为21.37%,与理论预测值21.49%相对偏差仅为0.12%,实验结果与模型相符,说明采用响应面分析法所得的孔雀草悬浮细胞总黄酮的提取条件参数准确可靠。
3 结论与讨论
孔雀草悬浮细胞总黄酮的提取工艺中,固料比、乙醇浓度、提取时间和提取温度4个因素,提取时间和乙醇浓度达到极显著水平,提取温度和液料比达到显著水平,其影响大小依次为:提取时间>乙醇浓度>提取温度>固液比。孔雀草悬浮细胞总黄酮最佳的提取条件为:固液比1∶25,乙醇浓度72%,提取温度59℃,提取时间3.2h,总黄酮得率可达21.37%,与理论值相差0.12%,说明该模型能较好地预测各因素与得率之间的关系。
目前,对孔雀草天然色素及药用成分的利用重要是通过干花直接提取,而通过测定孔雀草悬浮细胞的总黄酮含量,优化其最佳工艺条件,为植物组织培养生产天然素色及药用成分等次生代谢产物的开发与利用奠定基础,在一定程度上打破地域和季节的限制,弥补了天然植物材料的不足,也为今后的研究提供合理的科学依据。
[1]罗祥华.摘心和植物生长延缓剂对盆栽孔雀草生长发育的影响研究[D].长沙:湖南农业大学,2006.
[2]Politi AS,Figueira M,Araujo AM.,et al.Acaricidal activity of ethanolic extract from aerial parts of Tagetes patula L.(Asteraceae)against larvae and engorged adult females of Rhipicephalus sanguineus[J].Parasites and Vectors,2012,5:295.
[3]Politi AS,Moreira TM,Rodriguse ER,et al.Chemical characterization and acaricide potential of essenti al oil from aerial parts of Tagetes patula L.(Asteraceae)against engorged adult females of Rhipicephalus sanguineus[J].Parasites and Vectors,2013,112:2261-2268
[4]姚德权.万寿菊和孔雀草的形态特征与区分[J].科技创新导报,2010(13):140.
[5]李娜.微波辅助提取万寿菊花总黄酮的工艺研究[J].应用化工,2009,38(10):1476-1478.
[6]张瑞,邢军,张娟,等.响应面法优化万寿菊中类胡萝卜素的提取工艺[J].食品工业科技,2012,33(22):319-321
[7]李刚刚.万寿菊中叶黄素及黄酮的提取与纯化工艺研究[D].兰州:兰州理工业大学,2010.
[8]张瑞,邢军.孔雀草中黄酮类色素最佳提取工艺条件及光、热稳定性的研究[J].食品研究与开发,2008,29(11):38-41.
[9]袁云香.金属元素与植物组织培养[M].西北农林科技大学出版社,2013
[10]刘细祥,马博,张婷婷,等.响应面法优化麻疯树籽壳提取总黄酮工艺[J].食品工业科技,2014,35(6):284-287,291.
[11]郑燕菲,刘雄民,郭占京,等.巨尾桉叶总黄酮提取条件及其抗氧化抑菌研究[J].食品工业科技,2013,33(21):109-111.
[12]陈源,杨道富,范丽华,等.响应面法优化微波提取茂谷橘橙皮总黄酮工艺[J].中国食品学报,2013,13(4):80-86.
Optimization of technology for total flavonoids from of suspension cell Tagetes patula L.by respone surface methodology
YUAN Yun-xiang
(College of Chemistry and Life Science,Weinan Teachers University,Weinan 714099,China)
The callus induced from the leaf of Tagetes patula L.were suspended in liquid medium.Optimization of flavonoids extraction process carried out in suspension cell culture through a single factor experiment and response surface method.The solid-liquid ratio,ethanol concentration,extraction temperature and extraction time on the extraction of flavonoids were investigated.Analysing by response surface method,the optimum technological condition for suspension cell were ethanol concentration 72%,the mass ratio 1∶25g/mL,extracting time 3.2h and extracting temperature 59℃.Under this condition the theoretical extraction rate of flavonoids was 21.49%,validation value was up to 21.37%.The relative error between theoretical and validation was 0.12%.
Tagetes patula L.;callus;suspension cell culture;flavonoids
TS201.1
B
1002-0306(2015)10-0220-06
10.13386/j.issn1002-0306.2015.10.037
2014-08-29
袁云香(1980-),女,硕士,副教授,主要从事植物学及其次生代谢产物方面的研究。
国家自然科学基金项目(31000410);渭南师范学院校级理科类项目(14YKS003);渭南师范学院特色学科建设项目(14TSXK04)。

