枣叶黄酮类成分的分离鉴定及其抗氧化活性研究
李喜悦,高 哲,崔 璨,安小楠,王荣芳,崔 同
(河北农业大学食品科技学院,河北保定071000)
枣叶黄酮类成分的分离鉴定及其抗氧化活性研究
李喜悦,高哲,崔璨,安小楠,王荣芳,崔同*
(河北农业大学食品科技学院,河北保定071000)
对枣叶的乙醇提取物经乙酸乙酯萃取、高效液相色谱反复制备纯化,得到5种化合物。经LC-MS、1H NMR和13C NMR进行鉴定,分别为:槲皮素-3-O-洋槐糖苷(1)、槲皮素-3-O-芸香糖苷(2)、槲皮素-3-O-β-D-葡萄糖苷(3)、山奈酚-3-O-芸香糖苷(4)、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷(5)。对5种黄酮单体化合物清除ABTS+、DPPH自由基的活性进行了比较,结果表明5种化合物清除ABTS+、DPPH自由基的活性呈现出相同的趋势,其中化合物3表现出最强的活性,化合物1、2、5活性适中,化合物4的活性最低。
枣叶,黄酮,分离纯化,结构鉴定,清除自由基
枣(Ziziphus jujuba Mill.)和酸枣(Ziziphus jujuba Mill.var.spinosa(Bunge)Hu ex H.F.Chow)为鼠李科(Rhamnaceae)枣属植物,其栽培利用已有数千年历史,其相关研究,尤其针对红枣的栽培、加工、成分分析、药理等方面的研究已经非常深入[1-2]。然而关于枣叶方面的研究目前的报道并不多见[3]。在我国民间一直有将枣叶做成茶来饮用的习惯,近年研究表明枣叶中含有丰富的黄酮类化合物[4-6],这些研究可追溯到前苏联学者于1967年从酸枣叶中分离出高含量(1.5%~1.6%)的芦丁[7]。然而目前为止,虽然已经有枣叶中存在芦丁、山奈酚-3-O-芸香糖苷、槲皮素-3-O-β-D-木糖-(1→2)-α-L-鼠李糖苷等黄酮类化合物的报道[4-6],然而有关枣叶中黄酮类成分具体的分离过程及结构鉴定和保健活性方面的研究并未见报道。本研究拟对枣叶中的黄酮类化合物进行系统的分离纯化和结构分析,并对其清除自由基的活性进行评价,为枣叶生物资源的综合开发利用提供参考。
1 材料与方法
1.1材料与仪器
枣叶采自河北农业大学标本园(2013年10月7日),采后自然风干,放置在真空干燥器中备用;氘代甲醇北京伊诺凯科技有限公司;四甲基硅北京博雅大北科技开发公司;乙腈Honeywell Burdick& Jackson公司,色谱纯,高效液相色谱(HPLC)流动相用;纯净水杭州娃哈哈集团有限公司;其余试剂分析纯。
Agilent 1200型HPLC(由在线脱气机,四元输液泵,光电二极管阵列检测器以及Agilent Chemstation色谱工作站组成)Agilent公司;CO-3010柱恒温控制箱天津美瑞泰克科技有限公司;LC3000型制备型HPLC北京创新通恒科技有限公司,配用SinoChrom ODS-BP C18色谱柱(300mm×20mm i.d.,10μm);LC-MS系统(由Agilent 1200型LC、Agilent 6310型MS检测器组成)Agilent公司;Avance III 600 MHz型核磁共振仪Bruker公司;TU-1810型紫外可见分光光度计北京普析通用仪器有限责任公司;RE-5210型旋转蒸发器上海亚荣生化仪器厂;ST-02A型多功能粉碎机永康市帅通工具有限公司。
1.2枣叶黄酮的提取与分离
取枣叶样品900g,用多功能粉碎机粉碎,加入80%乙醇9L,不定期搅拌,室温浸提40h后将乙醇滤出,再加入95%乙醇9L重复提取一次,合并乙醇提取液,用旋转蒸发器减压浓缩回收乙醇,得到绿色浸膏。向浸膏中加入适量的水混悬,依次用等体积的石油醚、乙酸乙酯、正丁醇萃取。分别得到石油醚萃取物68g,乙酸乙酯萃取物30g,正丁醇萃取物32g。其中乙酸乙酯萃取物经制备型高效液相色谱反复分离纯化,得到化合物1、2、3、4、5。
1.3枣叶黄酮的LC-MS分析
将得到的化合物1~5溶解于甲醇中,配成浓度为100μg/mL的混和样液,用LC-MS联用仪进行分析。
车内便是整个世界。搏杀与互侵的世界。没有强弱没有输赢的世界。长长久久的世界。当一切风平浪静的时候,空气里飘荡着湿濡温润的芬芳,这气息,在柔软和刚强的缠绕里,在渐强渐微的呢喃里化成细绢一样的薄霭凝结在四边的玻璃上。
LC条件:色谱柱为Hypersil BDS C18(4.6mm× 250mm,5μm);柱温:30℃;流动相:A:500μL/L甲酸水溶液;B:乙腈含500μL/L的甲酸;线性梯度洗脱程序:0min,15%B;27min,15%B;32min,17%B;47min,17%B;49min,22%B;65min,26%B;70min,100%B;75min,100%B;77min,15%B;87min,15%B;流速:0.6mL/min;检测波长:360nm;进样量:5μL。
MS条件:ESI离子源,阴离子检测模式,喷雾器压力:45psi;干燥气体温度:350℃,干燥气(N2)流速:12L/min;离子阱质量分析器扫描范围:m/z=100~1000。
1.4核磁共振分析
称取化合物1~5各20mg,分别用氘代甲醇溶解,以四甲基硅为基准试剂,在核磁共振仪上进行氢谱(1H NMR)和全去偶碳谱(13C NMR)分析。
1.5清除ABTS+·活性测定
按照文献[8],将ABTS溶于甲醇中制备成7mmol/L的储备液;取5mL ABTS储备液和88μL 140mmol/L的过硫酸钾溶液混合,超声混匀,在室温、避光条件下静置过夜,形成ABTS+·储备液,最后将生成的ABTS+·储备液用甲醇稀释(现用现配),使其在734nm波长下的吸光度为0.70±0.02,即得到ABTS+·工作液,将其避光保存。
取ABTS+·工作液4mL加入具塞试管,分别向其中加入0.04mL不同浓度的样品甲醇溶液,漩涡混匀,30℃水浴避光反应15min[9],734nm测定吸光度值A,每个样品做三个平行。同时以0.04mL甲醇替代样品溶液做空白实验,每个浓度平行测定三次。根据以下公式计算ABTS+·的清除率:
ABTS·+清除率(%)=[1-A/A0]×100
其中:A为样品溶液吸光度的值,A0为空白溶液吸光度的值。
分别以各样品的不同浓度与其对应的ABTS·+自由基清除率作图。
1.6清除DPPH·活性测定
按照文献方法[10],配制25mg/L的DPPH·甲醇溶液(现用现配,避光放置)。清除DPPH自由基活性测定参考文献[11]。取一定浓度DPPH·甲醇溶液3.9mL加入具塞试管,向其中加入0.1mL不同浓度的被测溶液,漩涡混匀,30℃保温,避光反应40min,于515nm测定吸光度值A,每个样品做三个重复,同时以0.1mL甲醇替代抗氧化剂溶液做空白实验,每个浓度平行测定三次。根据以下公式计算DPPH·的清除率:
DPPH·清除率(%)=[1-A/A0]×100
其中:A为样品溶液吸光度的值,A0为空白溶液吸光度的值。
分别以各样品的不同浓度与其对应的DPPH·自由基清除率作图。
2 结果与分析
2.1化合物1~5的结构鉴定
化合物1:黄色粉末;UV λmaxnm:245,365(甲醇);(-)ESI-MS m/z 609.2[M-H]-;1H NMR(CD3OD,600MHz):δ 7.90(1 H,d,J=1.8Hz,H-2′),7.62~7.63(1 H,dd,J=8.4,1.8Hz,H-6′),6.89~6.90(1 H,d,J= 8.4Hz,H-5′),6.43(1 H,d,J=1.8Hz,H-8),6.23(1 H,d,J=1.8Hz,H-6),5.09~5.10(1 H,d,J=7.8Hz,H-1″),4.45(1 H,s,H-1‴),1.20~1.21(3 H,d,J=6.0Hz,CH3-6‴)。13C NMR(CD3OD,125MHz):δ 178.11(C-4),164.73(C-7),161.67(C-5),157.61(C-9),157.09(C-2),148.60(C-4′),144.36(C-3′),134.48(C-3),121.66(C-6′),121.45(C-1′),116.56(C-5′),114.73(C-2′),104.58(C-10),102.86(C-1″),100.55(C-1‴),98.58(C-6),93.44(C-8),73.97(C-5″),73.71(C-3″),72.50(C-4‴),71.47(C-2″),70.92(C-3‴),70.67(C-2‴),68.81(C-4″),68.33(C-5‴),66.02(C-6″),16.55(C-6‴)。以上数据与文献[12]一致,故鉴定化合物1为槲皮素-3-O-洋槐糖苷(Quercetin-3-O-robinobioside),其结构如图1所示。
化合物2:黄色粉末;UV λmaxnm:245,365(甲醇);盐酸-镁粉反应为阳性,(-)ESI-MS m/z 609.2[M-H]-;通过与芦丁标准品对比,其液相色谱保留时间及质谱离子碎片完全一致,故鉴定化合物2为芦丁,即槲皮素-3-O-芸香糖苷(Quercetin-3-O-rutinoside),其结构如图1所示。
化合物3:黄色粉末;UV λmaxnm:257,359(甲醇);(-)ESI-MS m/z 463.2[M-H]-;1H NMR(CD3OD,600MHz):δ 7.73(1 H,d,J=1.8Hz,H-2′),7.60~7.62(1 H,dd,J=8.4,1.8Hz,H-6′),6.88~6.90(1 H,d,J=8.4Hz,H-5′),6.41(1 H,d,J=1.8Hz,H-8),6.23(1 H,d,J=1.8Hz,H-6),5.27~5.28(1 H,d,J=7.2Hz,H-1″)。13C NMR(CD3OD,125MHz):δ 176.56(C-4),163.05(C-7),160.07(C-5),156.15(C-9),155.52(C-2),146.93(C-4′),142.96(C-3′),132.76(C-3),120.33(C-6′),120.18(C-1′),114.73(C-5′),113.12(C-2′),102.79(C-10),101.53(C-1″),97.01(C-6),91.86(C-8),75.44(C-5″),75.21(C-3″),72.84(C-2″),68.32(C-4″),59.68(C-6″)。以上数据与文献[13]一致,故鉴定化合物3为槲皮素-3-O-β-D-葡萄糖苷(Quercetin-3-O-β-D-glucoside),其结构如图1所示。
化合物4:黄色粉末;UV λmaxnm:265,350(甲醇);(-)ESI-MS m/z 593.2[M-H]-;1H NMR(CD3OD,600MHz):δ 8.08~8.09(2 H,d,J=8.4Hz,H-2′,6′),6.91~6.92(2 H,d,J=8.4Hz,H-3′,5′),6.43(1 H,s,H-8),6.24(1 H,s,H-6),5.15~5.16(1 H,d,J=7.2Hz,H-1″),4.53(1 H,s H-1‴),1.20(3 H,d,J=6.6Hz,H-6‴)。13C NMR(CD3OD,125MHz):δ 178.04(C-4),164.67(C-7),161.62(C-5),160.10(C-4′),158.03(C-9),157.18(C-2),134.13(C-3),130.98(C-2′,6′),121.38(C-1′),114.75(C-3′,5′),104.28(C-10),103.20(C-1″),101.03(C-1‴),98.59(C-6),93.53(C-8),76.77(C-3″),75.84(C-5″),74.38(C-2″),72.51(C-4‴),70.92(C-4″),70.70(C-3‴),70.07(C-2‴),68.34(C-5‴),67.18(C-6″),16.50~16.95(C-6‴)。以上数据与文献[14]一致,故鉴定化合物4为山奈酚-3-O-芸香糖苷(Kaempferol-3-O-rutinoside),其结构如图2所示。
化合物5:黄色粉末;UV λmaxnm:265,355(甲醇);(-)ESI-MS m/z 579.2[M-H]-;1H NMR(CD3OD,600MHz):δ 7.38~7.39(1 H,d,J=1.8Hz,H-2′),7.32~7.34(1 H,dd,J=8.4,1.8Hz,H-6′),6.94~6.95(1 H,d,J=8.4Hz,H-5′),6.39(1 H,d,J=1.80Hz,H-8),6.22~6.23(1 H,d,J=1.80Hz,H-6),5.40(1 H,s,H-1″),4.22~4.23(1 H,d,J=7.2Hz,H-1‴),4.21(1 H,d,J=2.4Hz,H-2″),1.03~1.04(3 H,d,J=6.0Hz,CH3-6‴)。13C NMR(CD3OD,125MHz):δ 178.41(C-4),164.41(C-7),161.82(C-5),157.76(C-9),157.12(C-2),148.41(C-4′),145.07(C-3′),135.45(C-3),121.59(C-6′),121.37(C-1′),115.50(C-5′),115.12(C-2′),106.39(C-1‴),104.50(C-10),101.84(C-1″),98.45(C-6),93.37(C-8),81.27(C-2″),72.94(C-3‴),72.42(C-2‴),71.44(C-4‴),70.64(C-3″),70.39(C-4‴),68.46(C-5″),66.04(C-5‴),16.32~16.96(C-6″)。以上部分数据与文献[15]槲皮素-3-O-α-L-阿拉伯糖一致,结合其他核磁数据,鉴定化合物5为槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷(Quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside),其结构如图1所示。
除以上5种成分外,从枣叶的乙酸乙酯提取物中还分离纯化出另外两种黄酮类成分,但因含量较低未能完成结构鉴定。

图1 化合物1、2、3、5的化学结构Fig.1 Chemical structures of compound 1,2,3,5

图2 化合物4的化学结构Fig.2 Chemical structure of compound 4
2.2枣叶黄酮类化合物的抗氧化活性
通过ABTS法和DPPH法测定了5种枣叶黄酮类化合物在0.04~0.20mg/mL质量浓度范围内的抗氧化活性。清除ABTS+·自由基能力的结果如图3所示,清除DPPH·自由基能力的结果如图4所示。

图3 枣叶5种黄酮清除ABTS+·能力的比较Fig.3 The effect of 5 flavonoids from jujube leaves on scavenging ABTS+·
由图3、图4可以看出,同一浓度下5种黄酮类化合物清除DPPH·自由基的活性要远强于其清除ABTS+·自由基的能力。槲皮素-3-O-β-D-葡萄糖苷清除DPPH·和ABTS+·自由基的活性均最强,其次为槲皮素-3-O-洋槐糖苷、槲皮素-3-O-芸香糖苷、槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷,这3种化合物表现出相当的抗氧化活性。而山奈酚-3-O-芸香糖苷抗氧化活性很弱。黄酮苷的抗氧化活性主要取决于苷元部分。槲皮素的B环上所具有的邻位羟基是其具有较强抗氧化活性的关键所在,而以山奈酚为苷元的山奈酚-3-O-芸香糖苷,因苷元的B环不存在邻位羟基,因此较其他4种黄酮的抗氧化活性明显要低。此外,黄酮苷上所连接的糖的数量和种类也对抗氧化活性有影响。仅带一个葡萄糖的槲皮素-3-O-β-D-葡萄糖苷表现出最强的抗氧化活性,而其他3种槲皮素-3-O双糖苷表现出适中的抗氧化活性,这与以往研究报道的规律一致[16-17]。
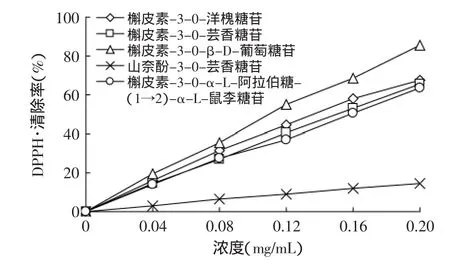
图4 枣叶5种黄酮清除DPPH·能力的比较Fig.4 The effect of 5 flavonoids from jujube leaves on scavenging DPPH
3 结论
对枣叶中黄酮类化合物进行了提取分离和结构鉴定,并对各单体黄酮的抗氧化活性进行了评价,发现枣叶中主要含有5种黄酮类化合物,为槲皮素-3-O-洋槐糖苷、槲皮素-3-O-芸香糖苷、槲皮素-3-O-β-D-葡萄糖苷、山奈酚-3-O-芸香糖苷和槲皮素-3-O-α-L-阿拉伯糖-(1→2)-α-L-鼠李糖苷。其中槲皮素-3-O-β-D-葡萄糖苷表现出较强的清除ABTS+·和DPPH·自由基的活性,其余3种槲皮素苷也具有一定的清除活性,而山奈酚-3-O-芸香糖苷的活性较弱。
[1]李淑子,张本.大枣的化学和药理研究概况[J].中草药,1983,14(10):39-43.
[2]Gao Q H,Wu C S,Wang M.The jujube(Ziziphus jujuba Mill.)fruit:a review of current knowledge of fruit composition and health benefits[J].J Agric Food Chem,2013,61(14):3351-3363.
[3]车勇,郑冰清,滕勇荣,等.酸枣叶化学成分的研究[J].中成药,2012,34(4):686-688.
[4]Guo S,Duan J A,Tang Y P,et al.Simultaneous qualitative and quantitative analysis of triterpenic acids,saponins and flavonoids in the leaves of two Ziziphus species by HPLC-PDAMS/ELSD[J].J Pharm Biomed Anal,2011,56(2):264-270.
[5]Zhang R,Chen J,Shi Q,et al.Quality control method for commercially available wild jujube leaf tea based on HPLC characteristic fingerprint analysis of flavonoid compounds[J].J Sep Sci,2014,37(1-2):45-52.
[6]Zhang R,Chen J,Shi Q,et al.Phytochemical analysis of Chinese commercial available Ziziphus jujube leaf tea using high performance liquid chromatography-electrospray ionization-time of flight mass spectrometry[J].Food Res Int,2014,56:47-54.
[7]曲泽洲,王永惠,刘孟军.酸枣的化学成分及其药理研究[J].河北农业大学学报,1987,10(2):60-66.
[8]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS+radical cation decolorization assay[J].Free Radical Biol Med,1999,26(9):1231-1237.
[9]林恋竹,赵谋明.反应时间对DPPH·法、ABTS+·法评价抗氧化性结果的影响[J].食品科学,2010,31(5):63-66.
[10]何童森.山楂中红果酸GC-MS分析方法的建立及黄烷醇抗氧化作用研究[D].保定:河北农业大学,2011.
[11]Brand-williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].Lebensm-Wiss Technol,1995,28:25-30.
[12]郝福玲,方访,凌铁军,等.夹竹桃叶化学成分的研究[J].安徽农业大学学报,2013,40(5):795-801.
[13]Deng S,Deng Z,Fan Y,et al.Isolation and purification of three flavonoid glycosides from the leaves of Nelumbo nucifera(Lotus)by high-speed counter-current chromatography[J].J Chromatogr B,2009,877(24):2487-2492.
[14]Juan-Badaturuge M,Habtemariam S,Thomas M J K. Antioxidant compounds from a South Asian beverage and medicinal plant,Cassia auriculata[J].Food Chem,2011,125(1):221-225.
[15]石心红,王宇行,孔令义.准噶尔大戟根中黄酮类成分的研究[J].中国药学杂志,2006,41(20):1538-1540.
[16]Luo Y,Li X,He J,et al.Isolation,characterisation,and antioxidantactivitiesofflavonoidsfromchufa(Eleocharis tuberosa)peels[J].Food Chem,2014,164:30-35.
[17]Ammar R B,Bhouri W,Sghaier M B,et al.Antioxidant and free radical-scavenging properties of three flavonoids isolated from the leaves of Rhamnus alaternus L.(Rhamnaceae):A structure-activity relationship study[J].Food Chem,2009,116(1):258-264.
Study on structural identification and antioxidant activity of flavonoids from jujube leaves
LI Xi-yue,GAO Zhe,CUI Can,AN Xiao-nan,WANG Rong-fang,CUI Tong*
(College of Food Science and Technology,Agricultural University of Hebei,Baoding 071000,China)
Five kind of flavonoids in the jujube leaves were obtained by the isolation with ethanol as the extraction reagent and subsequently purification of ethyl acetate fraction of the ethanol extract by a preparative HPLC,whose structures were verified by1H NMR and13C NMR.The five compounds were identified as quercetin-3-O-robinobioside(1),quercetin-3-O-rutinoside(2),quercetin-3-O-β-D-glucoside(3),kaempferol-3-O-rutinoside(4)and quercetin-3-O-α-L-arabinosyl-(1→2)-α-L-rhamnoside(5),respectively.All compounds were evaluated for antioxidant capacity against ABTS+and DPPH radicals.Results revealed similar trends for the capability of the five flavonoids to scavenge the ABTS+and DPPH radicals.Among them,compound 3 exhibited the highest activity and compound 1,2,and 5 showed moderate activity,while compound 4 revealed lower antioxidant capacity.
jujube leaves;flavonoids;isolation;structural identification;free radical scavengingactivity
TS201.1
A
1002-0306(2015)10-0135-04
10.13386/j.issn1002-0306.2015.10.019
2014-09-10
李喜悦(1990-),女,在读硕士研究生,研究方向:功能食品化学
崔同(1956-),男,博士,教授,研究方向:天然产物活性成分分析。
国家林业公益性行业科研专项(201304708)。

