新型工业油料作物亚麻荠油脂代谢工程
苑丽霞毛雪杨致荣薛金爱李润植
(1.山西农业大学分子农业与生物能源研究所,太谷 030801;2.晋中学院生物科学与技术学院,晋中 030600)
新型工业油料作物亚麻荠油脂代谢工程
苑丽霞1,2毛雪1杨致荣1薛金爱1李润植1
(1.山西农业大学分子农业与生物能源研究所,太谷 030801;2.晋中学院生物科学与技术学院,晋中 030600)
亚麻荠(Camelina sativa L. Crantz)是一种新型的“低投入、环保型”工业油料作物。种子含油量达43%,其中α-亚麻酸>35%。种子油不仅可做食用油和动物饲料,亦可用于加工保健功能食品,以及生物燃油和高值油脂产品。重点分析亚麻荠主要农艺性状和优异油脂性状,论述应用基因工程技术对亚麻荠油脂品质的遗传改良研究,包括长链多聚不饱和脂肪酸,ω-7脂肪酸,中、短链脂肪酸和蜡酯生物合成,以及单一脂肪酸富集途径的代谢组装。分析和讨论了亚麻荠功能基因组学研究动向以及亚麻荠产业发展前景。
亚麻荠;油脂;脂肪酸;生物燃油;代谢工程
随着石化能源的过渡消耗和生态环境的污染,寻找新的具有优良特性和开发潜力的绿色生物能源已成为当今全球可持续发展的迫切任务。近年来,亚麻荠油以独特的脂肪酸组成,在食品和健康领域、动物饲养、高值油脂化工品和生物能源等领域的应用持续增多,重新引起全球业界的广泛关注[1-7]。与油菜一样,亚麻荠(Camelina sativa L. Crantz)也是一种十字花科的油料作物,并且其生育期短(80-100 d),高抗逆境和病虫草害。亚麻荠栽培历史可追溯到青铜时代(大约公元前1500年-公元前400年),一直到第二次世界大战,以及20世纪50年代,亚麻荠在欧洲仍是一些国家和俄罗斯等地的重要油料作物[8-10]。现今,作为一种重新发掘出来的“低投入、环保型”的替代性工业油料作物,亚麻荠已在美洲、欧洲和大洋洲开始大面积种植[11],种子油也已应用于炼制航空燃油、生物柴油和其他油脂工业[12,13]。我国北方一些地区也不同规模地试种亚麻荠,一些单位也已开展亚麻荠油脂产品的研发[14]。本文结合作者课题组近年来对亚麻荠油脂代谢调控的研究,重点论述国内外亚麻荠种子油脂研究进展,尤其是种子油脂品质改良和油脂代谢工程,分析和讨论了亚麻荠功能基因组学研究动向及亚麻荠产业发展前景。
1 亚麻荠种子脂肪酸组成及特点
亚麻荠种子油的脂肪酸成分主要包括棕榈酸(16∶0)、硬脂酸(18∶0)、油酸(18∶1Δ9)、亚油酸(18∶2Δ9,12)、亚麻酸(18∶3Δ9,12,15)、花生酸(20∶0)、二十碳烯酸(20∶1Δ11)、芥酸(22∶1Δ13)等(表1)。亚麻荠种子油脂突出优点是含有多种对人体有益不饱和脂肪酸(油酸、亚油酸和亚麻酸),其中α-亚麻酸(ω-3脂肪酸)占总脂肪酸含量的28%-43%。而且还含有大量的长链脂肪酸,C20∶1的含量>10%[15]。ω-3脂肪酸具有降低血液中低密度脂蛋白及胆固醇,防护心脏及心血管的保健功能。食用亚麻油可使血液中低密度脂蛋白及胆固醇的浓度降低12.2%,而食用油菜籽油及橄榄油则分别只降低5.4%和7.7%[16]。亚麻酸还是人体内合成其他两种ω-3脂肪酸即EPA(二十碳五烯酸)和DHA(二十二碳六烯酸)的前体物质。EPA和DHA是构成人体细胞膜和细胞器膜的两种不饱和脂肪酸,在普通食用油中不含或含量很少。因而亚麻荠油是一种优良的营养保健食品,具有巨大的市场开发前景。芥酸(二十二碳-13-烯酸,C22:1Δ13)是十字花科植物共有特征,与低芥酸菜籽油(约2%)相近,亚麻荠油中芥酸平均含量约2.5%。因此,亚麻荠油既可以直接作为色拉油供人们烹调、烘烤和煎炸食用,也能加工成混合脂肪、蛋黄酱、调味剂、冰激凌等供人食用。亚麻荠油还是重要的工业原料,可加工成肥皂、洗涤剂、颜料和清漆等。亚麻荠油含有多不饱和脂肪酸对皮肤病的特殊效应,非常适合加工化妆品。此外,榨油后的油籽饼含40%蛋白质及其他营养成分,而且抗营养因子较少,亦是优质的畜禽饲料。

表1 亚麻荠油的脂肪酸组成[17-22]
亚麻荠种子含油量和脂肪酸组成受多种因素影响,包括品种基因型、种植地域、生长发育阶段、气候和土壤环境等,含油量变化范围在320-460 g/kg之间[21,22]。亚麻荠油中还含有甾醇(1-5 g/kg)、多酚(120-400 mg/kg)和生育酚(700 mg/kg)等多种脂质活性成分。正是这些化学成分增加了亚麻荠油的稳定性和生物活性,使亚麻荠油的氧化稳定性高于同样富含α-亚麻酸的亚麻籽油和鱼油。另外,亚麻荠的果壳含有大量的果胶,可用于提炼食用果胶。
2 亚麻荠农艺性状的遗传改良
亚麻荠作为重新发掘的“古老”新型油料作物,现今大面积种植的品种几乎都是传统品种,遗传改良主要集中在千粒重、含油量和某种特定脂肪酸含量等农艺性状[23]。在奥地利东部不同环境中条件下,对亚麻荠130个不同品种的农艺性状鉴定和评估试验显示[24],部分品种籽粒产量高达2 800 kg/hm2,一些品种含油量高达480 g/kg。千粒重与籽粒产量、含油量负相关。千粒重高达1.81 g的大粒种子亚麻荠品种产量和含油量均低于小粒种子品种,大粒基因型似乎限制了其他农艺性状和价值[25]。因此,不断提高籽粒产量和含油量是亚麻荠改良的主攻方向。高蛋白、低芥子甙、广适性和落粒性亦是重要育种选择指标[26]。欧洲一些国家亚麻荠育种项目,多年来通过常规育种手段以期培育大粒种子,未获实质性进展。从进化上讲,亚麻荠与同样具有小种子特性的拟南芥(Arabidopsis thaliana)亲缘关系最近,种质资源缺乏大粒基因型。美国农业部亚麻荠育种项目组已从全世界收集到数百份亚麻荠种质,进行农艺性状和遗传评估,通过传统育种方法已培育出一些籽粒产量和含油量均高、且综合农艺性状好的品系[27]。
我国一些单位也已开展了亚麻荠育种工作。例如,将国外引进的栽培亚麻荠与国内野生的长柄亚麻荠进行杂交(杂种幼胚培养-花药单倍体培养-染色体加倍-后代选育),中国农业大学和北京康福多生物技术发展有限公司合作培育成了一种适合于国内栽培的亚麻荠品种,称为荠蓝,其综合农艺性状良好,抗寒,耐干旱、贫瘠,病虫害较轻[28]。现已在我国山西、新疆等5个省进行了良种良法多年试验。荠蓝在陕西省试种,产量达2 025 kg/hm2,最高达 3 960 kg/hm2。近年来,中国农业大学亚麻荠研究组,通过引种、选择育种、诱变育种等技术,现已经选育出10余份适合春播的春性品系,20余份适合北方地区秋播种植的冬性品系。这些工作为我国亚麻荠新品种培育奠定了基础。
系统选择的一粒传方法在亚麻荠育种上应用较多,应用该方法可选出籽粒产量明显超过父本或母本的品系。Luczkiewicz等[29]利用γ射线辐照亚麻荠种子,经多代选育,获得每株种子数量及重量有广泛变异的后代材料。有研究者采用化学诱变剂甲磺酸乙酯(Ethyl methanesulfonate,EMS)对亚麻荠种子进行处理,以期诱变决定油脂脂肪酸组成的基因发生突变,研究获得了亚麻荠油中α-亚麻酸含量增加或降低的变异材料[30]。本课题组已建立了亚麻荠EMS诱变群体,现已获得一系列有关籽粒产量、开花期、落粒性、抗倒伏性、含油量和脂肪酸组成广泛变异体。可见,通过人工诱变能创新性状优异的亚麻荠种质,进一步可用于亚麻荠新品种培育。
此外,有关亚麻荠种质遗传多样和分子标记研究也有报道。RAPD和AFLP标记技术已分别用于检测41个亚麻荠种质[24]和53个不同地域的亚麻荠种质[9],通过遗传多样性分析,发现了一些具优异农艺特征的种质,可进一步用于品种改良。Gehringer等[31]应用两个农艺性状差异较大的品种Lindo 和Licalla 创建一个重组近交系作图群体,用AFLP和SSR标记构建了一个遗传图(总图距1 385.6 cM),接着定位了一些含油量、千粒重和株高等农艺性状的QTLs。最近,Singh 等[1]采用高通量RNA-seq和基因组消减文库及简化测序技术,检测4个农艺性状有明显差异的亚麻荠品种的SNP,并进一步用178 个不同品系群体作验证,构建了一张高密度的亚麻荠SNP 图谱。该图谱含有579 位点,分布于20条连锁群,平均SNP标记间距为3.4 cM,总图距 1 808.7 cM。据此,还建立了亚麻荠SNP芯片(768个SNP)检测方法。这些工作为建立亚麻荠重要农艺性状的分子标记和加快亚麻荠新品种选育奠定基础。
3 亚麻荠遗传转化技术的研究
为突破亚麻荠常规育种技术的限制和开展转基因改良亚麻荠农艺性状、培育良种,就需要建立亚麻荠植株再生体系和有效的遗传转化方法。黄友志[32]分别以冬性和春性亚麻荠品种无菌苗子叶为外植体,构建了亚麻荠组培及再生植株体系,并尝试用农杆菌介导法进行GUS基因转化,获得了抗性愈伤组织中GUS基因稳定表达的转化体。张永泰等[33]以亚麻荠无菌苗幼叶为试验材料,建立原生质体培养及植株再生体系,为开展原生质体融合(远缘体细胞杂交)及遗传转化提供条件。高立虎[34]用春性亚麻荠杂种无菌苗的子叶柄作为外植体,也成功创建了杂种亚麻荠的高效再生体系,将拟南芥细胞色素 P450 KLUH 基因(KLU),通过农杆菌介导的Floral dip 法转化亚麻荠,获得转基因植株,转化率为1.8%。Lu等[35]建立了应用农杆菌介导花序浸染法在花早期对亚麻荠植株进行遗传转化的有效方法。该转化方法与拟南芥Floral dip 法相似,操作简单,可用于大规模亚麻荠遗传转化,为通过基因工程对亚麻荠进行遗传改良奠定了技术基础。应用这种快速高通量转化方法,已对亚麻荠种子油脂代谢途径及油脂品质进行了卓有成效的遗传修饰。
本课题组应用Lu建立亚麻荠遗传转化方法,对参与油脂合成调控的一些转绿因子进行基因修饰[36,37],现已获得种子含油量明显提高、且其他农艺性状良好的亚麻荠基因工程株系。卵磷脂的分解在TAG合成中起重要作用,种子特异表达磷脂酶AIIIδ(pPLAIIIδ)以促进卵磷脂分解,结果导致亚麻荠种子油含量提高[4]。pPLAIIIδ超表达引起纤维素的降解,进而促使更多的碳源用于油脂合成,最终油脂积累增多。Malik 等[38]建立了在亚麻荠质体内表达外源基因的转化体系。质体特异表达催化合成羟基丁酸(Poly-3-hydroxybutyrate,PHB)酶,转基因亚麻荠T4种子中合成了高达13.7% PHB。这是迄今在种子中转基因合成积累PHB多聚物的最高水平。这种转基因亚麻荠种子含油量减低,但蛋白质含量不变,种子萌发受影响,进一步改造可应用转基因油料植物种子商业化生产PHB。Park等[6]克隆和分析了亚麻荠重金属ATP酶CsHMA3(heavy metal P1B-ATPase),超表达CsHMA3导致亚麻荠根部从土壤中吸收积累Pb 和 Zn,与对照相比,不但耐重金属胁迫,而且种子产量提高。此种基因改造的亚麻荠未来可用于清除土壤重金属污染。
4 代谢组装改良亚麻荠种子油脂品质
4.1 富集单不饱和油酸,提高亚麻荠油抗氧化性
植物油脂的抗氧化性高低取决于脂肪酸组成,多聚不饱和脂肪酸含量高,其抗氧化性就低。饱和脂肪酸含量高则减低了油脂的液体流动性,易凝固。单不饱和脂肪酸如油酸(18∶1Δ9)含量高的植物油脂既具有高抗氧化性,且其他性能也佳。亚麻荠油酸(18∶1Δ9)含量约17%,而亚油酸(18∶2Δ9,12)和亚麻酸(18∶1Δ9,12,15)含量约45%。
研究表明,在亚麻荠种子中,油酸合成后从质体转出进入细胞质,在内质网上经FAD2和FAD3两个脱氢酶依次催化,分别形成亚油酸和亚麻酸(图1)。油酸也可在脂肪酸延长酶FAE1的作用下生成二十碳烯酸(20∶1Δ11)。通过油脂代谢工程抑制FAD2、FAD3和FAE1酶的活性,就可阻断亚油酸、亚麻酸和二十碳烯酸合成,进而提高油酸含量。
Kang 等[39]从亚麻荠克隆到3个FAD2即CsFAD2-1、 CsFAD2-2和CsFAD2-3。 尽 管 这3个基因具有很高的序列相似性,但其表达模式不同。在发育种子、花、根、叶、茎等组织均检测到CsFAD2-1基因的表达。在发育种子中也检测到CsFAD2-2和 CsFAD2-3基因大量转录。表达及突变体分析基因已证明它们在油酸去饱和过程中的重要作用。Cahoon等[40]采用RNAi技术在亚麻荠种子中特异沉默FAD2、FAD3和FAE1,获得转基因亚麻荠成熟种子中合成积累了65%的油酸,比非转基因对照(18%)提高了3.5倍。此外,Lu等[35]用农杆菌介导花序浸染法在早花期对亚麻荠植株进行了遗传转化,把来自蓖麻的FAH12(fatty acid hydroxylase)基因导入植株,通过对T4代转基因植株种子的脂肪酸成分分析发现,亚麻荠种子中产生了高水平羟基脂肪酸,抗氧化性比非转基因的亚麻荠油明显提高。Rodríguez-Rodríguez等[41]克隆和分析了亚麻荠质体内FatA 和 FatB 硫酯化酶,证明FatA对油酰-ACP有选择性,而FatB对棕榈油酸-ACP有特异性。对这两个酶基因进行分子操作,可选择性地积累油酸或棕榈油酸。
4.2 富集长链多聚不饱和脂肪酸,增强亚麻荠油的营养保健功能
如前所述,ω-3长链(≥C20)多聚不饱和脂肪酸(long-chain polyunsaturated fatty acids LC-PUFAs)即 EPA(20∶5Δ5,8,11,14,17)和 DHA(22∶6Δ4,7,10,13,16,19),对人类健康和大脑发育极为重要,被誉为“血管清道夫”和“脑黄金”。普通食用动植物油脂不含或极少含EPA和DHA,供人类食用和营养需求的EPA和DHA主要来自高含EPA和DHA的鱼油。由于过度捕捞,优质鱼油资源日渐减少。因此,迫切需要建立可替代鱼油EPA和DHA的新的可再生资源[2,42]。对油料作物种子油脂合成途径进行代谢组装可望以普通油料作物种子为“加工厂”大量生产EPA和DHA[3,38]。亚麻荠种子高含能合成EPA和DHA的前体脂肪酸即α-亚麻酸(18∶3 ω-3,ALA)(>30%),这为在亚麻荠种子中组装EPA和DHA生物合成途径提供了丰富的起始底物。已有研究表明,由α-亚麻酸开始合成EPA需要2个脱氢酶(Δ6 Des 和Δ5 Des)和1个碳链延伸酶(Δ6Elo);由EPA合成DHA又需要1个脱氢酶(Δ4 Des)和1个碳链延伸酶(Δ5 Elo)催化(图2)。

图1 由油酸到亚麻酸和二十碳烯酸的酶促反应示意图
Ruiz-Lopez等[3]应用分别来源于Ostrococcus tauri,Thraustochytrium sp.,E. huxleyi,Phytophthorasojae和Phytophthora infestans的Δ6、Δ5、Δ4、Δ12和ω-3脱氢酶(OtΔ6、TcΔ5、EhΔ4、PsΔ12和Pi ω3),源于 P. patens和 O. tauri 的脂肪酸碳链延伸酶PSE1和OtEl05,构建这7个基因种子特异共表达载体,导入亚麻荠以在种子中组装DHA合成途径。构建种子特异共表达Δ6、Δ5、Piω3、PsΔ12和PSE1等5个基因载体,导入亚麻荠以在种子中组装EPA合成途径。EPA合成途径基因表达的亚麻荠种子积累高达31%的EPA(EPA平均含量为24%);DHA合成途径基因表达导致亚麻荠种子中DHA含量高达14%(平均为8%)[21]。这两种ω-3脂肪酸含量已达鱼油中的水平。这是目前在油料作物种子中基因工程组装EPA和DHA途径获得最高水平。重要的是转基因亚麻荠种子中没有其他有害脂肪酸中间代谢产物的积累(在其他油料作物种子中组装EPA和DHA合成途径,常相伴生成一些有害脂肪酸产物),而且转基因株系生长发育正常,无负效应。这种遗传修饰的新型亚麻荠种质为进一步研发富含ω-3脂肪酸(EPA和DHA)的系列医药、营养保健品提供了珍贵的可再生资源。
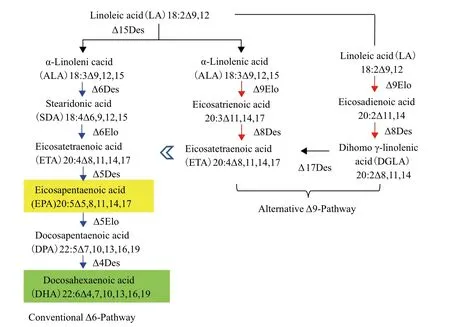
图2 由ALA开始合成EPA和DHA的酶促反应(Δ6和Δ9途径)示意图
此外,Ruiz-Lopez等[3]研究发现在一些微藻(如Pavlova salina 和 Isochrysis galbana)细胞内,还存在着另外一条不同于上述常规生物合成EPA的Δ6途径,即Δ9途径。该条途径起始底物也是α-亚麻酸(ALA),首先在Δ9碳链延伸酶(Δ9Elo)催化下,加上2个碳原子,生成二十碳三烯酸(20∶3Δ11,14,17;20∶3n-3)。然后,经Δ8脱氢酶催化生成二十碳四烯酸(20∶4Δ8,11,14,17;20∶4n-3,ETA)。最后,在Δ5脱氢酶作用下,ETA转化成EPA(二十碳五烯酸)(20∶5Δ5,8,11,14,17;20∶5n-3)。将该Δ9途径在亚麻荠种子中成功组装,转基因种子油积累了高达26.4%的长链ω-3脂肪酸(EPA和ETA)。需指出的是,由于Δ9Elo也能以亚油酸(18∶2Δ9.12)为底物,延伸生成二十碳二烯酸(20∶2Δ11,14;20∶2n-6)。而后,经Δ8脱氢酶催化生成二十碳三烯酸(20∶3Δ8,11,14;20∶3n-6,DGLA),再在Δ5脱氢酶作用下,DGLA转化成二十碳四烯酸(20∶4Δ5,8,11,14;20∶4n-6,ARA)。进一步需要精细修饰,以减少这些ω-6脂肪酸(DGLA和ARA)。
4.3 富集ω-7脂肪酸,改良亚麻荠生物柴油性能
ω-7脂肪酸包括棕榈油酸(16∶1Δ9)、11-十八碳烯酸(18∶1Δ11)和13-二十碳烯酸(20∶1Δ13),特别是棕榈油酸(16∶1Δ9)具有重要的工业、营养和医药价值。ω-7脂肪酸还是生产优质生物柴油的最佳脂肪酸。这些珍稀脂肪酸大多在一些野生植物的种子中合成,由于这些植物农艺性状差,迄今不能商业化生产。普通油料作物的种子极少积累ω-7脂肪酸。已有一些研究应用代谢工程技术在普通油料作物种子中组装 ω-7脂肪酸合成途径,以期实现富含ω-7脂肪酸的植物油商业化生产[43]。我们实验室以大豆为受体,将催化棕榈酸(16∶0)生成棕榈油酸(16∶1Δ9)的Δ9脱氢酶基因,以及能特异选择ω-7脂肪酸并积累于TAG(三酰甘油)的DGAT酶(催化二酰甘油生成三酰甘油)基因,导入大豆基因组,并使其在种子中特异表达。共表达这两个基因的种子油中ω-7脂肪酸含量大于29%[44]。用这样的大豆油可生产一系列富含ω-7脂肪酸的功能性食品等。此外,为培育燃油型烟草,我们实验室还在烟叶等营养器官组装ω-7脂肪酸生物合成途径,已获得富含ω-7脂肪酸含量的烟草新种质[45]。
亚麻荠等油料作物种子中脂肪酸从头合成发生在质体内,起始步骤是乙酰辅酶 A 羧化酶催化乙酰辅酶 A 形成丙二酰单酰辅酶 A,再经脂肪酸合成酶KASIII和KASI等酶催化,生成棕榈酸(16∶0),并结合于ACP蛋白,即16∶0-ACP(棕榈酰-ACP)。16∶0-ACP下游酶促反应有3条路径(图3):其一为16∶0-ACP在质体内经KASII作用碳链延伸生成18∶0-ACP(硬脂酰-ACP)。18∶0-ACP可直接从质体转出,以18∶0-CoA进入细胞质。18∶0-ACP也可以在质体内经ACP型Δ9脱氢酶(ACP-Δ9Des)催化生成18∶1Δ9-ACP(油酰-ACP),接着转出质体,以18∶1Δ9 -CoA进入细胞质。第二条路径为16∶0-ACP在脂肪酸硫脂酶FatB作用下,直接从质体转出,以16∶0-CoA进入细胞质。第三条路径是在质体内经对16∶0-ACP有底物特异性的ACP型Δ9脱氢酶作用,16∶0-ACP转化为16:1Δ9-ACP(棕榈油酰-ACP)(ω-7)。在质体内16∶1Δ9-ACP可进一步延伸为18∶1Δ11-ACP(11-十八碳烯酰-ACP)(ω-7)。16∶1Δ9-ACP和18∶1Δ11-ACP分别在脂肪酸硫脂酶FatA作用下,从质体转出,以16∶1Δ9-CoA和18∶1Δ11-CoA进入细胞质。
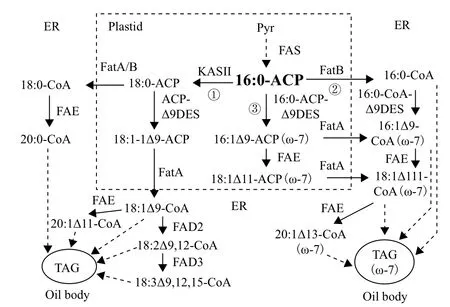
图3 质体内生成的16∶0-ACP下游3条酶促反应路径
Nguyen等[46]研究获得了能在质体内特异催化16∶0-ACP生成16∶1Δ9-ACP的ACP型Δ9脱氢酶和能在细胞质内质网上特异催化16∶0-CoA生成16∶1Δ9-CoA的CoA型Δ9脱氢酶。将这两个Δ9脱氢酶导入亚麻荠,种子特异共表达导致单不饱和ω-7脂肪酸从野生型的0.6% 增加到17%。在此基础上,他们通过RNAi技术沉默FatB以减少16∶0-ACP从质体转出量和沉默KASII以阻断16∶0-ACP 生成18∶0-ACP。这样就提高了质体内16∶0-ACP积累量,为16∶0-ACP特异性ACP型Δ9脱氢酶提供了足量底物。种子特异表达上述两个Δ9脱氢酶和同时沉默FatB和KASII使亚麻荠种子中ω-7脂肪酸积累量大幅提高,平均达60%,而且饱和脂肪酸含量从野生型的12%减少到5%。这种基因工程修饰的富含ω-7脂肪酸亚麻荠油更适于加工功能保健品。试验检测表明这种ω-7亚麻荠油的热力学特性显著改善,可用于生产优质生物柴油及聚亚胺酯工业品。
4.4 代谢组装培育亚麻荠优质生物润滑油和航空燃油
亚麻荠种子也可被用作“生物反应器”以期安全、可持续生产环境友好的生物润滑油和航空燃油,以替代石化基润滑油和航空燃油。长链(C20-C24)饱和脂肪酸和单不饱和脂肪酸的含量决定着植物油所制成润滑油耐热抗氧化性。亚麻荠种子油中20C及以上的脂肪酸含量约19%。沉默催化18∶1Δ9生成18∶2Δ9,12的 FAD2表达,可阻断由18∶1Δ9生成18∶2Δ9,12和18∶3Δ9,12,15的途径,使18∶1Δ9在脂肪酸延长酶FAE1作用下,更多地形成20C以上的单不饱和脂肪酸。Cahoon实验室将来自Lunaria alba的FAE1在种子种超表达,同时应用RNAi沉默FAD2,获得的转基因亚麻荠油20C以上单不饱和脂肪酸含量提高至30%。进一步在该转基因株系中,导入蜡酯合成酶基因和酰基辅酶A还原酶,使其种子特异表达,催化单不饱和脂肪酸生成蜡酯(wax ester)(20-22C),这种高含蜡酯(25%-30%)的亚麻荠油具有优异润滑特性。在这种多基因修饰的亚麻荠种质中,再导入超表达羟化酶(hydroxylase)基因,就可获得富含羟化蜡酯的种子油,其生物润滑油性能更优[47]。
亚麻荠等多数油料作物种子油含有较多的16-18C脂肪酸,直接用于加工航空燃油质量欠佳和工序繁长。然而,富含短、中链(8-14C)脂肪酸的植物油是生产油脂航空燃油的优质资源。Collins-Silva等[48]报道,以亚麻荠为转基因受体,在种子中特异表达来自Cuphea 的Thio14 FatB 硫脂酶基因,获得了肉豆蔻酸(14∶0)含量高达25%的转基因亚麻荠株系。种子特异共表达来自California bay(富含月桂酸)的FatB硫脂酶基因和来自椰子的溶血磷脂酸酰基转移酶(lysophosphatidic acid acyltransferase,LPAT)基因,导致亚麻荠种子积累高达30% 的月桂酸(12∶0)。这两种富含肉豆蔻酸和月桂酸的亚麻荠油均可直接用于生产高抗低温的航空燃油。
5 展望
生物能源的研发利用在应对全球能源危机和环境污染,以及实施经济可持续绿色发展中具有独特优势。生物质能是一种绿色可再生能源,其原料具有良好的稳定性和储能性,能源产品具有多样性,能量生产过程具有环保和资源循环利用等功能,因而被认为是替代化石能源最具有前景的新能源。因近10多年来全世界对生物燃油能源研发的强力推进,种植历史悠久的油料亚麻荠,被重新发掘出来作为一种清洁可替代的再生能源的油料作物,被认为是发展潜力巨大的新兴燃油作物,在欧美许多国家开始了新一轮商业化种植及研发高潮。在世界范围内,不少机构相继对亚麻荠的育种、栽培、营养特性和在生物能源中的应用等多方面展开了研究,取得了较为重要的进展。基于亚麻荠的食品、营养保健品、化妆品、饲料添加剂、高值化工品等产品不断研制成功,并日渐进入商业化。尤其是美国Sustainable Oils等几家燃油公司在利用亚麻荠种子油研制优质生物燃油和航空油等方面获得一些实质进展,部分燃油产品规模化生产和利用已显端倪。
种子油脂含量和脂肪酸成分是决定亚麻荠食用营养品、医药保健品,以及燃油等能源产品研制的关键因素。在采用常规育种手段培育高油品种的同时,应用代谢工程等生物技术培育富含目标脂肪酸或具有高附加值新型油脂等新种质方面也已取得重要成果,为亚麻荠油脂的大规模高值开发利用奠定了物质基础。亚麻荠全基因组序列高质量图谱也已公布[49]。以此为基础,未来将开展亚麻荠功能基因组学等组学研究[46,50],以及基于组学的分子设计育种[1]。我们实验室已部分完成种子脂类代谢组及调控网路等相关研究,鉴定和筛选到若干种子油脂代谢调控基因和遗传修饰的候选靶基因。应用代谢工程技术不仅能成功地在亚麻荠种子中组装目标脂肪酸合成途径,以实现珍稀脂肪酸规模化生产,还有助于从基因水平上全面解析油料植物种子油脂代谢及调控的分子机制。
与欧美等国家相比,我国亚麻荠研发还处于起步阶段。在不断引进、试种国外品种的同时,持续培育亚麻荠优良品种和建立高效低耗的、利用我国广大非农边际性土地规模化种植技术体系仍然是未来一个主攻领域。进一步应组建全国亚麻荠研发联盟,合作攻关,加快亚麻荠能源产品,以及亚麻荠食品、饲料、医药、化工等综合利用的深度研发,解决亚麻荠精细加工的关键工艺等科学和技术问题。可以预见,一个新兴的环境友好、低耗高效、可持续的亚麻荠产业将在我国建立并快速发展。
[1] Singh R, Bollina V, Higgins EE, et al. Single-nucleotide polymorphism identification and genotyping in Camelina sativa[J]. Molecular Breeding, 2015, 35:35.
[2] Betancor MB, Sprague M, Usher S, et al. A nutritionally-enhanced oil from transgenic Camelina sativa effectively replaces fish oil as asource of eicosapentaenoic acid for fish[J]. Scitific Reports, 2015,5:8104.
[3] Ruiz-Lopez N, Haslam RP, Usher S, et al. An alternative pathway for the effective production of the omega-3 long-chain polyunsaturates EPA and ETA in transgenic oilseeds[J]. Plant Biotechnology Journal, 2015, 3. DOI:10. 1111/pbi. 12328.
[4] Li M, Wei F, Tawfall A, et al. Overexpression of patatin-related phospholipase AIIIδ altered plant growth and increased seed oil content in camelina[J]. Plant Biotechnology Journal, 2014. DOI:10. 1111/pbi. 12304.
[5] Petrie JR, Shrestha P, Belide S, et al. Metabolic engineering Camelina sativa with fish oil-like levels of DHA[J]. PLoS One,2014, 9(1):e85061.
[6] Park W, Feng Y, Ahn SJ. Alteration of leaf shape, improved metal tolerance, and productivity of seed by overexpression of CsHMA3 in Camelina sativa[J]. Biotechnology for Biofuels, 2014, 7:96.
[7] Haslam RP. The modification of plant oil composition via metabolic engineering-better nutrition by design[J]. Plant Biotechnology Journal, 2013, 11:157-168.
[8] Eynck C, Falk KC. Camelina(Camelina sativa)//Singh BP(ed)Biofuel Crops:Production, Physiology and Genetics[M]. Center for Agricuture and Bioscience International, 2013:369-391.
[9] Ghamkhar K, Croser J, Aryamanesh N, et al. Camelina(Camelina sativa(L. )Crantz)as an alternative oilseed:molecular and ecogeographic analyses[J]. Genome, 2010, 53(7):558-567.
[10] Séguin-Swartz G, Eynck C, Gugel R, et al. Diseases of Camelina sativa(false flax)[J]. Canadian Journal of Plant Pathology,2009, 31:375-386.
[11] Manca A, Pecchia P, Mapelli S, et al. Evaluation of genetic diversity in a Camelina sativa(L.)Crantz collection using microsatellite markers and biochemical traits[J]. Ggenetic Resources and Crop Evolution, 2013, 60(4):1223-1236.
[12] 刘广瑞, 颜蓓蓓, 陈冠益. 航空生物燃料制备技术综述及展望[J]. 生物质化学工程, 2012, 46(3):45-48.
[13] 钱伯章. Great Plains公司采用亚麻荠生产航空生物燃料[J].炼油技术与工程, 2010, 3:37.
[14] 邓乾春, 黄凤洪, 黄庆德, 等. 一种高利用价值油料作物-亚麻荠的研究进展[J]. 中国油料作物学报, 2009, 31(4):551-559.
[15] Zubr J, Matthaus B. Effects of growth conditions on fatty acids and to copherols in Camelina sativa oil[J]. Industrial Crops and Products, 2002, 15:155-162.
[16] Karvonen HM, Tapola NS, Uusitupa MI, et al. The effect of vegetable oil-based cheese on serum total and lipoprotein lipids[J]. European Journal of Clinical Nutrition, 2002, 56(11):1094-1101.
[17] 邓曙东, 张青文. 亚麻荠种植和利用的研究现状[J]. 植物学通报, 2004, 21(3):376-382.
[18] Matthaus B, Zubr J. Variability of specific components in Camelina sativa oilseed cakes[J]. Industrial Crop sand Products, 2000, 12(1):9-18.
[19] Markéta S. Fatty acid composition of Camelina sativa as affected by combined nitrogen and sulphur fertilization[J]. African Journal of Agricultural Research, 2011, 6(16):3919-3923.
[20] Shukla VKS, Dutta PC, Artz WE. Camelina oil and its unusual cholesterol content[J]. Journal of the American Oil Chemists’Society, 2002, 79(10):965-969.
[21] Ruiz-Lopez N, Haslam RP, Napier JA, et al. Successful high-level accumulation of fish oil omega-3 long-chain polyunsaturated fatty acids in a transgenic oilseed crop[J]. The Plant Journal, 2014,77(2):198-208.
[22] Tong W, Kevin BH, Robert M. Antioxidant activity of phytosterols,oryzanol and other phytosterol conjugates[J]. Journal of the American Oil Chemists’ Society, 2002, 79(12):1201-1206.
[23] Velasco L, Fernandez-Martinez JM. Breeding oilseed crops for improved oil quality[J]. Journal of Crop Production, 2002, 5:309-344.
[24] Vollmann J, Grausgruber H, Stift G, et al. Genetic diversity in camelina germplasm as revealed by seed quality characteristics and RAPD polymorphism[J]. Plant Breeding, 2005, 124(5):446-453.
[25] Vollmann J, Moritz T, Kargl C, et al. Agronomic evaluation of camelina genotypes selected for seed quality characteristics[J]. Industrial Crops and Products, 2007, 26(3):270-277.
[26] Gugel RK, Falk KC. Agronomic and seed quality evaluation of Camelina sativa in western Canada[J]. Canadian Journal of Plant Science, 2006, 86(4):1047-1058.
[27] Janick J, Paris HS, Parrish DC. The cucurbits of mediterranean antiquity:identification of taxa from ancient images and descriptions[J]. Annals of Botany, 2007, 100(7):1441-1457.
[28] 杜润鸿. 油料家园的一枝奇葩——荠蓝[J]. 粮油加工与食品机械, 2005, 4:23-24.
[29] Luczkiewicz T, Szewczyk D. Variability of some plant traits of Camelina sativa L. in g1-3 generation[J]. Rosliny Oleiste, 1997,18(1):83-90.
[30] Buchsenschutz NA, Schuster A, Friedt W. Breeding for modified fatty acid composition via experimental mutagenesis in Camelina sativa(L. )Crtz. [J]. Industrial Crops and Products, 1998, 7:291-295.
[31] Gehringer A, Friedt W, Luhs W, et al. Genetic mapping of agronomic traits in false flax(Camelina sativa subsp. sativa)[J]. Genome,2006, 49(12):1555-1563.
[32] 黄友志. 油料新作物亚麻荠的初步研究[D]. 北京:中国农业大学, 2002.
[33] 张永泰, 毛善婧, 李爱民, 等. 亚麻荠原生质体培养再生植株的研究[J]. 扬州大学学报:农业与生命科学版, 2006, 27(4):78-80.
[34] 高立虎. 亚麻荠高效再生体系创建及KLU转化亚麻荠研究[D]. 石河子:石河子大学, 2013.
[35] Lu C, Kang J. Generation of transgenic plants of a potential oilseed crop Camelina sativa by Agrobacterium-mediated transformation[J]. Plant Cell, 2008, 27:273-278.
[36] 岳爱琴, 孙希平, 李润植. 食用植物油脂的代谢工程[J]. 植物生理与分子生物学学报, 2007, 33(6):489-498.
[37] 吴永美, 毛雪, 王书建, 等. 植物ω-7脂肪酸的系统代谢工程[J]. 植物学报, 2011, 46(5):575-585.
[38] Malik MR, Yang W, Patterson N, et al. Production of high levels of poly-3-hydroxybutyrate in plastids of Camelina sativa seeds[J]. Plant Biotechnology Journal, 2014, DOI:10. 1111/pbi. 12290.
[39] Kang J, Snapp AR, Lu C. Identification of three genes encoding microsomal oleate desaturases(FAD2)from the oilseed crop Camelina sativa[J]. Plant Physiology and Biochemistry, 2011,49(2):223-229.
[40] Cahoon EB, Shockey JM, Dietrich CR, et al. Engineering oilseeds for sustainable production of industrial and nutritional feedstocks:solving bottlenecks in fakty acid flux[J]. Current Opinion in Plant Biology, 2007, 10(3):236-244.
[41] Rodriguez-Rodriguez MF, Salas JJ, Garces R, et al. Acyl-ACP thioesterases from Camelina sativa:cloning, enzymatic characterization and implication in seed oil fatty acid composition[J]. Phytochemistry, 2014, 107:7-15.
[42] Xue ZX, Sharpe PL, Hong SP, et al. Production of omega-3 eicosapentaenoic acid by metabolic engineering of Yarrowia lipolytica[J]. Nature Biotechnology, 2013, 31;734-740.
[43] Wu Y, Li R, Hildebrand DF. Biosynthesis and metabolic engineering of palmitoleate production, an important contributor to human health and sustainable industry[J]. Progress in Lipid Research, 2012, 51(4):340-349.
[44] Xue JA, Mao X, Yang ZR, et al. Expression of yeast acyl-CoA-9 desaturase leads to accumulation of unusual monounsaturated fatty acids in soybean seeds[J]. Biotechnology Letters, 2013, 35(6):951-959.
[45] 薛金爱, 毛雪, 吴永美, 等. 酿酒酵母脂酰-△9脱氢酶亚细胞定位表达及其对烟草脂肪酸合成的影响[J]. 生物工程学报,2013, 29(5):630-645.
[46] Nguyen HT, Silva JE, Podicheti R, et al. Camelina seed transcriptome:a tool for meal and oil improvement and translational research[J]. Plant Biotechnology Journal, 2013, 11(6):759-769.
[47] Lu C, Napier JA, Clemente TE, et al. New frontiers in oilseed biotechnology:meeting the growing global demand for vegetable oils for food, feed, biofuel, and industrial uses[J]. Current Opinion in Biotechnology, 2011, 22:252-259.
[48] Collins-Silva JC, Cahoon EB. Camelina:A designer biotech oilseed crop[J]. Inform, 2011, 22:610-613.
[49] Kagale S, Koh C, Nixon J, et al. The emerging biofuel crop Camelina sativa retains a highly undifferentiated hexaploid genome structure[J]. Nature Communications, 2014, 23(5):3706.
[50] Hutcheon C, Ditt RF, Beilstein M, et al. Polyploid genome of Camelina sativa revealed by isolation of fatty acid synthesis genes[J]. BMC Plant Biology, 2010, 10:233.
(责任编辑 狄艳红)
Metabolic Engineering of Seed Oil in Camelina sativa L. Crantz,a New Type of Industrial Oilseed Crop
Yuan Lixia1,2Mao Xue1Yang Zhirong1Xue Jin’ai1Li Runzhi1
(1. Institute of Molecular Agriculture and Bioenergy,Shanxi Agricultural University,Taigu 030801;2. College of Biological Science and Technology,Jinzhong University,Jinzhong 030600)
Camelina sativa L. Crantz is a new and potential industrial oilseed crop with low input and environment-friendly. The seed yields 43%(W/W)oil with α-linolenic acid content over 35%. The seed oil can be used for edible oil and animal feed, health-promoting food,biofuel oil and high-valued oil chemicals. In this study we characterize the important agronomic traits and the excellent oil properties of camelina. Particularly, we describe the genetic improvements of the seed oil quality by gene engineering, which include pathway assembly of long chain polyunsaturated fatty acids, ω-7 fatty acids, wax esters, medium- and short-chain fatty acids, and enrichment of single fatty acid. We also dissect and discuss trends in camelina functional genomics and the prospects for development of camelina commercialization as a new bioenergy oilseed in China.
Camelina sativa L. Crantz;oil;fatty acid;biofuel oil;metabolic engineering
10.13560/j.cnki.biotech.bull.1985.2015.06.006
2015-02-15
国家自然科学基金项目(30971806,31201266,31401430),国家“948”项目(2014-Z39),山西省煤基重点科技攻关项目(FT-2014-01)
苑丽霞,女,博士研究生,研究方向:分子遗传与基因工程;E-mail:lixiayuan1999@126.com
李润植,男,教授,博士生导师,研究方向:分子遗传与基因工程;E-mail:rli2001@hotmail.com

