微量热泳动技术原理及其在研究生物分子互作方面的应用
艾秋实曹向宇赵芊牛亚利,4宋水山
(1. 河北省科学院生物研究所,石家庄 050081;2. 河北农业大学生命科学学院,保定 071001;3.河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081;4.河北工业大学化工学院,天津 300130)
微量热泳动技术原理及其在研究生物分子互作方面的应用
艾秋实1,2,3曹向宇1,3赵芊1,3牛亚利1,3,4宋水山1,3
(1. 河北省科学院生物研究所,石家庄 050081;2. 河北农业大学生命科学学院,保定 071001;3.河北省主要农作物病害微生物控制工程技术研究中心,石家庄 050081;4.河北工业大学化工学院,天津 300130)
微量热泳动(MST)技术是近年来兴起的一项用于研究生物分子间互作的新技术。其检测是基于热泳动现象,即分子在温度梯度中的定向运动及由此引起分子性质的变化,如分子大小、电荷和水化层及构象等。该方法把精确的荧光检测与灵敏的热泳动相结合,从而提供了一个灵敏的、快速的精确分析生物分子间互作的检测方法。就MST的工作原理和检测过程及其在生物学研究中的应用作以综述。
微量热泳动;互作分析;结合性研究;生物分子间互作
研究生物分子的相互作用,对于探明生物体信号转导通路及调控机制、生理生化代谢途径具有重要意义。在生命科学研究中,人们经常利用荧光分子追踪和分析分子间的相互作用。这是因为荧光相关技术在研究生物学过程中起到了极其重要的作用[1]。多种显微技术可对细胞内的荧光分子进行观察,而且在体外实验中也可应用荧光分子。无论是检测结合常数和酶活,还是研究蛋白质折叠的热力学机制都能使用荧光分子相关技术对生物分子运动过程的生物物理学参数进行测定。在过去几十年中,荧光技术作为一种体外检测方法帮助人们认识了生物分子诸多方面的功能。这是由于荧光技术具有应用广泛、特异性好、灵敏度高的优点[2]。
利用荧光技术分析生物分子间互作,主要依靠检测系统的性能、荧光猝灭机理、荧光光谱[3]、异向性或福斯特(Foerster)共振能量转移来分析某个反应的平衡常数。然而,这些技术还存在一定的局限性,如需要依赖分子的大小,结合时分子大小的变化和荧光团相互作用时相对位置等参数[4]。另外,这些技术具有样品用量大,实验步骤繁琐,数据分析不精确等缺点。
基于荧光检测技术的优势,微量热泳动(microscale thermophoresis,MST)技术将荧光检测与热泳动现象相结合,提供了一个高效、精确、灵敏的检测方法。MST检测通常需要用荧光标记蛋白,配体则不需要标记。在温度梯度中,荧光标记蛋白与配体发生热泳动,导致反应体系中荧光分布发生变化。MST就是通过检测温度梯度场中,分子热泳动引起的荧光分布变化来分析分子间相互作用。
1 MST基本介绍
1.1 基本原理
热泳动现象由 Ludwig首次阐释,指在温度梯度下分子的定向运动[5]。2010年,Wienken 等[6]首次报道了利用MST技术研究蛋白质及小分子在生物溶液中的相互作用,此项技术的兴起是研究生物分子间互作领域的一场革命。MST检测设备由Nano Temper公司发明,其工作原理是生物分子在毛细管中发生热泳动现象,导致发生相互作用的生物分子的水化层、分子大小、电荷等分子性质发生改变,进而引起反应体系中荧光分布的变化,以检测相互作用的生物分子间的亲和性。
MST生物物理学背景已经有了广泛的报道[7-10]。反应体系中的温度变化(ΔT)可导致温度升高区域中粒子数量减少。通过索雷特(Soret)系数对热泳动进行定量分析 ST:Chot/Ccold=exp(-STΔT)。热泳动的减弱是由于分子与溶剂交界面相互作用导致的。在缓冲液不变的情况下,热泳动可分析分子的大小、电荷和溶剂熵值。如蛋白质与蛋白质-配体复合物的热泳动是有显著差异的,复合物形成后会引起分子大小、电荷和溶剂能量的改变。即使结合后不能显著改变蛋白大小、电荷,MST仍可通过检测溶剂熵值的变化来检测结合是否发生[10]。MST除了能精确检测生物分子间相互作用,计算解离常数(Kds),还能得到有关生物分子互作的其他参数。
1.2 性能优势
长期以来,测定生物分子间的结合情况一般使用生物化学的方法。因其能直接呈现检测结果,而且操作简单、成本低。常用的生物化学方法包括,用于检测蛋白与核酸相互作用的凝胶迁移实验(electrophoretic mobility shift assay,EMSA),以及基于抗体的检测技术,如酶联免疫(enzyme linked immunosorbent assay,ELISA)[11,12]。尽管这些检测方法应用广泛,但很难对结合情况进行精确分析[13]。
生物物理学的方法可对生物分子的结合情况进行定量研究。然而目前应用较多的一些检测方法也存在着局限性。如等温滴定量热法(isothermal titration calorimetry,ITC)虽然无需标记和固定样品,但其灵敏度较低,且需要较多的待测样品产生明显的热信号用于检测,这就加大了样品制备的难度[14]。动态光散射法(dynamic light scattering,DLS)也是免标记、免固定样品的方法,但其检测依靠未结合组分与结合复合体之间水动力半径(rH)的明显差异,这限制了检测的范围[15]。荧光偏振技术(flourscence polarization,FP)尽管无需固定样品,但其适用性和灵敏性受荧光染料的寿命、荧光标记配体的大小以及配体结合后分子质量变化的影响。该方法使用的荧光染料为荧光素,其寿命短,分子量普遍大于0.3 kD,这会影响配体的结合运动[16,17]。表面等离子体共振(surface plasmon resonance,SPR)法灵敏度高,可实时获取检测数据。但其需要将样品固定,这会影响结合分子的动力学特性进而影响结合反应发生[18]。而MST技术则避免了上述实验技术的不足。
MST能对微升(μL)级的溶液进行检测,这不完全取决于待测分子的大小变化和物理特性[6,9,19]。MST的检测主要基于生物分子水化层的改变,所以比其他的荧光技术应用范围广[7,8]。因此,MST不会像FP技术那样,需要改变待测分子的大小和质量,同时避免了DLS受制于结合组分的分子质量比。另外,MST不用固定样品,且样品用量极少,这是ITC、SPR等非荧光检测法所不具备的优势。而且细胞质、细胞裂解液等复杂生物溶液可作为MST检测的反应体系[6,10]。
根据检测器不同MST检测设备分为Monolith NT.115/Monolith.NT115Pico和 Monolith NT.LabelFree。使用Monolith NT.115/Monolith.NT115Pico型号检测时需要对其中一个待测分子进行荧光标记。Monolith NT.LabelFree的出现为研究生物分子互作提供了一个完全免标记的检测方法[20],这是因为它能检测到蛋白质自身所含芳香类氨基酸发出的内源荧光。另外Monolith NT.Automated结合了上述两种类型检测器的特性,所以具备高通量筛选的能力。
综上所述,MST与其他方法相比具有以下几方面优点:(1)可在多种生物溶液中进行检测;(2)实时获取检测数据;(3)灵敏度极高;(4)样品处理简单;(5)检测时间短;(6)待测样品用量极少。
1.3 解离常数的计算
Kds是通过MST测得的重要参数。Kds是反应分子间亲和力的重要指标。它被定义为:
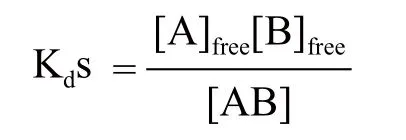
Kds:解离常数;[A]free:游离态A组分浓度;[B]free:游离态B组分浓度;[AB]:A与B结合后形成的复合体浓度。
但两个结合组分的游离态浓度无法测得。所以,以它们的总浓度替代。它们的总浓度分别被定义为:[A]=[A]free+[AB]和[B]=[B]free+[AB]
因此Kds被定义为:
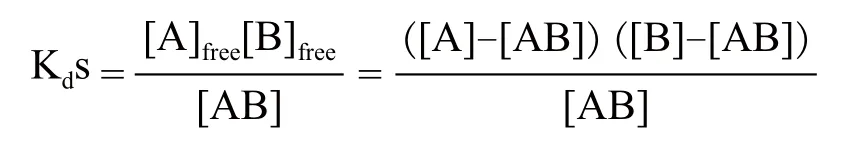
下面将A定义为滴定组分,即配体。B定义为与A结合的另一组分,即受体。其浓度保持不变,荧光值可被仪器读出。由此解出B的结合率(FB)即可求得Kds。FB为:
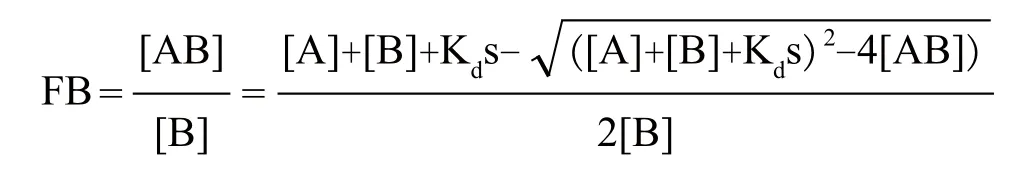
MST设备给出的Fnorm是关于FB的线性函数,因此由上述等式可得出Fnorm[21]。
2 MST检测过程
除了使用Monolith NT.LabelFree外,MST检测要对其中一个互作分子进行荧光标记且浓度不变,而非荧光标记的分子进行倍比稀释,根据仪器的规格最多可做15个浓度梯度。因此MST检测主要涉及荧光标签选择,结合配体的倍比稀释和毛细管3方面的问题。MST的检测过程,如图1所示。
2.1 荧光标签
除Monolith NT.LabelFree型外,MST的激发光波长处于可见光范围内,所以要对待测分子进行荧光标记才能检测其热泳动现象,如荧光标签、融合荧光蛋白。生物分子存在结合标签位点,它的结合并不影响热泳动的产生。此外,随机结合的标签有利于MST的检测。因为在结合过程中能降低单个标签的局部效应。荧光物质与目的分子偶联需要特定的pH值,大部分蛋白质都可适应这一条件。除了蛋白质,其他生物分子也可利用荧光标签进行相互作用的研究。
荧光标记法要针对目标蛋白选择特定的荧光标签。在体外表达系统中,可将嘌呤毒素荧光团与C端结合[23],也可与携带荧光染料的非天然氨基酸结合[24],或是结合后对其进行特殊修饰[25]。另外,细胞裂解液中可直接使用重组蛋白,如绿色荧光蛋白(green fluorescent protein,GFP),或是针对特定染料的结合位点选用肽段序列标签。
荧光标签提供了一种高灵敏的检测方法,可用于纳摩(nmol)水平的检测。该方法能检测复杂液体环境中带有不同标签的混合分子。然而荧光标签可能会影响分子间的结合,像G蛋白偶联受体等膜蛋白对于修饰比较敏感。所以在选择荧光标签时,要考虑被标记生物分子的性质,核酸、蛋白质的结构与性质不同,它们需要的荧光标签也不同。通过使用Monolith NT.LabelFree型仪器可解决此问题,该仪器在紫外条件下检测蛋白质自身含有的芳香类氨基酸发射的荧光,如酪氨酸、苯丙氨酸和色氨酸。
选择荧光源时,要考虑MST检测时所用缓冲液的性质,使得缓冲液的背景荧光值在荧光团特定波长下产生尽可能小的信噪比。因此,在细胞裂解物或血清等复杂生物溶液中必须采用荧光标签,因为生物溶液含有较高浓度的蛋白质会产生较高的紫外荧光值。

图1 MST检测过程[22]
2.2 倍比稀释
一般初始荧光强度是恒定的,除非荧光团接近结合位点或出现表面吸附和聚集情况。为验证这些情况是否对检测产生影响,应用去垢剂或小牛血清蛋白(BSA)等作为阴性对照。因为蛋白质紫外范围内背景荧光值是不容忽视的,所以免标记的MST检测应设置阴性对照,以扣除本底信号的干扰。通过倍比稀释的方法,将不同浓度的非荧光标记反应物与固定浓度的荧光标记反应物混合。前者的最低浓度为游离状态下仪器能检测到其热泳动的发生,最高浓度要高于预期的Kds,以及与荧光标记反应物完全结合时所需的浓度。通常认为最高浓度是Kds的20倍左右。
2.3 毛细管
将待测样品通过毛细管现象吸到不同的毛细管中。4 μL样品就能满足测试的需要。MST实验所用毛细管的内径差距不会大于1 μm,以确保每根毛细管中产生一致的温度梯度,因此毛细管内表面对实验检测结果至关重要。毛细管外层的厚度也影响着温度梯度及总体温度的增加,它的热传导性决定了远离红外线(IR-laser)照射区域的热传导效率。标准MST毛细管(nanotemper technologies)的内表面是高度均匀的,其背景信号很低。对于非特异吸附在毛细管表面的反应物,MST设备能轻易的检测到,或利用BSA作为阴性对照以避免非特异吸附对实验结果的影响。例如,对小分子物质检测时,可利用BSA作为对照实验以排除小分子的非特异结合。毛细管内表面也可进行亲水或疏水处理。
3 MST在生物分子互作研究中的应用
近些年,MST已经成功的应用在研究生物分子间互作领域,主要包括寡聚核苷酸间的互作、蛋白质与DNA的互作、蛋白质与蛋白质的互作、蛋白质与小分子间的互作,以及蛋白质与脂质体的互作。
3.1 寡核苷酸相互作用的研究
适配体(aptamer)是体外筛选的能与特定目标分子结合的核苷酸序列,它与适配体-目标结合物产生的热泳动现象具有显著差异。Baaske等[26]利用Cy5染料标记核苷酸序列,定量分析凝血酶适配体与凝血酶的结合情况。他们发现在不同缓冲液中,适配体与目标物的亲和性存在差异,在10%和50%血清中测得的结合常数与其他缓冲液中测得的不同,由此表明MST可对血清这样复杂的生物溶液进行检测,其检测的灵敏度和特异性不受血清中其他组分的影响。他们还分析了ATP适配体在不同缓冲液中与AMP和ATP的结合情况。
分子稳定性和构象是生物分子重要的测量参数。Wienken等[27]通过测定核酸的热泳动,精确检测核酸的熔化相变和分解时构象变化。利用MST分析了单核苷酸的多态性、DNA修饰、DNA发卡结构和双链小RNA的构象。他们把MST测得的结果与紫外吸收光谱法测得的结果进行比较发现,利用两种方法测得的结果一致,证实了MST在核酸分析方面的可靠性。
3.2 蛋白质与核酸相互作用的研究
病毒非结构蛋白NSP5是构成病毒质的主要成分。Martin等[28]证实铁硫簇在NSP5与ssRNA结合过程中发挥作用。用Cy-3标记ssRNA与野生型NSP5或缺少铁硫簇的NSP5 C171A C174反应,以测得Kds。MST结果显示,野生型NSP5有两个结合位点可以结合ssRNA,且两个结合位点的亲和性不同。而NSP5 C171A C174只具有亲和性较高的结合位点。
转录因子PU.1在造血系统发挥重要作用,在分化过程中PU.1的结合形式会发生明显的改变。转录因子能够识别并结合到基因组特定DNA序列。Pham等[29]通过体内外结合实验和生物信息技术研究表明,PU.1选择它的结合位点主要依靠与目的序列的亲和性。他们利用MST技术检测了75个Cy-3标记的DNA模体序列与体外表达PU.1的Kds发现,每个模体log-odds scores与Kds成反比,认为logodds scores能够反应模体序列的亲和力。
3.3 蛋白质与蛋白质相互作用的研究
泛素化信号被一整套泛素受体识别,Keren-Kaplan等[30]发现了一个可能与泛素结合的结构域ALIX-V。首先通过pull-down实验证实ALIX-V与泛素具有较强的亲和性,但SPR测得的Kds约为2 200 μmol/L,不能印证pull-down实验的结论。利用MST技术测得Kds约为119 μmol/L,这一结果与多数泛素结合结构域特征相符。他们推测SPR与MST结果出现分歧的原因可能是泛素引起ALIX-V发生齐聚反应,SPR实验需要把ALIX-V固定,而MST实验并不需要将其固定。他们又通过MST实验进一步验证了其推测。
线粒体热休克蛋白Hsp70的分子伴侣 Ssq1在铁硫蛋白成熟过程中起着至关重要的作用。Ssq1与支架蛋白Isu1结合,以促进新合成的铁硫簇从Isu1上解离,同时Ssq1转移到目标载脂蛋白上。Uzarska等[31]证实Ssq1也可与硫醇谷氧还蛋白5(Grx5)结合,但是结合位点与Isu1不同。在MST实验中使用Kit Red标记Grx5与Ssq1进行反应,计算出Grx5的亲和常数。
3.4 蛋白质与小分子互作的研究
小分子物质可竞争单结构域酶的活化位点,抑制其蛋白功能,还可干扰两个含单结构域酶的相互作用。tRNA-鸟嘌呤转糖基酶(TGT)只有形成二聚体才能发挥作用,因此通过小分子物质抑制TGT形成二聚体是治疗志贺杆菌病的新思路。为阻止TGT形成二聚体,Immekus等[32]根据TGT的结构特点设计了不同类型的配体。利用MST技术检测Alexa Fluor 647标记的TGT与不同配体间的Kds。并通过[8-3H]鸟嘌呤动力学实验验证了所测得Kds。
G-蛋白介导的Rho鸟苷酸交换因子(GEF)-Rho GTPase信号轴参与人类的病理过程,它也是一个潜在的治疗位点。Shang等[33]对能够嵌入LARG(参与RhoA激活并受G蛋白调节的Rho GEF)的DH-PH结构域的化学物进行了筛选,并通过生化实验发现以Y16为代表的一类化学抑制剂能够特异的阻止LARG与RhoA结合。通过MST技术检测Y16与Alexa Fluor 647标记的LARG作用时的 Kds,表明Y16能与LARG特异性结合。他们还用LARG不同位点的突变体与Y16反应,进一步明确了Y16与LARG的结合位点。
N-酰基高丝氨酸内酯(AHLs)是革兰氏阴性细菌分泌的一类群体感应信号,并能影响植物体内多条信号通路[34]。因此寻找植物体内AHLs受体对进一步研究植物如何感应AHLs至关重要。本实验室利用MST技术验证拟南芥体内可能的AHLs受体G蛋白偶联受体2(GCR2)是否作为某种AHLs的受体,即用Kit Red标记GCR2并与不同的AHLs分子进行结合实验(未发表)。
3.5 蛋白质与脂质体互作的研究
突触囊泡蛋白Synaptotagmin-1是神经元胞吐作用中重要的Ca2+感受器,它同时与Ca2+和带阴离子的磷脂酰肌醇4,5-二磷酸(PIP2)结合。但三者间的协同作用还并不十分清楚。Van Den Bogaart等[35]利用MST技术分析了PIP2和Ca2+与Synaptotagmin-1的结合情况。用Alexa Fluor 488标记Synaptotagmin-1及其突变体发现,PIP2与C2B结构域保守区域结合。当有较高浓度的PIP2存在时可以显著提高Ca2+与C2AB的亲和性。由此证明,在神经递质释放过程中,Ca2+、synaptotagmin-1和PIP2之间的相互作用十分紧密。
4 结语
研究生物分子间互作,对于明确生物信号转导机制,生物分子的结构与功能等方面尤为重要。但如何证明两个生物分子结合一直是生物学研究领域的重点和难点,一般需要用多个实验共同验证实验结果的真实性、可靠性。MST技术的出现为研究生物分子间互作提供了一个新的方法。目前,MST与pull-down、液闪实验等技术相结合,丰富了研究生物分子间互作的检测方法,提高了检测效率。除了上述提到的优势外,MST还具有仪器维护及运行费用较低,仪器体积小等优点。但目前,MST的应用还有一定的局限性,其一、仪器价格昂贵;其二、不能直接确定结合的具体位点,只能通过使用该生物分子的突变体等方法加以确定。MST技术通过进一步的发展,一定会在细胞信号转导、小分子配体筛选、分子靶向治疗、医药研发等研究领域中发挥越来越大的作用。
[1] Ha T, Tinnefeld P. Photophysics of fluorescent probes for singlemolecule biophysics and super-resolution imaging[J]. Annu Rev Phys Chem, 2012, 63:595-617.
[2] Geddes CD, Lakowicz JR. Reviews in fluorescence[M]. Springer,2011, XII.
[3] Maiti S, Haupts U, Webb WW. Fluorescence correlation spectroscopy:diagnostics f o r sp a rse molecules[J]. Proc Natl Acad Sci USA, 1997, 94(22):11753-11757.
[4] Masi A, Cicchi R, Carloni A, et al. Optical methods in the study of protein-proteinintera c tions[J]. Adv Exp Med Biol, 2010, 674:33-42.
[5] Ludwig C. Diffusion zwischen ungleich erwärmten Orten gleich zusammengesetzter Lös u n g en[J]. Sitzungsber Akad Wiss Wien Math-Naturwiss, 1856, 20:539.
[6] Wienken CJ, Baaske P, Rothbauer U, et al. Protein-binding assays in biological liquids u sing microscale thermophoresis[J]. Nat Commun, 2010, 1:100.
[7] Duhr S, Braun D. Thermophoretic depletion follows Boltzmann distribution[J]. Phys R ev L ett, 2006, 96(16):168301.
[8] Duhr S, Braun D. Why molecules move along a temperature gradient[J]. Proc Natl A cad Sci USA, 2006, 103(52):19678-19682.
[9] Jerabek-Willemsen M, Wienken CJ, Braun D, et al. Molecular interaction stu dies using m icroscale thermophoresis[J]. Assay Drug Dev Technol, 2011, 9(4):342-353.
[10] Seidel SA, Dijkman PM, Lea WA, et al. Microscale thermophoresis quantifies bi o mol e cular interactions under previously challenging conditions[J]. Methods, 2013, 59(3):301-315.
[11] Garner MM, Revzin A. A gel electrophoresis method for quantifying the binding of proteins to specific DNA regions:application to components of the Escherichia coli lactose operon regulatory system[J]. Nucleic Acids Res, 1981, 9(13):3047-3060.
[12] Engvall E, Perlmann P. Enzyme-linked immunosorbent assay(ELISA). Quantitative assay of immunoglobulin G[J]. Immunochemistry, 1971, 8(9):871-874.
[13] Hellman LM, Fried MG. Electrophoretic mobility shift assay(EMSA)for detecting protein-nucleic acid interactions[J]. NatProtoc, 2007, 2(8):1849-1861.
[14] Fujime S, Ishiwata S. Dynamic study of F-actin by quasielastic scattering of laser light[J]. J Mol Biol, 1971, 62(1):251-265.
[15] Hanlon AD, Larkin MI, Reddick RM. Free-solution, labelfree protein-protein interactions characterized by dynamic light scattering[J]. Biophys J, 2010, 98(2):297-304.
[16] Dandliker WB, Feigen GA. Quantification of the antigen-antibody reaction by the polarization of fluorescence[J]. Biochem Biophys Res Commun, 1961, 5:299-304.
[17] Lea WA, Simeonov A. Fluorescence polarization assays in small molecule screening[J]. Expert Opin Drug Discov, 2011, 6(1):17-32.
[18] Baksh MM, Kussrow AK, Mileni M, et al. Label-free quantification of membrane-ligand interactions using backscattering interferometry[J]. Nat Biotechnol, 2011, 29(4):357-360.
[19] Zillner K, Jerabek-Willemsen M, Duhr S, et al. Microscale thermophoresis as a sensitive method to quantify protein:nucleic acid interactions in solution[J]. Methods Mol B i ol, 2012, 815:241-252.
[20] Seidel SA, Wienken CJ, Geissler S, et al. Label-free microscale thermophoresis discrim i nates sites and affinity of protein-ligand binding[J]. Angew Chem Int Ed Engl, 2012, 51(42):10656-10659.
[21] Seidel SA, Dijkman PM, Lea WA, et al. Microscale thermophoresis quantifies biomolecular interactions under previously challenging conditions[J]. Methods, 2013, 59(3):301-315.
[22] Jerabek-Willemsen M, Andr T, Wanner R, et al. MicroScale Thermophoresis:I nteraction a nalysis and beyond[J]. Journal of Molecular Structure, 2014, 1077:101-113.
[23] Kawahashi Y, Doi N, Takashima H, et al. In vitro protein microarrays for detecti n g prote i n-protein interactions:application of a new method for fluorescence labeling of protei n s[J]. Pro teomics,2003, 3(7):1236-1243.
[24] Hohsaka T, Abe R, Shiraga K, et al. Incorporation of fluorescently labeled nonnat u ral am i no acids into proteins in an E. coli in vitro translation system[J]. Nucleic Acids Res S uppl, 2003(3):271-272.
[25] Serwa R, Wilkening I, Del Signore G, et al. Chemoselective Staudinger-phosphitereaction of azides for the phosphorylation of proteins[J]. Angew Chem Int Ed Engl, 2009, 48(44):8234-8239.
[26] Baaske P, Wienken CJ, Reineck P, et al. Optical thermophoresis for quantifying t he buff e r dependence of aptamer binding[J]. Angew Chem Int Ed Engl, 2010, 49(12):2238-2241.
[27] Wienken CJ, Baaske P, Duhr S, et al. Thermophoretic melting curves quantify theconfor mation and stability of RNA and DNA[J]. Nucleic Acids Res, 2011, 39(8):e52.
[28] Martin D, Charpilienne A, Parent A, et al. The rotavirus nonstructural protein NSP5 coor d inates a[2Fe-2S]iron-sulfur cluster that modulates interaction to RNA[J]. FASEB J, 2013,27(3):1074-1083.
[29] Pham TH, Minderjahn J, Schmidl C, et al. Mechanisms of in vivo binding site selectionof the hematopoietic master transcription factor PU. 1[J]. Nucleic Acids Res, 2013, 41(13):6391-6402.
[30] Keren-Kaplan T, Attali I, Estrin M, et al. Structure-based in silico identification of ubiquitin-binding domains provides insights into the ALIX-V:ubiquitin complex and retrovirus budding[J]. EMBO J, 2013, 32(4):538-551.
[31] Uzarska MA, Dutkiewicz R, Freibert SA, et al. The mitochondrial Hsp70 ch a perone Ss q 1 facilitates Fe/S cluster transfer from Isu1 to Grx5 by complex formation[J]. Mol Biol Cell, 2013, 24(12):1830-1841.
[32] Immekus F, Barandun LJ, Betz M, et al. Launching spiking ligands into a prote i n-proteininterface:a promising strategy to destabilize and break interface formation in a tRN A modify in g enzyme[J]. ACS Chem Biol, 2013, 8(6):1163-1178.
[33] Shang X, Marchioni F, Evelyn CR, et al. Small-molecule inhibitors targeting G-p rotein-co upled Rho guanine nucleotide exchange factors[J]. Proc Natl Acad Sci USA, 2013, 110(8):3155-3160.
[34] 宋水山. N-酰基高丝氨酸内酯介导的细菌与其真核寄主之间的信息交流[J]. 中国细胞生物学学报, 2010(2):331-335.
[35] Van Den Bogaart G, Meyenberg K, Diederichsen U, et al. Phosphatidylinos i t ol 4, 5-bisph o sphate increases Ca2+affinity of synaptotagmin-1 by 40-fold[J]. Journal of Bio l o gical Chemistry,2012, 287(20):16447-16453.
(责任编辑 狄艳红)
Principle and Application of Microscale Thermophoresis in Studies of Biomolecular Interactions
Ai Qiushi1,2,3Cao Xiangyu1,3Zhao Qian1,3Niu Yali1,3,4Song Shuishan1,3
(1. Biology Institute,Hebei Academy of Sciences,Shijiazhuang 050081;2. College of Life Sciences,Agricultural University of Hebei,Baoding 071001;3. Hebei Engineering and Technology Center of Microbiological Control on Main Crop Disease,Shijiazhuang 050081;4. College of Chemistry and Engineering,Hebei University of Technology,Tianjin 300130)
Microscale Thermophoresis(MST)is a new technique to study biomolecular interactions in recent years. It is based on thermophoresis, i.e., the directional movements of molecules in a temperature gradient, which results in subsequent changes of molecular properties such as sizes, charges, hydration shell and conformation. MST combines the precise fluorescence detection and sensitive thermophoresis and provides a sensitive, fast and precise detection technique to analyze biomolecular interactions. Wor king principle, detection process and application of MST in biology researches are reviewed here.
microscale thermophoresis;interaction analysis;binding studies;biomolecular interaction
10.13560/j.cnki.biotech.bull.1985.2015.06.010
2014-08-21
国家自然科学基金项目(31270880)
艾秋实,男,硕士研究生,研究方向:植物抗逆机理;E-mail:yingyangtt@163.com
宋水山,男,博士,研究员,研究方向:细胞信号传导;E-mail:shuishans@hotmail.com

