斑秃患者血清对人头皮毛囊体外生长的影响及自拟生发方的干预作用
郁 辉侯占英杨小秋谢小军
(1 深圳市南山区西丽人民医院皮肤科,广东 深圳 518055;2 深圳市龙华新区观澜人民医院皮肤科,广东 深圳 511180)
斑秃患者血清对人头皮毛囊体外生长的影响及自拟生发方的干预作用
郁 辉1侯占英2杨小秋1谢小军1
(1 深圳市南山区西丽人民医院皮肤科,广东 深圳 518055;2 深圳市龙华新区观澜人民医院皮肤科,广东 深圳 511180)
目的 观察斑秃患者血清对人头皮毛囊体外生长的影响及自拟生发方的干预作用。方法 门诊斑秃患者1例,服药前空腹采血制备不含药血清;给予20 g/kg剂量的自拟生发方口服,连续10 d,于第11天清晨空腹服药后采血制备含药血清。复制人头皮游离毛囊体外培养模型,分为3组:空白对照组加Williams E无血清培养基,不含药斑秃血清组加入体积分数为20%血清,含药斑秃血清组加入体积分数为20%的自拟生发方含药血清。采用倒置显微镜观察毛囊大体形态变化,并测量毛囊生长长度和生长时间,计算前4 d平均生长速度和最终生长长度。结果 不含药斑秃血清组前4 d平均生长速度、生长时间、最终生长长度均减少,与空白对照组比较,差异具有统计学意义(P<0.05或P<0.01);而含药斑秃血清均可不同程度升高以上指标(P<0.05或P<0.01)。结论 自拟生发方具有促进毛囊生长、维持毛囊正常形态的作用,而斑秃血清对毛囊生长具有一定的负影响。
斑秃;自拟生发方;器官培养
斑秃的病因和发病机制尚未完全清楚,暂无特效的治疗方法[1-2]。我们通过取健康成人正常头皮,建立体外游离毛囊培养模型,观察斑秃患者血清对毛囊生长的影响及自拟生发方的干预作用。
1 材料与方法
表1 各组毛囊生长情况的比较()

表1 各组毛囊生长情况的比较()
注:与空白对照组比较,△P<0.05,△△P<0.01;与B组比较,*P<0.05,**P<0.01
组别 毛囊数 前4 d的平均生长速度(mm/d) 生长时间(d) 最终生长长度(mm) A组 20 0.22±0.03 8.7±1.8 1.25±0.26 B组 9 0.16±0.02 5.4±0.5 0.71±0.12 C组 13 0.21±0.03** 6.5±0.7* 1.03±0.5**△
1.1材料:整形外科手术中获得的枕部头皮(年龄28岁)。毛囊培养基,L-谷氨酰胺2 mmol/L,Hepes 20 mmol/L、牛胰岛素10 μg/mL、转铁蛋白10 μg/mL,氢化可的松0.4 μg/mL;青霉素、链霉素100 U/mL。手术显微镜YZ20P5;倒置显微镜Nikon T300带目镜测微尺;CO2培养箱HSO 301T-VBA;电热恒温水浴箱HH W21 600;净化工作台SW-CT-IF。
1.2血清的制备
1.2.1不含药斑秃血清的制备,门诊斑秃患者(初次发病,未治疗,无合并其他自身免疫性疾病者)1例,清晨空腹时肘部浅静脉采血,取血于无抗凝试管中,常温静置一段时间后,在离心机内分离血清,取上清液,经56、30 min灭活处理后,用针头滤器滤过除菌,-20 ℃以下保存备用。
1.2.2含药斑秃血清的制备[3-4]:服用自拟生发方(配方颗粒),颗粒剂,药材制造商:广东省一方药业有限公司,方药组成:党参10 g,生地10 g,熟地10 g,天冬10 g,麦冬10 g,黄精10 g,制首乌10 g,茯苓10 g,女贞子10 g,墨旱莲10 g,枸杞10 g,菟丝子10 g,桑椹子10 g,甘草 6 g。每日1剂,给同一门诊斑秃患者服用(20 g/kg),分两次开水冲服,每次250 mL,连服7 d,于第8天清晨空腹服药(服药前应禁食12 h)后1 h采血,血清制备方法同“1.2.1”。
1.3游离毛囊的分离与培养[5]:参考文献[5]的方法,分离和培养游离毛囊。
1.4试验分组:试验共分为3组,第1组为空白对照组(A组);第2组分别为体积分数为20%的不含药斑秃血清组(B组);第3组分别为体积分数为20%的含药斑秃血清组(C组)。
1.5统计学方法:应用统计软件SPSS 10.0对数据进行统计学处理,数据用()表示,组间比较采用t检验和方差分析,P<0.05具有统计学差异。
2 结 果
2.1毛囊大体形态变化:观察显示,各组毛囊逐日延长。A组的毛囊在培养的第1周形态完好,层次清晰;部分毛囊于9~10 d后毛囊停止生长,呈早期退行变化。B组的大部分毛囊形态第6天开始发生改变,毛母质已萎缩,远离毛乳头,毛乳头也变得模糊,呈现退行休止期样毛囊的毛球部形态。C组的毛囊培养的第2天两组的毛母质都呈倒漏斗形,形态丰满,色素明显。毛乳头清晰可见。培养第6天毛母质略呈缩小的倒漏斗形,毛乳头紧邻于其底部,仍然表现为生长期样毛球部形态,8 d后逐渐进入退行期。毛囊快速生长主要集中在前4 d,此时各组毛囊总的形态没有明显变化,毛囊各层结构清晰,毛球部饱满,毛乳头与毛母质界线分明且呈锥形嵌入其内。随着培养时间的延长,生长速度明显减慢(图1)。
2.2各组毛囊的生长情况:B组前4 d平均生长速度、生长时间、最终生长长度均减少,与空白对照组比较具有显著性差异(均P<0.05或P<0.01);C组可不同程度升高以上指标(P<0.05或P<0.01),见表1。
3 讨 论
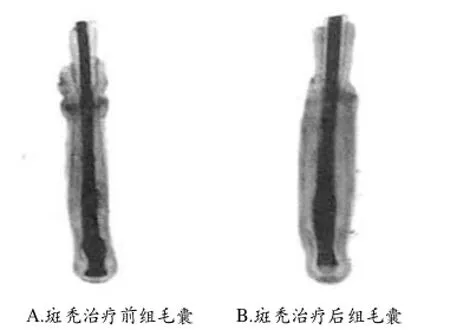
图1 培养第6天后的毛囊形态(×40)
斑秃的病因复杂,其发病机制涉及众多的分子与细胞因子,但其作用尚未明确,Philpott[6]1990年首先建立了人头皮游离毛囊的生长模型,我国从1996年始也逐渐建立了游离毛囊体外培养(小鼠触须、人头皮毛囊和猪耳毛囊)的方法,并就一些细胞因子、皮质类固醇及药物对毛囊生长的影响进行了探讨[7]。有报道,在斑秃患者的外周血中可见抗甲状腺、胃壁细胞、肾上腺细胞等多种自身抗体,并检测到抗毛囊水平细胞成分的自身抗体[8-9]。
中医认为本病的发生为肝、肾、气、血功能失调,风邪入侵,致经脉不畅,发根失养所致。故本病以滋补肝肾、养血益精、祛风生发为治疗原则[10]。我们观察了斑秃患者服用自拟生发方后的血清对健康成人正常头皮毛囊的干预作用,尽可能真实反映药物在患者体内环境中产生的药理效应,在一定程度上更能体现整体给药的效果。方中制何首乌、黄精、菟丝子、枸杞子、黄芪等,具有益气补血、滋养肝、肾作用,不仅能促进生发,还能促进毛发由白变黑。本研究结果表明自拟生发方能够促进毛囊生长、维持毛囊正常形态,从而达到减少毛发脱落、促进毛发生长的效果,这可能是该方治疗斑秃的作用机制之一,但其作用方式和靶点尚不清楚,有待于从分子生物学角度作进一步探讨。
[1]赵莹,蔡泽明,巩毓刚,等.斑秃皮损的皮肤镜影像及其与临床病理的关系[J].中华皮肤科杂志,2011,44(1):30-34.
[2]王博,杨淑霞.斑秃464例临床资料分析[J].临床皮肤科杂志,2011,40(6):346-347.
[3]李仪奎.中药血清药理学实验方法的若干问题[C].//《中药新药与临床药理》二十周年刊庆祝大会暨世中联中药药理专业委员会学术年会论文集.2011:81-83.
[4]孙莉娜,孟静岩,孙晓霞,等.中药血清药理学方法相关问题的思考[J].西部中医药,2012,25(11):36-38.
[5]薛庆善.体外培养的原理与技术[M].北京:科学出版社,2003:304.
[6]Philpott MP,Green MR,Kealey T. Human hair growth in vit ro[J].J Cell Sci,1990,97(Pt3):463.
[7]官浩,周琴,侯宏义,等.毛发移植术中单株毛囊单位分离技术的培训研究[J].中国美容医学,2012,21(3):413-415.
[8]柯玮,朱建华.中药血清药理方法学的研究概况[J].中国医药指南,2011,9(6):24-25.
[9]黄臣虎,陆茵,高骁君,等.中药血清药理学研究进展[J].中国实验方剂学杂志,2011,17(10):266-271.
[10]尤雯丽,艾儒棣.普秃综述[J].光明中医,2013,28(9):1981-1984.
R285.5
B
1671-8194(2015)25-0096-02

