动脉栓塞联合CT引导热消融治疗肝血管瘤
生守鹏, 郑加生
·临床研究Clinical research·
动脉栓塞联合CT引导热消融治疗肝血管瘤
生守鹏,郑加生
目的评价经动脉栓塞(TAE)联合CT引导热消融(射频消融/微波消融,RFA/MWA)治疗肝血管瘤的疗效及安全性。方法回顾分析2008年11月至2013年7月TAE联合CT引导热消融治疗的肝血管瘤患者26例,其中单发14例,多发12例,有症状患者8例。病灶长径5.0~13.0 cm,平均(7.6±2.4)cm。先行TAE治疗,再行CT引导下RFA/MWA治疗,观察完全消融率、病灶缩小程度、手术并发症。结果26例患者中行RFA治疗9例,MWA 17例,共消融病灶27个,行消融治疗28次。23个病灶实现了完全消融,病灶的完全消融率为85.2%(23/27),病灶缩小12.9%~66.3%,平均(31.0±19.6)%。有症状患者经治疗后症状全部消失。消融治疗后出现肝包膜下出血1例、血红蛋白尿1例、胆汁瘤1例,经治疗后好转,总体并发症发生率为11.5%,无严重并发症及死亡患者。结论TAE联合CT引导热消融治疗肝血管瘤疗效确切,无严重并发症及死亡患者,可作为肝血管瘤治疗的选择之一。
肝;血管瘤;栓塞;消融
肝血管瘤是肝内最常见的良性肿瘤,其尸检发现率为0.4%~7.4%[1],其有海绵状血管瘤、毛细血管瘤及血管内皮瘤3种病理类型。组织学和胚胎发生学上已证实是肝胚血管-门静脉系统的先天性畸形,目前尚无恶变报道。对于<5 cm肿瘤以定期复查为主,对于有症状、肿瘤直径>5 cm及焦虑明显患者可给予开腹切除、动脉栓塞等治疗。物理消融治疗作为一种微创治疗方法,具有损伤小、安全性高的优点。2008年11月至2011年7月,我们采用经皮血管栓塞(TAE)联合射频消融/微波消融(RFA/ MWA)治疗肝血管瘤26例,现将其安全性及疗效报道如下。
1 材料与方法
1.1一般资料
本组患者共26例,其中男6例,女20例。患者的年龄27~62岁,平均(48.3±8.2)岁。有症状患者8例,包括腹痛(4例)、上腹部不适(3例)、纳差(1例)。其中单发病例14例,多发12例。治疗病灶27个,其中肝左叶病灶12个,肝右叶病灶15个,病灶长径5.0~13.0 cm,平均(7.6±2.4)cm。术前行增强CT/MRI明确诊断。
1.2方法
1.2.1TAE采用Seldinger技术,经右股动脉插管,5 F肝管在肝固有动脉造影,明确肿瘤的位置、大小及滋养动脉。选择肿瘤供血动脉,注入超液化碘油及明胶海绵颗粒栓塞剂栓塞肿瘤供血动脉。
1.2.2RFA/MWA结合腹部增强CT/MRI确定穿刺点、穿刺角度及消融范围,穿刺前再次行CT扫描,确认消融方案。1%利多卡因局麻后,在千叶针引导下射频电极针/微波天线经皮穿刺至肿瘤行消融治疗。消融范围满意后,撤针行针道消融。
先行TAE治疗,其后1~2周行CT导引下RFA/ MWA治疗,对于体积较大肿瘤,可根据患者肝功能情况分次消融。
1.2.3评价消融后3个月复查肝脏增强CT/MRI以评价治疗效果,病灶无强化视为完全消融。患者病灶缩小程度计算方法:(治疗前长径-消融后长径)/治疗前长径。
1.3统计方法
连续性变量采用平均值±标准差的描述性统计分析。因素间对比采用卡方检验(四格表),P<0.05表示有统计学差异,统计软件采用SPSS 10.0。
2 结果
2.1疗效
26例患者中行RFA治疗9例,MWA 17例,共消融病灶27个,行消融治疗28次。所有患者经消融治疗后症状完全消失。其中有23个病灶实现了完全消融(图1),病灶的完全消融率为85.2%(23/ 27),病灶缩小12.9%~66.3%(平均31.0%±19.6%)。MWA的完全消融率(82.4%,14/17)与RFA的完全消融率(8/9)间差异无统计学意义(P=0.589);5~8 cm肿瘤的完全消融率(100%,12/12)与>8 cm肿瘤的完全消融率(73.3%,11/15)间差异无统计学意义(P=0.053)。
2.2并发症
1例患者在消融术中出现肝包膜下少量出血,即刻行穿刺部位肿瘤区补充消融,同时给予保守治疗后出血停止;1例患者消融术后出现血红蛋白尿,经大量补液后好转;1例患者出现胆汁瘤,经穿刺引流后好转。本组患者并发症发生率为11.5%(3/26),无严重并发症及死亡患者。其中RFA并发症1例(肝包膜下出血),患者肿瘤血供丰富、离肝包膜距离小于1 cm。MWA并发症2例(血红蛋白尿及胆汁瘤),此2例患者肿瘤直径均超过8 cm,其中血红蛋白尿患者的肿瘤直径为13 cm。
3 讨论
肝血管瘤是肝内最常见的良性肿瘤,具有较高的罹患率(5%~7%)。在肝血管瘤的治疗方法和指征的选择上,目前尚无统一意见。一般认为肿瘤直径>5 cm、有临床症状、生长速度快、压迫周围脏器、患者焦虑明显等作为治疗的指征。据文献报道,肝血管瘤至今尚未见恶变病例,且自发破裂出血的风险极小[2]。在预后方面,Herman等[3]报道,249例肝血管瘤,未经手术治疗者241例,经过平均78个月随访,未发现任何与肝血管瘤相关的并发症。Yoon等[4]报道163例肝血管瘤长期随访,平均92个月,并发症包括2例Kasabach-Merritt综合征,1例肝内出血,2例Budd-Chiari Syndrome综合征。综上所述,肝血管瘤对患者的危害相对较小,因此应严格把握治疗指征,慎重选择治疗方法。
目前肝血管瘤的治疗以外科手术为主,主要包括肝血管瘤切除及肝动脉结扎,肝血管瘤切除是目前最常见的外科治疗方法,其优点是肿瘤消除彻底,不易复发。但是由于肝血管瘤血供丰富,术中易出现大出血而造成肝功能损害甚至危及生命。对于位置比较深在的血管瘤,需要牺牲大量正常肝组织。同时由于创伤大,高龄、有合并症的患者也无法采用此种治疗方法。
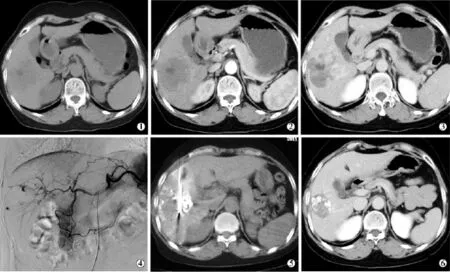
图1 消融治疗前后图像
相对于外科切除,肝动脉化疗栓塞基本不存在术中大出血的风险,目前以碘油+平阳霉素+明胶海绵的栓塞方案安全性高,此外相对于外科切除具有手术时间短、术后恢复快、住院时间短、可重复操作的优点[5-6],可预防肿瘤破裂出血及缓解Kasabach-Merritt综合征[7],其缺点是根治率低,复发率高,还存在胆道损伤、异位栓塞等风险[3,8]。
消融技术目前已广泛应用于肝恶性肿瘤的治疗,资料显示其具有安全性高、疗效确切的优点,近期不断有人将其应用在肝血管瘤的治疗上,并取得了良好的效果[9-10]。肝血管瘤血供丰富,穿刺过程中易出血,同时由于“热沉降效应”的存在,消融时间长。通过联合TAE,可阻断肿瘤的供血动脉,减少瘤内血流,降低术中出血的风险,同时减少消融时间。
我们采用TAE联合物理消融的方法治疗肝血管瘤,23个病灶实现了完全消融,病灶的完全消融率为85.2%(23/27),在肿瘤的完全消融率上,RFA与MWA间差异无统计学意义。未完全消融的病灶全部是长径>8 cm的病灶,但5~8 cm肿瘤与>8 cm肿瘤间的完全消融率差异无统计学意义,可能与本组患者样本量较小有关。3个月后随访,病灶缩小12.9%~66.3%(平均31.0%±19.6%)。我们观察到本组患者肿瘤的体积缩小程度低于文献报道单纯消融的方法,原因考虑与碘油的沉积有关,碘油沉积越密实,沉积范围越广,肿瘤的缩小程度越小。经过治疗,本组所有患者症状得到了完全缓解。
肝血管瘤消融治疗的常见发症是出血和急性肾损伤。一般认为肿瘤越大、血供越丰富,消融区域越大,出现血红蛋白尿、急性肾损伤甚至肾衰竭的风险越大。本组患者中有1例患者出现了血红蛋白尿,患者病灶较大,单次消融体积较大,但是由于术后及时补液治疗,避免了急性肾损伤及肾衰竭的出现。其他的并发症还包括胆汁瘤1例,肝包膜下出血1例,即刻行穿刺部位肿瘤区补充消融,同时给予保守治疗后出血停止。本组患者的总体并发症的发生率为11.5%,无严重并发症及死亡患者。
在消融方法的选择上,我们使用了RFA和MWA。相对于RFA,MWA效率更好,因此在巨大肿瘤的消融治疗上我们较多选择了MWA。在并发症方面,RFA并发症1例(出血),MWA并发症2例(血红蛋白尿及胆汁瘤),其中出血患者的肿瘤血供丰富、离肝包膜距离小于1 cm。而发生血红蛋白尿与胆汁瘤的的患者肿瘤直径均超过8 cm,其中血红蛋白尿患者的肿瘤直径为13 cm。在治疗效果上,MWA的完全消融率(82.4%,14/17)与RFA的完全消融率(90.0%,9/10)间无统计学差异(P=0.589)。
我们认为肝血管瘤的消融治疗应注意以下几个问题:①穿刺过程应尽量经过较多的正常肝组织,减少出血风险;②精确进针,避免反复穿刺,消融针进入肿瘤后调整穿刺角度之前应给予肿瘤局部消融,撤针时应消融针道;③避免单次消融体积过大,术后要给予补液治疗,避免急性肾损伤甚至肾衰竭的发生;④不应过分追求肿瘤的完全消融,不需要肿瘤消融边缘,避免损伤过多的正常肝组织及损伤周围的组织、器官;⑤一旦出现穿刺引起的出血,可行肿瘤局部补充消融同时给予保守治疗,及时考虑行肝动脉栓塞止血。
综上所述,TAE联合CT引导RFA/MWA治疗肝血管瘤疗效确切、安全性好,可作为肝血管瘤治疗的选择之一。
[1]Jr MA,Papaiordanou F,Goncalves JM,et al.Spontaneous rupture of hepatic hemangiomas:A review of the literature[J].World J Hepatol,2010,2:428-433.
[2]Yamamoto T,Kawarada Y,Yano T,et al.Spontaneous rupture of hemangioma of the liver:treatment with transcatheter hepatic arterial embolization[J].Am J Gastroenterol,1991,86:1645-1649.
[3]Herman P,Costa ML,Machado MA,et al.Management of hepatic hemangiomas:a 14-year experience[J].J Gastrointest Surg,2005,9:853-869.
[4]Yoon SS,Charny CK,Fong Y,et al.Diagnosis,management,and outcomes of 115 patients with hepatic hemangioma[J].J Am Coll Surg,2003,197:392-402.
[5]曾庆乐,陈勇,赵剑波,等.介入与外科手术治疗症状性肝海绵状血管瘤的成本效益分析[J].介入放射学杂志,2009,18:93-96.
[6]蒋旭远,徐克.平阳霉素碘油乳剂动脉栓塞治疗肝血管瘤的中远期疗效评价[J].介入放射学杂志,2012,21:31-34.
[7]Malagari K,Alexopoulou E,Dourakis S,et al.Transarterial embolizationofgiantliverhemangiomasassociatedwith Kasabach-Merritt syndrome:a case report[J].Acta radiol,2007,48:608-612.
[8]周胜利,王宗盛,张根山,等.肝海绵状血管瘤介入治疗及并发症预防[J].介入放射学杂志,2006,15:370-372.
[9]Cui Y,Zhou LY,Dong MK,et al.Ultrasonography guided percutaneousradiofrequencyablationforhepaticcavernous hemangioma[J].World J Gastroenterol,2003,9:2132-2134.
[10]Tang XY,Wang Z,Wang T,et al.Efficacy,safety and feasibility of ultrasound-guided percutaneous microwave ablation for large hepatic hemangioma[J].J Dig Dis,2015,16:525-530.
Transcatheter arterial embolization combined with CT-guided thermal ablation for the treatment of hepatic hemangiomas
SHENG Shou-peng,ZHENG Jia-sheng.Minimally-Invasive Interventional Center of Oncology,Affiliated Beijing Youan Hospital,Capital Medical University,Beijing 100069,China
ZHENG Jia-sheng,E-mail:shengshoupeng@163.com
ObjectiveTo evaluate the efficacy and safety of transcatheter arterial embolization(TAE)combined with CT-guided thermal ablation in treating hepatic hemangiomas.MethodsBetween November 2008 and July 2013,a total of 26 patients with hepatic hemangioma were treated with combination therapy of TAE and CT-guided thermal ablation.Of the 26 patients,single lesion was seen in 14 and multiple lesions were found in 12.There were 8 symptomatic patients in this series.The diameter of the lesions was(5.0-13.0)cm with a mean of(7.6±2.4 cm).TAE was performed first,which was followed by CT-guided thermal ablation therapy.The complete ablation rate,the reduction degree of lesion's volume,and the procedure-related complications were recorded.ResultsOf the 26 patients,CT-guided radiofrequency ablation(RFA)was carried out in 9 and microwave ablation(MWA)in 17.A total of 27 lesions were treated with 28 ablation procedures.Complete necrosis was achieved in 23 lesions,with a complete ablation rate of 85.2%(23/27).The lesion's volume was reduced by 12.9%-66.3%(mean 31%±19.6%).After the treatment the clinical symptoms disappeared in all symptomatic patients.Complications included hepatic subcapsular hemorrhage(n=1),hemoglobinuria(n=1)and biloma(n=1),which were improved after proper medication. The general incidence of moderate complications was 11.5%,no severe complications or death occurred. ConclusionFor the treatment of hepatic hemangiomas,TAE combined with CT-guided thermal ablation is effective and reliable with no severe complications or death.Therefore,this technique can be regarded as one treatment choice for hepatic hemangiomas.(J Intervent Radiol,2015,24:996-999)
liver;hemangioma;embolization;ablation
R735.7
B
1008-794X(2015)-11-0996-04
2014-12-16)
(本文编辑:俞瑞纲)
10.3969/j.issn.1008-794X.2015.11.016
国家科技支撑计划资助项目(2012BAI15B08)
100069北京首都医科大学附属北京佑安医院肿瘤微创介入中心
郑加生E-mail:shengshoupeng@163.com

