脑脊液中CD4+CD25+Tr细胞和sICAM-1与蛛网膜下腔出血相关性研究
马恒飞, 朱 洁, 李灵军, 马慧贤, 王黎洲, 周 石
·神经介入Neurointervention·
脑脊液中CD4+CD25+Tr细胞和sICAM-1与蛛网膜下腔出血相关性研究
马恒飞,朱洁,李灵军,马慧贤,王黎洲,周石
目的探讨脑脊液中CD4+CD25+Tr细胞(Treg)、可溶性细胞间黏附分子(sICAM)-1与蛛网膜下腔出血(SAH)发生发展的相关性。方法随机选取住院治疗的SAH患者108例(观察组)和非器质性神经病变伴头痛患者100例(对照组),采用流式细胞仪多色技术检测脑脊液中Treg,酶联免疫吸附试验(ELISA)检测白细胞介素(IL)-10、转化生长因子(TGF)-β1、IL-6、sICAM-1。比较两组患者Glasgow昏迷量表(GCS)评分、美国国立卫生研究院卒中量表(NIHSS)评分、视觉模拟评分(VAS),分析它们与Treg的关系。分析Hunt-Hess分级、脑血管痉挛与sICAM-1的关系。结果观察组患者Treg、IL-10、TGF-β1分别为(1.09±0.21)%、(0.67±0.17)%、(0.29±0.08)%,显著低于对照组(P<0.05);sICAM-1、IL-6分别为(793.1±84.8)pg/ml、(47.2±24.9)pg/ml,显著高于对照组(P<0.05)。自发性SAH患者Treg、NIHSS评分、VAS评分显著低于外伤性SAH患者,GCS评分显著高于外伤性SAH患者(P<0.05)。Treg、IL-10、TGF-β1与GCS评分呈正相关,与NIHSS评分、VAS评分呈负相关(P<0.05)。随着Hunt-Hess分级增加,sICAM-1与IL-6逐渐升高,各Hunt-Hess分级间差异有统计学意义(P<0.05)。脑血管痉挛患者sICAM-1、IL-6显著高于脑血管非痉挛患者(P<0.05)。结论Treg下降对自发性SAH发生影响较大,sICAM-1升高可加速SAH病情并向脑血管痉挛发展。
CD4+CD25+调节性T细胞;可溶性细胞间黏附分子-1;蛛网膜下腔出血
蛛网膜下腔出血(SAH)是临床常见急性脑血管疾病,其病理生理机制与机体免疫功能密切相关。CD4+CD25+Tr细胞(Treg)属T细胞亚群,具有明显的免疫抑制功能[1-2]。研究发现动脉瘤患者Treg水平较正常人显著降低,是导致动脉瘤发生的重要免疫学机制之一[3]。可溶性细胞间黏附分子(sICAM)-1在参与介导SAH后脑血管痉挛与炎性反应中起关键作用[4],有助于预测SAH病情发展。Treg和sICAM-1在SAH病情发生发展中的作用研究较少,现将我们的研究结果报道如下。
1 材料与方法
1.1临床资料
随机选取2011年1月至2014年1月在贵阳医学院附属医院住院治疗的SAH患者108例(观察组),其中男65例,女43例,年龄27~62岁,平均(53.4±11.7)岁;Fisher分级Ⅰ级16例,Ⅱ级33例,Ⅲ级45例,Ⅳ级14例;Hunt-Hess分级Ⅰ级22例,Ⅱ级44例,Ⅲ级24例,Ⅳ~Ⅴ级18例。108例中55例为自发性SAH,入组标准[5]:①CT确诊SAH伴剧烈头痛;②MRI或DSA确诊动脉瘤破裂出血;③有腰穿刺和脑脊液检查适应证,签署知情同意书。53例为外伤性SAH,入组标准[6]:①CT确诊为SAH伴闭合性颅脑损伤,采用保守治疗;②排除外伤性头晕和头痛;③自愿接受腰穿刺和脑脊液检查。另外选取非器质性神经病变伴头痛患者100例(对照组),其中男59例,女41例,年龄26~64岁,平均(53.0± 12.1)岁。观察组和对照组患者性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。
1.2检测方法
全部患者住院期间经腰椎穿刺采集脑脊液,低温下放置备用,准备好全部标本后集中检测。检测所用CD4-PE和CD25-FITC抗体购自南京建城生物工程研究所。采用流式细胞仪(美国Beckman Coulter公司)多色技术检测脑脊液Treg百分含量,酶联免疫吸附试验(ELISA)法检测白细胞介素(IL)-10、转化生长因子(TGF)-β1、IL-6、sICAM-1水平。
采用经颅多普勒(TCD)超声检测大脑中动脉血流速度(VMCA),>120 cm/s评定为脑血管痉挛[7],反之为非脑血管痉挛。
1.3观察指标
根据Glasgow昏迷量表(GCS)评分标准[8]评价颅脑损伤程度,美国国立卫生研究院卒中量表(NIHSS)评分[8]评价神经功能缺损程度,视觉模拟评分(VAS)[8]评价头痛程度,Fisher分级[9]评价出血量,Hunt-Hess分级[9]评价病情程度。
1.4统计学处理
采用SPSS 18.0软件进行统计学分析。组间计量资料用T检验,以均数±标准差()表示,相关性分析用Pearson检验,P<0.05提示差异有统计学意义。
2 结果
观察组患者脑脊液Treg、IL-10、TGF-β1水平显著低于对照组,差异有统计学意义(P<0.05);观察组患者sICAM-1、IL-6水平显著高于对照组,差异有统计学意义(P<0.05)(表1)。自发性SAH患者Treg水平、NIHSS评分、VAS评分显著低于外伤性SAH患者,差异有统计学意义(P<0.05)。自发性SAH患者GCS评分显著高于外伤性SAH患者,差异有统计学意义(P<0.05)(表2)。Treg、IL-10、TGF-β1水平与GCS评分呈正相关(均r>0,P<0.05),Treg、IL-10、TGF-β1水平与NIHSS评分、VAS评分呈负相关(均r<0,P<0.05)(表3)。随着患者Hunt-Hess分级增加,sICAM-1和IL-6水平也逐渐升高,各Hunt-Hess分级间比较之差异均有统计学意义(P<0.05);脑血管痉挛患者sICAM-1与IL-6水平显著高于脑血管非痉挛患者,差异均有统计学意义(P<0.05)(图1)。
表1两组脑脊液Treg、sICAM-1水平比较 ()

表1两组脑脊液Treg、sICAM-1水平比较 ()
表2 SAH患者Treg水平与临床评分之间差异 ()
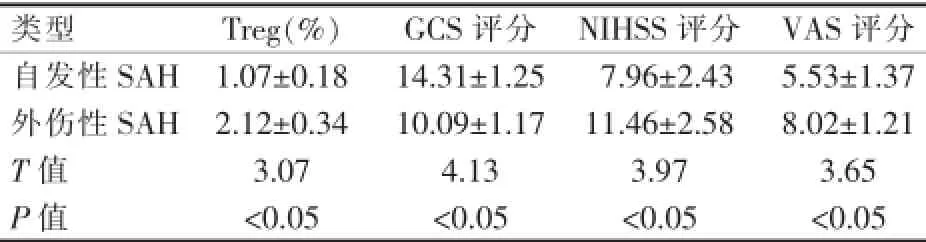
表2 SAH患者Treg水平与临床评分之间差异 ()
类型 Treg(%) GCS评分 NIHSS评分 VAS评分自发性SAH 1.07±0.18 14.31±1.25 7.96±2.43 5.53±1.37外伤性SAH 2.12±0.34 10.09±1.17 11.46±2.58 8.02±1.21 T值 3.07 4.13 3.97 3.65 P值 <0.05 <0.05 <0.05 <0.05

表3 Treg、IL-10、TGF-β1水平与临床评分相关性
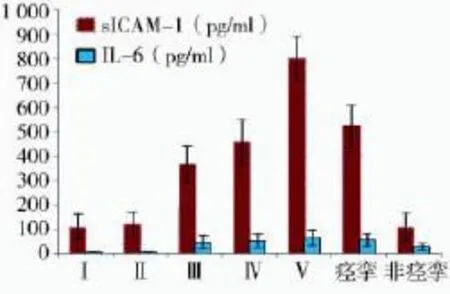
图1 不同病情程度(Hunt-Hess分级)SAH患者sICAM-1和IL-6水平比较
3 讨论
Treg是一群CD4与CD25同时表达的T细胞,通过减轻免疫反应降低机体组织及器官损害。研究表明,动脉管壁免疫性损害可导致动脉瘤破裂出血后自发性SAH[10]。此外,Treg减少引起的血管内炎性反应抑制,可不完全地加重血管内膜损伤,从而导致动脉瘤破裂出血并出现自发性SAH。IL-10、TGF-β1是特异性细胞因子,也是Treg执行免疫抑制功能的关键物质[11]。TGF-β1百分含量降低可引起血管内皮细胞损伤,导致血管内膜不稳定并形成血管斑块[12];Treg分泌的TGF-β1是血管内皮细胞抑制炎性反应的主要物质,其降低可引起不可控制的炎性作用,引发动脉瘤破裂而导致SAH发生[13-14]。SAH受免疫学机制影响还表现在SAH发生后血管壁继发免疫炎性反应,引起脑血管痉挛,其病情随着炎性细胞因子和sICAM-1逐渐增多而逐渐加重,促进SAH发展。sICAM-1是一种常见炎性介质,其正常表达利于机体抑制炎性反应,但过度表达可对机体产生较大损害。有研究表明,sICAM-1含量增加是白细胞和血管内皮细胞激活或损害的标志[15]。本实验研究Treg、sICAM-1在SAH发生发展中的作用,旨在探讨Treg、sICAM-1检测在SAH诊断和治疗中的价值。
本实验表明,SAH患者Treg、IL-10、TGF-β1水平显著低于非SAH患者,sICAM-1、IL-6水平显著高于非SAH患者;自发性SAH患者Treg水平、NIHSS评分、VAS评分显著低于外伤性SAH患者,GCS评分显著高于外伤性SAH患者;Treg、IL-10、TGF-β1水平与GCS评分呈正相关,与NIHSS评分、VAS评分呈负相关;随着Hunt-Hess分级增加,sICAM-1、IL-6水平逐渐升高,各Hunt-Hess分级间比较之差异有显著统计学意义;并发脑血管痉挛患者sICAM-1、IL-6水平显著高于未并发脑血管痉挛患者。本实验结果提示:①IL-10、TGF-β1、Treg对自发性SAH诊断具有特异性,可作为鉴别诊断自发性和外伤性SAH的依据;②Treg水平与NIHSS评分、VAS评分呈负相关,与GCS评分呈正相关,说明Treg与SAH发生密切相关;③sICAM-1水平升高与并发脑血管痉挛、SAH病情向较严重程度发展相一致,说明sICAM-1参与SAH并发脑血管痉挛发生。Treg在自发性SAH发生中起着非常重要的作用,而sICAM-1升高可加速SAH并发脑血管痉挛发生。
综上所述,Treg水平下降对自发性SAH发生影响较大,sICAM-1水平升高可加速SAH病情并向脑血管痉挛发展。临床上检测脑脊液Treg对鉴别诊断自发性与外伤性SAH有一定价值,检测sICAM-1对预测SAH病情发展与并发脑血管痉挛有重要意义。
[1]陈文龙,汤建平.调节性T细胞与类风湿关节炎的研究进展[J].中华临床医师杂志·电子版,2012,19:133-135.
[2]王立静,苗同国,宁更献,等.肝动脉化疗栓塞术对原发性肝癌患者T淋巴细胞亚群的影响[J].介入放射学杂志,2015,24:165-168.
[3]罗赛华,戴世学,梁仔,等.颅内动脉瘤破裂与CD8+CD28-调节性T细胞的关系[J].中国神经精神疾病杂志,2012,38:425-427.
[4]黄风怡,郑晓春,李荣钢,等.肝门阻断再灌注后肠黏膜损伤中髓过氧化酶活性和TNF-α及细胞间黏附分子1的表达研究[J].中华临床医师杂志·电子版,2012,19:5873-5876.
[5]冯路,徐菱霜,黄睿.自发性蛛网膜下腔出血CTA阴性患者21例分析[J].中国现代医生,2012,24:147-149.
[6]屠传建,顾志伟,宋大刚,等.外伤性蛛网膜下腔出血后颅内压和大脑中动脉流速的相关性研究[J].中华急诊医学杂志,2013,22:792-794.
[7]韩震,王中,崔岗,等.经颅多普勒超声评价外伤性脑血管痉挛[J].实用医学杂志,1995,9:575-576.
[8]Provencio JJ,Altay T,Smithason S,et al.Depletion of Ly6G/C+cells ameliorates delayed cerebral vasospasm in subarachnoid hemorrhage[J].J Neuroimmunol,2011,232:94-100.
[9]顾大群,张扬,晁迎九,等.超早期栓塞治疗对破裂颅内动脉瘤患者预后的影响[J].介入放射学杂志,2014,23:1029-1032.
[10]李瑾,沙杜鹃,李启明,等.动脉瘤破裂性蛛网膜下腔出血发生后血浆儿茶酚胺的含量变化及其与神经源性肺水肿发生的关系[J].临床和实验医学杂志,2013,12:1204-1206.
[11]Chou SH,Feske SK,Simmons SL,et al.Elevated peripheral neutrophils and matrix metalloproteinase 9 as biomarkers of functional outcome following subarachnoid hemorrhage[J].Transl Stroke Res,2011,2:600-607.
[12]Ayer RE,Ostrowski RP,Sugawara T,et al.Statin-induced T-lymphocyte modulation and neuroprotection following experimental subarachnoid hemorrhage[J].Acta Neurochir Suppl,2013,115:259-266.
[13]MathiesenT,LefvertAK.Cerebrospinalfluidandblood lymphocyte subpopulations following subarachnoid haemorrhage[J].Br J Neurosurg,1996,10:89-92.
[14]Zhang J,Chen G,Zhou D,et al.Expression of CD137 in the cerebral artery after experimental subarachnoid hemorrhage in rats:a pilot study[J].Brain Res,2011,1386:200-208.
[15]杨丽莎,王钊,覃理灵,等.HBV感染患者不同免疫状态下血清sICAM-1表达的研究[J].重庆医学,2010,39:3158-3159.
Study on the correlation of CD4+CD25+Tr cells and sICAM-1 in cerebrospinal fluid with subarachnoid hemorrhage
MA Heng-fei,ZHU Jie,LI Ling-jun,MA Hui-xian,WANG Li-zhou,ZHOU Shi.Department of Interventional Radiology,First People's Hospital of Pingdingshan,Pingdingshan,Henan Province 467000,China
ZHOU Shi,E-mail:156722229@qq.com
ObjectiveTo investigate the correlation between CD4+CD25+Tr cells(Treg),soluble intercellular adhesion molecule-1(sICAM-1)in cerebrospinal fluid and the development of subarachnoid hemorrhage(SAH).MethodsA total of 108 hospitalized patients with SAH (observation group)and 100 hospitalized patients with non-organic neuropathy associated with headache(control group)were randomly selected.Flow cytometry was used to detect Treg in cerebrospinal fluid,and enzyme linked immunosorbent assay(ELISA)was employed to determine(IL)-10 and transforming growth factor beta 1(TGF-β1),IL-6 and sICAM-1.Glasgow Coma Scale(GCS)scores,stroke scale(NIHSS)scores and visual analog scale(VAS)scores of the two groups were determined,and results were compared between the two groups.The relationship between Hunt-Hess grade,cerebral vasospasm and sICAM-1 was analyzed.ResultsThe Treg,IL-10,TGF-β1 of the observation group were(1.09±0.21)%,(0.67±0.17)%and(0.29±0.08)%respectively,which were significantly lower than those of the control group(P<0.05);the sICAM-1 and IL-6 of the observation group were(793.1±84.8)pg/ml and(47.2±24.9)pg/ml respectively,which were significantlyhigher than those of the control group(P<0.05).The Treg,NIHSS scores and VAS scores in the patients with spontaneous SAH were significantly lower than those in the patients with traumatic SAH,while the GCS scores in the patients with spontaneous SAH were significantly higher than those in the patients with traumatic SAH (P<0.05).Treg,IL-10 and TGF-β1 carried a parallel correlation with GCS scores,while a negative correlation with NIHSS scores and VAS scores(P<0.05).With the increase of Hunt grade,IL-6 and sICAM-1 gradually increased,and the differences between different Hunt-Hess grades were statistically significant(P<0.05).The sICAM-1 and IL-6 of the patients with cerebral vasospasm were significantly higher than those of patients with no cerebral vasospasm(P<0.05).ConclusionThe decrease of Treg has a strong influence on the development of spontaneous SAH,and the increase of sICAM-1 can accelerate the development of SAH toward cerebral vasospasm.(J Intervent Radiol,2015,24:939-942)
CD4+CD25+regulatory T cells;soluble intercellular adhesion molecule-1;subarachnoid hemorrhage
R743.4
A
1008-794X(2015)-11-0939-04
2015-03-25)
(本文编辑:边佶)
10.3969/j.issn.1008-794X.2015.11.002
国家自然科学基金(81460276)
467000河南平顶山市第一人民医院介入科(马恒飞);贵阳医学院附属医院放射科(王黎洲、周石)
周石E-mail:156722229@qq.com

