提高重组型腺相关病毒转导效率的研究现状
殷子斐王丽娜王园凌晨
(1. 中国人民解放军第二军医大学,上海 200433;2.佛罗里达大学,美国佛罗里达州 32610)
提高重组型腺相关病毒转导效率的研究现状
殷子斐1王丽娜1王园1凌晨2
(1. 中国人民解放军第二军医大学,上海200433;2.佛罗里达大学,美国佛罗里达州32610)
重组型腺相关病毒(recombinant adeno-associated virus,rAAV)载体是目前基因治疗研究中常用的、非常有前景的载体之一。欧洲第一个批准上市的基因治疗药物正是基于rAAV。然而,rAAV的转导效率相对有限,导致其治疗成本过高;且过高剂量的rAAV可以激发人体的免疫反应,降低其疗效。因此,如何提高rAAV的转导效率一直是基因治疗领域研究的热点之一。目前常用的提高rAAV转导效率的方法有:使用组织特异性强的血清型/变体、应用蛋白酶体抑制剂、突变衣壳蛋白表面裸露氨基酸、增加单链DNA的第二链合成、构建自身互补型双链载体等。就这些方法各自的原理、应用现状及优劣势进行系统地综述。
重组腺相关病毒载体;基因治疗;转导效率
腺相关病毒(Adeno-associated virus,AAV)是一种无包被,直径约22 nm的单链DNA病毒。它是一种非致病病毒,目前尚未发现与AAV相关的人类或其他哺乳类疾病。与其他基因治疗载体相比,重组型腺相关病毒(Recombinant adeno-associated virus,rAAV)载体具有安全性好、免疫原性低、物理性质稳定、感染细胞谱广等优点,可在体内外有效介导外源基因长期稳定表达,被视为最有前途的基因治疗载体之一。目前,rAAV已经被用于血友病、先天性黑矇、囊性纤维变性等多项基因治疗的临床研究中[1-3]。此外,全球第一个基因治疗药物——Glybera已经于2012年底批准上市,主要用于治疗脂蛋白脂酶缺乏遗传病,而它的载体正是AAV1。
然而rAAV转导效率相对较低,必须使用大量的病毒才能达到有效的治疗效果,从而导致其治疗费用相对较高[4]。此外,过高剂量rAAV的衣壳蛋白会激发宿主的免疫排斥反应,限制基因治疗载体的转导效率[5,6]。因此,如何提高rAAV转导效率成了近年来基因治疗领域的研究热点之一。由于目前已有学者针对如何通过调控免疫反应,增加rAAV的转导效率进行了系统的综述[5-9],故笔者现主要针对rAAV从进入细胞到在细胞中实现转基因表达的各个环节,探讨能够有效提高rAAV转导效率的方法,并对这些方法的原理及优劣势进行分析。
1 AAV基本生物学特征
成熟的AAV衣壳是由VP1、VP2和VP3三种衣壳蛋白装配而成,其分子量大小分别为87、73、62 kD,三者的分子数目比例约为1∶1∶10。野生型(wide-type,wt)AAV的基因组为单链(Single-stranded,ss)、约4 800个碱基的线形DNA,其两末端为145个碱基组成的倒置末端重复序列(Inverted terminal repeat,ITR)。在ITR序列之间为病毒蛋白编码区,包含两个开放阅读框架,产生复制蛋白质(Rep)、衣壳蛋白质(Cap)和包装激活蛋白质(Assembly-activating protein,AAP)。基因治疗载体rAAV仅仅保留了AAV基因组末端的ITR,而将Rep、Cap及AAP的基因以目的基因盒替代(图1)。在ITR结构中,有3段回文结构和一段非回文结构,3段回文结构形成发夹状,非回文结构为D序列,其中含有末端断裂位点(Terminal resolution site,trs)。在AAV的复制过程中,其以自身3'-OH为引物,产生2个等长的具有一个共价连接末端的复制中间体(子/母链)(图1)。之后,Rep蛋白发挥核酸内切酶的作用,在母链trs处产生一个缺口。新产生的3'-OH作为DNA聚合酶底物,合成新的ITR。经过新一轮复制,可形成一个新的单链AAV病毒基因及一个子/母链共存二聚体[1,2,10]。
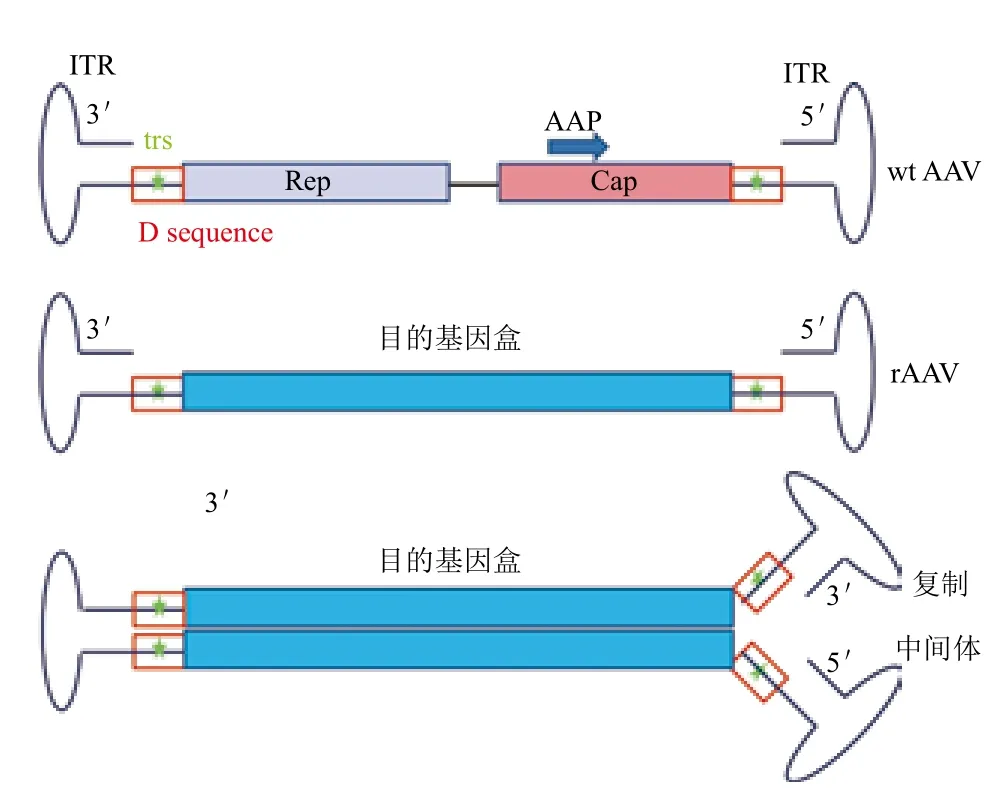
图1 AAV结构示意图
在AAV感染细胞的过程中,病毒颗粒不停地撞击靶细胞,直至衣壳蛋白与细胞表面相应的受体、共受体结合,借助于细胞内吞作用形成内含体进入细胞,随后因内含体酸化后从内含体中逸出,并向细胞核内运输,运输过程中,其衣壳蛋白表面会被磷酸化、泛素化,从而被蛋白酶体降解。未被降解而进入细胞核内的病毒颗粒逐渐脱壳,释放出其中的ssDNA。ssDNA不能作为mRNA转录模板,必须进一步合成为双链(Double-stranded,ds)DNA,最终通过转录、翻译过程实现目的基因的表达[1,11-14](图2)。此外,也有报道高尔基体/内质网参与到了AAV在细胞质内的转运过程[15]。

图2 AAV在细胞中的生物学过程示意图
2 提高腺相关病毒转导效率的方法
2.1 选择组织特异性强的血清型/变体
根据衣壳蛋白抗原的不同,AAV可以分为1-13个血清型,且不同血清型的组织靶向性不完全相同。通过系统注射和局部注射的方法,现已经证实:AAV3、AAV8和AAV9对肝脏靶向性较强;AAV6、AAV8对心脏、胰腺的特异性突出;AAV4、AAV9对肺的特异性明显;AAV2对肾的特异性较强;AAV1、AAV2、AAV5和AAV9对脑组织的特异性较好;对骨骼肌选择性较强的载体有AAV1、AAV5、AAV6、AAV7、AAV8和AAV9;另外,AAV2、AAV5对角膜的靶向性优于其他血清型[16-18]。为了更加精确地针对特殊细胞群进行治疗,越来越多的研究者针对特定组织中的某一类细胞筛选rAAV不同血清型。例如,本课题组[19-21]的研究表明:rAAV3能使用人肝细胞生长因子受体作为共受体,对肝癌细胞的靶向性很强;Markakis等[22]发现AAV5在神经元蛋白阳性、胶质原纤维酸性蛋白阳性的细胞中转导效率最佳;Aschauer等[23]报道:rAAV8主要在脑星形细胞中表达,而脑皮层神经元是rAAV9的主要靶向组织。
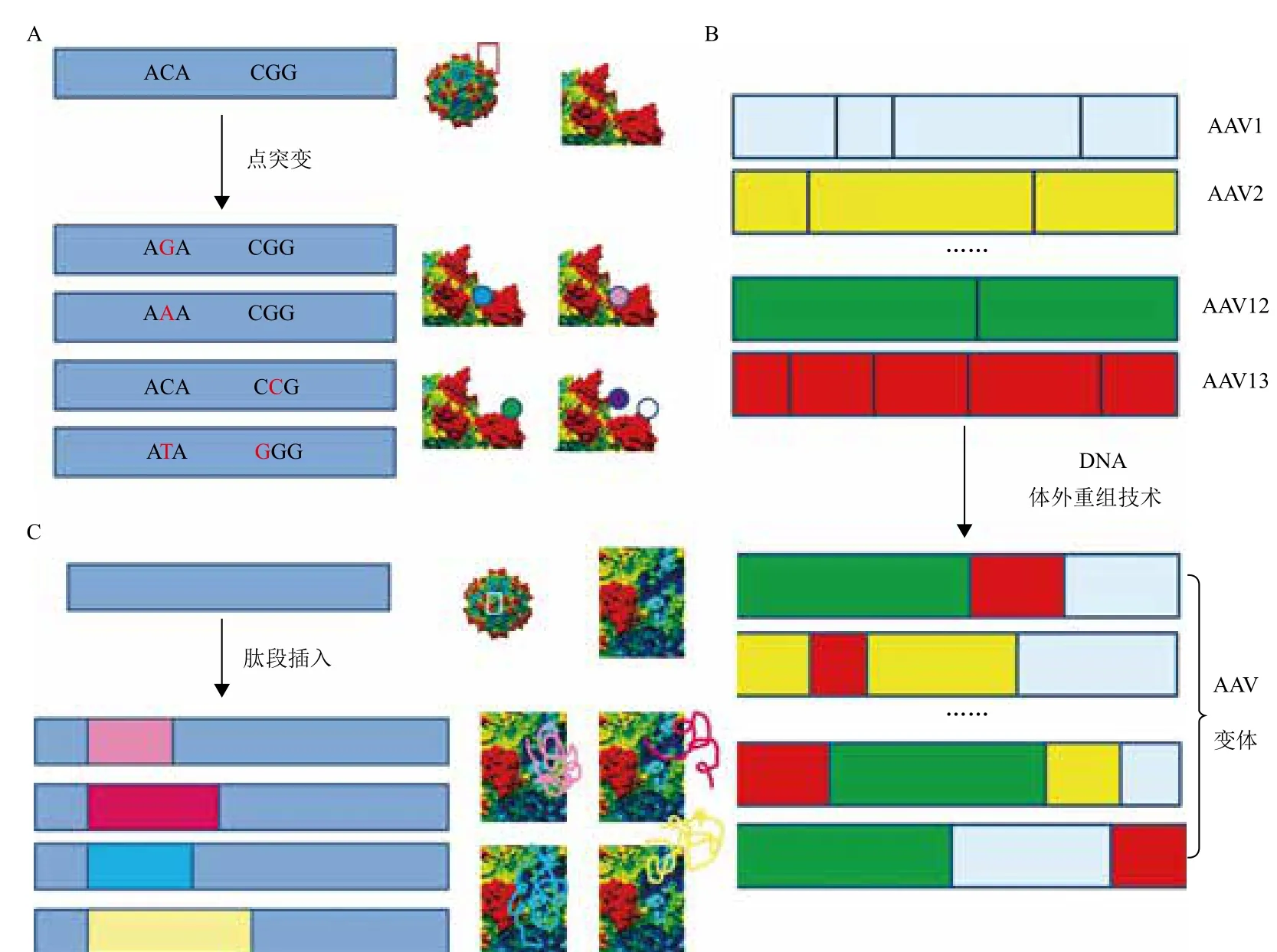
图3 AAV文库的构建方法
近年来,借助于现代分子生物学技术,通过点突变、DNA体外重组技术(DNA shuffling)、衣壳蛋白引入新肽段等方法,建立起了包含成千上万种AAV变体的大型AAV文库,为筛选靶向性更强的rAAV载体提供了有效的保障[24]。点突变技术是指应用易错聚合酶链反应(PCR)技术,将单个或多个碱基进行突变的方法。利用点突变技术,可以将AAV中Cap基因序列进行突变,从而形成一个或多个位点氨基酸不同的变体(图3-A)。Perabo等[25]对rAAV2 Cap序列中353-767的氨基酸序列进行了突变,产生了2.5×107个AAV变体,并从中进一步筛选出了能够降低被人血清抗体中和的变体。DNA体外重组(shuffling)技术是指使用核酸酶,将基因剪切后产生大量的片段,在此基础上,使之互为引物和模板进行PCR扩增,从而发生基因重组。使用此技术,将多种AAV的Cap序列剪切后,发生随机重新组合,就可以产生大量的变体[26-28](图3-B)。如Yang等[28]采用这种方法,建立了AAV文库,并从中筛选出变体M41,其对心脏的靶向性与目前报道的心脏靶向性最强的rAAV9相当,且在肝脏中的转基因表达明显较低。细胞表面特异性的受体是基因治疗载体结合的位点。因此,如果AAV表面有与特异性受体结合的配体,那么,其靶向性将大大提高。随机肽段插入法是指在目的基因中插入一段可表达特异性肽段的DNA序列。在AAV的Cap基因中,用直接结合法或转座子介导突变等方法,可以在不影响AAV包装的前提下在特定的位点插入一段能够表达特异性肽段的DNA序列,从而形成大量新的AAV变体[29-31](图3-C)。Müller等[30,31]使用这种方法建立了载体文库,并从中筛选出的AAV9 变体对人脐带血内皮细胞的亲和力为wtAAV9的200倍。
值得指出的是,目前对于rAAV血清型/变体的筛选主要停留在细胞和动物实验上,并不能直接地指导临床应用。例如,AAV8能够靶向小鼠的肝脏细胞,却在人的肝脏细胞中转导效率不高。因此,如何构建更加能够反映人的某种组织特异性的动物模型,并在此基础上筛选鉴定最佳的AAV血清型/变体,是亟需解决的问题。Lisowski 等[32]将一位患者的新鲜肝脏细胞接种在免疫缺陷的FRG小鼠肝脏上,从而构建了人-鼠肝的杂合体。这种动物模型对于AAV在肝脏疾病中的应用具有极高的应用价值,值得借鉴。其次,AAV文库的出现为大规模筛选靶向性更强的载体提供了可能,但不同的方法建立的文库中的变体的结构、组织靶向性不尽相同。因此,有必要加大多个文库间的比较,并从中筛选出对某一特定的组织靶向性最强的变体。此外,许多文库面临一个问题:大多数变体并不能有效地包装rAAV载体。如何整合并优化现有的构建文库方法,建立变体数量不庞大、但却含有高效变体的文库,也需要进一步的研究。Marsic等[33]通过计算机模拟的方法,先根据AAV衣壳蛋白的结构特点,结合目前已知的150个变体,在不影响AAV衣壳蛋白包装的前提下,仅针对衣壳蛋白表面的部分可变氨基酸位点进行调整,最终产生了大约8×105的rAAV2变体,大大减少了那些不能被包装的AAV变体的产生。
2.2 采用蛋白酶体抑制剂
泛素-蛋白酶体系统是细胞降解错误以及外源蛋白质的主要途径,在细胞周期、细胞凋亡等方面发挥着重要的作用[34,35]。不仅如此,泛素-蛋白酶体系统也在rAAV进入宿主细胞后的生物学过程中发挥了重要作用[36]。当rAAV进入细胞,离开内含体之后,其衣壳蛋白被泛素化标记。被泛素化标记的rAAV会被泛素-蛋白酶体系统降解,导致rAAV的转导效率下降[37,38]。在这个机制被揭示后,关于应用蛋白酶体抑制剂提高rAAV转导效率的报道相应地增加。
Duan等[37]最早报道:半胱氨酸蛋白酶抑制剂LLnL、泛素蛋白酶体抑制剂MG132等能明显将rAAV2在支气管上皮细胞的转导效率提高10倍左右。Jennings等[39]以类风湿性关节炎患者病变部位的人滑膜细胞为研究对象,发现蛋白酶体抑制剂zLLL能够明显增加含有白介素IL-10治疗基因的rAAV2的转基因表达。此外,蛋白酶体抑制剂MG132还可以提高rAAV在人黑色素瘤细胞M21、人胶质瘤细胞U87等多种肿瘤细胞中的转导效率[40]。
硼替佐米(Bortezomib)是目前已经被美国食品及药品管理局批准用于临床的蛋白酶体抑制剂,主要用于多发性骨髓瘤的治疗。现有不少学者针对这个药物在rAAV基因治疗中的应用进行了研究。Neukirchen等[41]研究发现Bortezomib可以明显提高细胞中rAAV介导的p53基因的表达水平,且二者具有协同的抗非小细胞肺癌的作用;Monahan等[42]在使用含有第八凝血因子治疗基因的rAAV2和rAAV8治疗A型血友病的狗时,同时注射了Bortezomib,结果发现仅Bortezomib单次给药就能使rAAV2和rAAV8的转导效率分别提高6倍和3倍,并能使血友病狗的凝血时间恢复正常,出血率降低90%。此外,研究显示,一种新的蛋白酶抑制剂卡非佐米(Carfilzomib)能够特异性地抑制糜蛋白酶样蛋白酶体的活性,其提高rAAV的转导效率[36]的效能与Bortezomib相当。
目前在rAAV转导效率研究中常用的蛋白酶体抑制剂大多为化学合成,但从中药中分离的一些化合物也有抑制蛋白酶体活性的作用,可提高rAAV的转导效率[43-45]。Zhang等[43]发现从中药雷公藤中提取出来的单体——雷公藤红素可以明显在细胞诱导分化前后增加前脂肪细胞3T3-L1中rAAV1的转导效率,其原因是雷公藤红素可以抑制蛋白酶体活性,增加rAAV入核。Wang等[44]进一步发现雷公藤红素的结构类似物——扁塑藤素也能通过同样的机制在体内外提高rAAV的转导效率,且扁塑藤素的作用较雷公藤红素强。
蛋白酶体抑制剂在提高rAAV转导效率的同时,它们的毒性作用也必须引起注意。例如,Bortezomib可导致胃肠道不适、周围神经病变、心力衰竭等不良反应,不少患者不得不减少使用剂量,甚至终止治疗[46-48],因此,在利用蛋白酶体抑制剂联合rAAV治疗疾病时,必须尽可能地将蛋白酶体的剂量控制在安全、有效的范围内。与此同时,现已证明一些中药单体具有蛋白酶体抑制剂的活性,能提高rAAV的转导效率,这为新的蛋白酶体抑制剂的研发开辟了新的方向,但是,也必须对它们的毒副作用进行严格的评估。
2.3 衣壳蛋白定点突变
在研究泛素化-蛋白酶体对rAAV影响时,Yan等[38]发现,经热处理的衣壳蛋白更容易被泛素化,提示衣壳蛋白在泛素化之前可能发生了构象变化或经历了某种修饰。随后,Zhong等[12,49,50]研究显示,细胞内的上皮生长因子受体酪氨酸激酶(Epidermal growth factor receptor protein tyrosine kinase,EGFR-PTK)能够将rAAV衣壳蛋白表面酪氨酸(Tyrosine,Y)残基磷酸化,磷酸化的衣壳蛋白将通过泛素化-蛋白酶体途径被降解,导致rAAV转导效率降低。两年后,同一课题组对rAAV2衣壳蛋白中的表面裸露的7个酪氨酸(Y)残基位点突变成苯丙氨酸(Phenylalanine,F),各个突变体均能有效提高rAAV2的转导效率,且Y730F能够分别在HeLa细胞和小鼠肝脏中的将转导效率提高10、30倍,能在小鼠体内将治疗血友病基因的第九凝血因子的表达效率提高10倍[12]。在此基础上,该课题组还尝试对 rAAV多个酪氨酸残基位点进行点突变,结果显示,AAV2-3M(Y444+500+730F)在小鼠肝脏细胞中的转导效率较AAV2单个位点的突变体高3倍,较wtAAV2提高至少30倍[51]。此外,Qi 等[52]对rAAV2同时进行了3个和6个位点的突变,结果显示:新构建的突变体AAV2-6M(Y252+272+444+500+704+730F)在肾小管上皮细胞中的转导效率最高。关于通过Y残基定点突变提高rAAV转导效率的研究主要集中在AAV2上,但这项技术对AAV6等血清型也适用[53]。不仅如此,衣壳蛋白Y残基定点突变还能进一步提高AAV变体的转导效率。如Klimczak等[54]对AAV变体ShH10进行定点突变(Y445F),新的载体在Müller细胞的转导效率较ShH10进一步提高,且能实现治疗基因——胶质细胞源性神经营养因子在视网膜中的稳定表达,减缓大鼠视网膜退行性变的病情进展[55]。
虽然,目前的衣壳蛋白突变大多将Y残基进行突变,但是Aslanidi等[56]用丝氨酸(Serine,S)/苏氨酸(Threonine,T)蛋白激酶JNK、p38MAPK处理细胞后,携带有增强绿色荧光蛋白(Enhanced green fluorescence protein,EGFP) 报 告 基 因 的rAAV2在细胞中基因表达明显增高,这表明对衣壳蛋白表面暴露的S和/或T磷酸化能降低病毒载体的转导效率。在此基础上,该课题组分别对AAV2衣壳蛋白上的S、T位点进行突变,结果发现,将S或T突变成缬氨酸(Valine V)的rAAV2载体的转导效率更强[56,57]。
对rAAV衣壳蛋表面的Y、S、T残基进行定点突能显著提高其转导效率,这种技术已经被越来越多的学者证实并采纳[58-61]。然而,衣壳蛋白突变不一定对所有的血清型有效。例如,Qiao等[62]构建了突变体AAV8(Y447F、Y733F)、AAV9(Y446F、Y731F),结果显示,突变后的AAV与wtAAV在基因转导效率上并无明显差别。这究竟是突变位点不佳,还是衣壳蛋白定点突变的方法对这两种血清型无效,尚待进一步的分析。其次,衣壳蛋白上能被磷酸化的位点有很多,但究竟对哪个位点、多少个位点进行突变,是突变某一种氨基酸还是多种氨基酸的残基位点,才能获得具有最强的转导效率的突变体,还需要深入的研究来证实。目前,已经有学者针对这个问题进行了初步的尝试,结果显示,AAV2-4M(Y444+500+730F+T491V)突变体的转导效率比突变体AAV2-3M(Y444+500+730F)还高2-3倍[57]。然而,这样的突变组合对于其他血清型的rAAV是否适用,还需要进一步的分析。
2.4 增加第二链的合成
虽然wtAAV能感染多种哺乳类细胞,但在缺乏辅助病毒或其他辅助因子情况下,其自身基因表达几乎检测不到。同样的,rAAV自身介导的转基因表达水平低下。其中一个重要原因是其ssDNA必须变成dsDNA才能完成转录和翻译,这个DNA第二链合成rAAV介导的转基因表达的限速环节[63]。
单链D序列结合蛋白(Single-stranded D-sequence-binding protein,ssD-BP)在rAAV基因组第二链合成的过程中发挥着重要的作用。Qing等[11,64,65]在20世纪90年代发现,当ssD-BP的Y残基位点被EGFR-PTK磷酸化后,它能与AAV基因组中的ITR中的D序列结合,从而导致DNA从3'端的复制受阻,影响dsDNA的合成。随后的研究表明:ssD-BP中的部分氨基酸序列与一种细胞内源性的可与免疫抑制药物FK506结合的蛋白(FK506-binding protein 52,FKBP52)相同。除了Y磷酸化,S或T磷酸化的FKBP52亦能显著抑制rAAV基因组的第二链合成[66]。
随着以上机制的揭示,关于通过调控FKBP52去磷酸化从而增加转基因表达的方法也逐渐增多。如Qing等[67]发现Y磷酸化的FKBP52是T细胞蛋白酪氨酸磷酸酶(T-cell protein tyrosine phosphatase,TC-PTP)的底物。HeLa细胞和小鼠过表达TC-PTP后,FKBP52的磷酸化程度显著降低,伴随着ssAAV的转导效率明显提升;Zhong 等[68]将TC-PTP基因包装进入rAAV组成新的病毒载体rAAV-TC-PTP,并将其与携带有报告基因的ssAAV病毒载体同时感染细胞,这种共感染的方法能安全有效的提高ssAAV的转导效率;Zhao等[69]发现细胞磷酸酶5(Protein phosphatase 5,PP5)能够介导FKBP52在S或T残基上的去磷酸化,增加单链rAAV的第二链合成;Jayandharan等[70]用3种rAAV载体共同感染小鼠,即携带有报告基因的ssAAV,过表达TC-PTP及PP5的病毒载体。这种方法能使靶细胞内FKBP52的Y、S、T残基均去磷酸化,最大程度降低第二链合成的抑制作用,结果显示,该方法使ssAAV的报告基因在小鼠肝脏中的表达效率提高了16倍。Ma等[71]在传统的三质粒包装rAAV的基础上,增加了含有PP5基因的质粒,这样包装纯化后的病毒含有rAAV2-EGFP和rAAV2-PP5两种病毒,这种混合的病毒在体内外的转导效率较单独的rAAV2-EGFP高5-10倍。
ssD-BP、FKBP52的发现阐明了ssAAV转导效率有限的根本原因,TC-PTP、PP5的应用能够使FKBP52残基去磷酸化,从而将抑制第二链合成的作用降低,增加rAAV介导的转基因表达效率。然而,需要注意的是,虽然通过构建过表达TC-PTP、PP5基因的细胞或小鼠,有助于阐明其作用机制,但是过表达这些基因对细胞或小鼠的生理功能是否有影响,目前尚无确切的研究报道。其次,直接将携带有TC-PTP、PP5基因的辅助rAAV注射到人体内,其安全性同样也需要深入评估。
2.5 将单链病毒载体改造成自身互补型双链载体
自然条件下存在的AAV的基因组是ssDNA。虽然人们已经发现了影响其第二链合成的关键酶,并且可以通过对关键酶的调控增加rAAV转基因表达效率,但将传统ss rAAV病毒载体直接改造成ds载体,则能更加快速有效地提高rAAV的转导效率。
早在2001年,McCarty等[72]将原来的rAAV2的包装的基因组的长度从4 474碱基减少至2 299碱基,首次分离了自身互补性(Self-complementary,sc)的rAAV载体,这种scAAV一端为正常的ITR,另一端为ITR的二聚体,中间的基因组是互补的双链,从而解除了在ssAAV病毒载体基因表达过程中合成第二链的限制。体外研究证实,scAAV的转导效率是ssAAV的5-190倍。随后不久,McCarty[73]等进一步研究表明:只要去除rAAV的一端的ITR的trs,就能避免末端ITR在复制后被Rep蛋白质剪切。这个新合成的DNA会在分子内部通过碱基配对的作用进行折叠,从而形成scAAV载体。动物实验显示:ssAAV2在小鼠肝脏中的表达效率仅有5%-10%,而scAAV2的表达效率却高达25%-50%。此后,Wang等[74]进一步将一端ITR中的部分D序列和trs一起删除,合成双链的scAAV2。这种新的rAAV载体不仅能在体外实现对黑色素瘤、肺癌等多种肿瘤细胞的转基因表达,并能在体内肝脏中高效表达转基因,并维持长达6个月。
这种新型的scAAV较传统的ssAAV的转基因表达效率大幅提高,可用于多种血清型、多种疾病的基因治疗中。例如,Nathwani等[75]研究发现:scAAV8能够快速地在细胞中形成有活性的双链线性基因组,并使人凝血因子IX的转导效率较ssAAV提高20倍左右,更加有效地纠正小鼠的出血状态;Gao等[76]合成的scAAV7、scAAV8在食蟹猕猴的肝脏细胞中的转导效率较传统ssAAV2有2个指数倍数的提高;Liu等[77]将scAAV2直接注射到大鼠感觉运动皮质、红核、背根神经节,结果显示这些地方沿着轴突有很强的报告基因表达。
然而,scAAV也有着一定的局限性。首先,scAAV提高转导效率是建立在牺牲基因装载容量的基础之上的,因为传统的ssAAV能包装约4 500碱基的基因,而scAAV载体的基因装载量只有2 300碱基左右,约为ssAAV的一半,这并不适合杜氏肌营养不良等治疗基因较长的疾病;其次,虽然目前研究者们已经成功地实现了scAAV在肝脏、肌肉、骨髓、眼等多种组织和细胞中的转导,但并非所有细胞都能被scAAV感染[78]。如Ding等分别使用携带有报告基因的scAAV2、ssAAV2、scAAV5、ssAAV5感染人极化气道上皮细胞,结果发现scAAV与ssAAV之间没有区别,这说明可能在某些细胞中,从单链合成双链并非转基因表达的限速环节[78,79]。再次,scAAV较ssAAV能够激发更强的免疫反应。如Martino[80]等研究结果表明,与注射ssAAV后的小鼠相比,注射scAAV后的小鼠体内的肿瘤坏死因子a、单核细胞趋化化蛋白1、g干扰素诱导蛋白等炎性因子明显升高,且肝脏中的中性粒细胞、巨噬细胞、自然杀伤细胞明显增多,这说明scAAV较ssAAV对机体产生的免疫反应更强;Wu 等[81]研究发现,scAAV能够较ssAAV明显增加转基因产物特异的CD8+T细胞的数量。由于过强的免疫反应不仅会导致抗体的产生,降低后续基因治疗的疗效,且对机体也有损伤,因此,如何合理控制scAAV的使用剂量,在提高疗效的同时,保证机体的安全是亟需探讨的。
3 结语
基因治疗不仅是遗传性疾病的最佳疗法,也在肿瘤、心血管疾病、自身免疫性疾病的治疗中有着重要的价值。rAAV免疫源性低、感染谱广,是目前基因治疗领域中的热门载体。然而,由于AAV血清型有限且对组织的靶向性不强,AAV进入细胞后会被蛋白酶体降解,且ssAAV必须实现向dsAAV的转变才能完成基因的表达,而第二链合成的过程在很大程度上受细胞内特异性蛋白抑制,rAAV的转导效率不尽如人意,限制了其广泛应用。
随着研究的不断深入,通过对AAV生命周期更加全面的了解,现已经建立了一系列有效的提高rAAV转导效率的方法。野生型的AAV只有13种,但在现代分子技术上建立的AAV文库包含了大量的变体,使载体数量有了几何倍数的提高,这为将来筛选特异性强的AAV载体提供了宝贵的资源;通过直接使用蛋白酶体抑制剂,或者对衣壳蛋白进行定点突变,均可以显著降低衣壳蛋白被泛素-蛋白酶体系统的识别,保障rAAV的转基因表达;TC-PTP、PP5的应用可以将细胞中限制第二链合成的蛋白活性降低,加速rAAV载体在靶细胞中的第二链合成;新合成的scAAV载体则可以直接跳过合成双链这个环节,快速地实现转基因的转录、翻译。除了目前最常用的这5类方法外,还可通过使用三氧化二砷增加细胞内活性氧、紫外线改变细胞内环境、在rAAV的衣壳蛋白上连接化学基团改变其对靶细胞的亲和性等方法提高rAAV的转导效率[63,82-84]。正是由于这些方法的发现、验证和应用,rAAV的转导效率大幅度提升,可用其进行基因治疗的疾病范围也逐渐扩大。目前,全球第一个以rAAV为载体的基因治疗药物——Glybera已经于2012年上市,并且还有关于rAAV基因治疗的多项临床试验正在进行中,有望早日应用于患者。
在今后的研究中,需要注意的是,现报道的提高rAAV转导效率的方法部分尚处于细胞和动物实验阶段,能否安全、有效地应用于临床,还需要进一步的判断评估。本综述中介绍的这些方法分别在rAAV衣壳蛋白与细胞绑定、胞内运输与降解、基因复制与转录等环节中发挥作用。因此,十分有必要将这些方法进行联合应用,以实现转导效率的最大化。可以采取以下策略,首先,在常规血清型和rAAV文库的基础上,筛选对某一特定组织靶向性最强的载体,并进一步根据载体的结构,突变其表面的部分衣壳蛋白的氨基酸残基,合成感染效率更佳的rAAV突变体;其次,若目的基因较小,则合成scAAV,若只能使用ssAAV,则可联合含有TCPTP、PP5的rAAV同时应用;最后,结合安全剂量下的蛋白酶抑制剂,实现目的基因的表达。事实上,在最近一次的乙型血友病临床试验中,科学家们已经将几种方法联合应用,包括本文介绍的以及没有介绍的,从而增加rAAV介导的转基因表达。这些方法包括:转基因DNA序列人源化、AAV8血清型、scDNA的基因组以及联合使用免疫抑制剂地塞米松等[85]。相信在不远的将来,通过科研和临床工作者们不断的深入探索和有效的交流合作,rAAV可以为维护人类的健康作出更加重要的贡献。
[1]Grieger JC, Samulski RJ. Adeno-associated virus vectorology,manufacturing, and clinical applications[J]. Methods Enzymol,2012, 507:229-254.
[2]Griesenbach U, Alton EW. Current status and future directions of gene and cell therapy for cystic fibrosis[J]. BioDrugs, 2011, 25(2):77-88.
[3]Mingozzi F, High KA. Therapeutic in vivo gene transfer for genetic disease using AAV:progress and challenges[J]. Nat Rev Genet,2011, 12(5):341-355.
[4]Tal J. Adeno-associated virus-based vectors in gene therapy[J]. J Biomed Sci, 2000, 7(4):279-291.
[5]Masat E, Pavani G, Mingozzi F. Humoral immunity to AAV vectors in gene therapy:challenges and potential solutions[J]. Discov Med, 2013, 15(85):379-389.
[6]Mingozzi F, High KA. Immune responses to AAV in clinical trials[J]. Curr Gene Ther, 2011, 11(4):321-330.
[7]Hareendran S, Balakrishnan B, Sen D, et al. Adeno-associated virus(AAV)vectors in gene therapy:immune challenges and strategies to circumvent them[J]. Rev Med Virol, 2013, 23(6):399-413.
[8]Logan GJ, A lexander IE. Adeno-associated virus vectors:immunobiology and potential use for immune modulation[J]. Curr Gene Ther, 2012, 12(4):333-343.
[9]刁勇, 许瑞安. 重组腺相关病毒载体诱导的天然免疫反应及机制[J]. 微生物学报, 2012, 52(5):550-557.
[10]张凤兰, 文朝阳, 丁卫. 腺相关病毒基因治疗载体的改良与应用[J]. 首都医科大学学报, 2009, 30(4):565-572.
[11]Qing K, Khuntirat B, Mah C, et al. Adeno-associated virus type 2-mediated gene transfer:correlation of tyrosine phosphorylation of the cellular single-stranded D sequence-binding protein with transgene expression in human cells in vitro and murine tissues in vivo[J]. J Virol, 1998, 72(2):1593-1599.
[12]Zhong L, Li B, Mah CS, et al. Next generation of adeno-associated virus 2 vectors:point mutations in tyrosines lead to high-efficiency transduction at lower doses[J]. Proc Natl Acad Sci USA, 2008,105(22):7827-732.
[13]Seisenberger G, Ried MU, Endress T, et al. Real-time singlemolecule imaging of the infection pathway of an adeno-associated virus[J]. Science, 2001, 294(5548):1929-1932.
[14]Nonnenmacher M, Weber T. Adeno-associated virus 2 infection requires endocytosis through the CLIC/GEEC pathway[J]. Cell Host Microbe, 2011, 10(6):563-576.
[15]Johnson JS, Gentzsch M, Zhang L, et al. AAV exploits subcellular stress associated with inflammation, endoplasmic reticulum expansion, and misfolded proteins in models of cystic fibrosis[J]. PLoS Pathog, 2011, 7(5):e1002053.
[16]Wu Z, Asokan A, Samulski RJ. Adeno-associated virus serotypes:vector toolkit for human gene therapy[J]. Mol Ther, 2006, 14(3):316-327.
[17]Gao GP, Alvira MR, Wang L, et al. Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy[J]. Proc Natl Acad Sci USA, 2002, 99(18):11854-11859.
[18]Miyake K, Miyake N, Yamazaki Y, et al. Serotype-independent method of recombinant adeno-associated virus(AAV)vector production and purification[J]. J Nippon Med Sch, 2012, 79(6):394-402.
[19]Ling C, Lu Y, Cheng B, et al. High-efficiency transduction of liver cancer cells by recombinant adeno-associated virus serotype 3 vectors[J]. J Vis Exp, 2011, (49):doo:10.3791/2538.
[20]Ling C, Lu Y, Kalsi JK, et al. Human hepatocyte growth factor receptor is a cellular coreceptor for adeno-associated virus serotype 3[J]. Hum Gene Ther, 2010, 21(12):1741-1747.
[21]Cheng B, Ling C, Dai Y, et al. Development of optimized AAV3 serotype vectors:mechanism of high-efficiency transduction of human liver cancer cells[J]. Gene Ther, 2012, 19(4):375-384.
[22]Markakis EA, Vives KP, Bober J, et al. Comparative transduction efficiency of AAV vector serotypes 1-6 in the substantia nigra and striatum of the primate brain[J]. Mol Ther, 2010, 18(3):588-593.
[23]Aschauer DF, Kreuz S, Rumpel S. Analysis of transduction efficiency, tropism and axonal transport of AAV serotypes 1, 2,5, 6, 8 and 9 in the mouse brain[J]. PLoS One, 2013, 8(9):e76310.
[24]Bartel MA, Weinstein JR, Schaffer DV. Directed evolution of novel adeno-associated viruses for therapeutic gene delivery[J]. GeneTher, 2012, 19(6):694-700.
[25]Perabo L, Endell J, King S, et al. Combinatorial engineering of a gene therapy vector:directed evolution of adeno-associated virus[J]. J Gene Med, 2006, 8(2):155-162.
[26]Gray SJ, Blake BL, Criswell HE, et al. Directed evolution of a novel adeno-associated virus(AAV)vector that crosses the seizurecompromised blood-brain barrier(BBB)[J]. Mol Ther, 2010,18(3):570-578.
[27]Kienle E, Senis E, Börner K, et al. Engineering and evolution of synthetic adeno-associated virus(AAV)gene therapy vectors via DNA family shuffling[J]. J Vis Exp, 2012, (62). pii:3819. doi:10.3791/3819
[28]Yang L, Jiang J, Drouin LM, et al. A myocardium tropic adenoassociated virus(AAV)evolved by DNA shuffling and in vivo selection[J]. Proc Natl Acad Sci USA, 2009, 106(10):3946-3951.
[29]Koerber JT, Schaffer DV. Transposon-based mutagenesis generates diverse adeno-associated viral libraries with novel gene delivery properties[J]. Methods Mol Biol, 2008:434161-434170.
[30]Muller OJ, Kaul F, Weitzman MD, et al. Random peptide libraries displayed on adeno-associated virus to select for targeted gene therapy vectors[J]. Nat Biotechnol, 2003, 21(9):1040-1046.
[31]Varadi K, Michelfelder S, Korff T, et al. Novel random peptide libraries displayed on AAV serotype 9 for selection of endothelial cell-directed gene transfer vectors[J]. Gene Ther, 2012, 19(8):800-809.
[32]Lisowski L, Dane AP, Chu K, et al. Selection and evaluation of clinically relevant AAV variants in a xenograft liver model[J]. Nature, 2014, 506(7488):382-386.
[33]Marsic D, Govindasamy L, Currlin S, et al. Vector design tour de force:integrating combinatorial and rational approaches to derive novel adeno-associated virus variants[J]. Mol Ther, 2014, 22(11):1900-1909.
[34]Engel K, Bassermann F. The ubiquitin proteasome system and its implications for oncology[J]. Dtsch Med Wochenschr, 2013, 138(22):1178-1182.
[35]Shen M, Schmitt S, Buac D, et al. Targeting the ubiquitinproteasome system for cancer therapy[J]. Expert Opin Ther Targets, 2013, 17(9):1091-1108.
[36]M itchell AM, Samu lski RJ. Mechanistic insights into the enhancement of adeno-associated virus transduction by proteasome inhibitors[J]. J Virol, 2013, 87(23):13035-13041.
[37]Duan D, Yue Y, Yan Z, et al. Endosomal processing lim its gene transfer to polarized airway epithelia by adeno-associated virus[J]. J Clin Invest, 2000, 105(11):1573-1587.
[38]Yan Z, Zak R, Luxton GW, et al. Ubiquitination of both adenoassociated virus type 2 and 5 capsid p roteins affects the transduction efficiency of recombinant vectors[J]. J Virol, 2002,76(5):2043-2053.
[39]Jennings K, Miyamae T, Traister R, et al. Proteasome inhibition enhances AAV-mediated transgene exp ression in human synoviocytes in vitro and in vivo[J]. Mol Ther, 2005, 11(4):600-607.
[40]Przystal JM, Umukoro E, Stoneham CA, et al. Proteasome inhibition in cancer is associated with enhanced tumor targeting by the adenoassociated virus/phage[J]. Mol Oncol, 2013, 7(1):55-66.
[41]Neukirchen J, Meier A, Rohrbeck A, et al. The proteasome inhibitor bortezomib acts differently in combination with p53 gene transfer or cytotoxic chemotherapy on NSCLC cells[J]. Cancer Gene Ther,2007, 14(4):431-439.
[42]Monahan PE, Lothrop CD, Sun J, et al. Proteasome inhibitors enhance gene delivery by AAV virus vectors expressing large genomes in hemophilia mouse and dog models:a strategy for broad clinical application[J]. Mol Ther, 2010, 18(11):1907-1916.
[43]Zhang FL, Jia SQ, Zheng SP, et al. Celastrol enhances AAV1-mediated gene expression in mice adipose tissues[J]. Gene Ther, 2011, 18(2):128-134.
[44]Wang LN, Wang Y, Lu Y, et al. Pristimerin enhances recombinant adeno-associated virus vector-mediated transgene expression in human cell lines in vitro and murine hepatocytes in vivo[J]. J Integr Med, 2014, 12(1):20-34.
[45]Ling C, Wang Y, Zhang Y, et al. Selective in vivo targeting of human liver tumors by optimized AAV3 vectors in a murine xenograft model[J]. Hum Gene Ther, 2014, 25(12):1023-1034.
[46]Rampen A J, Jongen J L, van Heuvel I, et al. Bortezomib-induced polyneuropathy[J]. Neth J Med, 2013, 71(3):128-133.
[47]Voortman J, Giaccone G. Severe reversible cardiac failure after bortezomib treatment combined with chemotherapy in a non-small cell lung cancer patient:a case report[J]. BMC Cancer, 2006, (6):129.
[48]Petrucci MT, Giraldo P, Corradini P, et al. A prospective,international phase 2 study of bortezomib retreatment in patients with relapsed multiple myeloma[J]. Br J Haematol, 2013, 160(5):649-659.
[49]Zhong L, Zhao W, Wu J, et al. A dual role of EGFR protein tyrosine kinase signaling in ubiquitination of AAV2 capsids and viral second-strand DNA synthesis[J]. Mol Ther, 2007, 15(7):1323-1330.
[50]Zhong L, Li B, Jayandharan G, et al. Tyrosine-phosphorylation of AAV2 vectors and its consequences on viral intracellular trafficking and transgene expression[J]. Virology, 2008, 381(2):194-202.
[51]Markusic DM, Herzog RW, Aslanidi GV, et al. High-efficiency transduction and correction of murine hemophilia B using AAV2 vectors devoid of multiple surface-exposed tyrosines[J]. Mol Ther, 2010, 18(12):2048-2056.
[52]Qi YF, Li QH, Shenoy V, et al. Comparison of the transduction efficiency of tyrosine-mutant adeno-associated virus serotype vectors in kidney[J]. Clin Exp Pharmacol Physiol, 2013, 40(1):53-55.
[53]Qiao C, Zhang W, Yuan Z, et al. Adeno-associated virus serotype 6 capsid tyrosine-to-phenylalanine mutations improve gene transfer to skeletal muscle[J]. Hum Gene Ther, 2010, 21(10):1343-1348.
[54]Klimczak RR, Koerber JT, Dalkara D, et al. A novel adenoassociated viral variant for efficient and selective intravitreal transduction of rat Muller cells[J]. PLoS One, 2009, 4(10):e7467.
[55]Dalkara D, Kolstad KD, Guerin KI, et al. AAV mediated GDNF secretion from retinal glia slows down retinal degeneration in a rat model of retinitis pigmentosa[J]. Mol Ther, 2011, 19(9):1602-1608.
[56]Aslanidi GV, Rivers AE, Ortiz L, et al. High-efficiency transduction of human monocyte-derived dendritic cells by capsid-modified recombinant AAV2 vectors[J]. Vaccine, 2012, 30(26):3908-3917.
[57]Aslanidi GV, Rivers AE, Ortiz L, et al. Optimization of the capsid of recombinant adeno-associated virus 2(AAV2)vectors:the final threshold?[J]. PLoS One, 2013, 8(3):e59142.
[58]Zolotukhin I, Luo D, Gorbatyuk O, et al. Improved adeno-associated viral gene transfer to murine glioma[J]. J Genet Syndr Gene Ther, 2013, 4(133):12815.
[59]Dai X, Han J, Qi Y, et al. AAV-mediated lysophosphatidylcholine acyltransferase 1(Lpcat1)gene replacement therapy rescues retinal degeneration in rd11 mice[J]. Invest Ophthalmol Vis Sci,2014, 55(3):1724-1734.
[60]Hakim CH, Yue Y, Shin JH, et al. Systemic gene transfer reveals distinctive muscle transduction profile of tyrosine mutant AAV-1, -6, and -9 in neonatal dogs[J]. Mol Ther Methods Clin Dev,2014, 1:14002.
[61]Mowat FM, Gornik KR, Dinculescu A, et al. Tyrosine capsid-mutant AAV vectors for gene delivery to the canine retina from a subretinal or intravitreal approach[J]. Gene Ther, 2014, 21(1):96-105.
[62]Qiao C, Yuan Z, Li J, et al. Single tyrosine mutation in AAV8 and AAV9 capsids is insufficient to enhance gene delivery to skeletal muscle and heart[J]. Human Gene Therapy, Part B:Methods,2012, 23(1):29-37.
[63]Ferrari FK, Samulski T, Shenk T, et al. Second-strand synthesis is a rate-limiting step for efficient transduction by recombinant adenoassociated virus vectors[J]. J Virol, 1996, 70(5):3227-3234.
[64]Qing K, Wang XS, Kube DM, et al. Role of tyrosine phosphorylation of a cellular protein in adeno-associated virus 2-mediated transgene expression[J]. Proc Natl Acad Sci USA, 1997, 94(20):10879-10884.
[65]Mah C, Qing K, Khuntirat B, et al. Adeno-associated virus type 2-mediated gene transfer:role of epidermal growth factor receptor protein tyrosine kinase in transgene expression[J]. J Virol, 1998,72(12):9835-9843.
[66]Qing K, Hansen J, Weigel-Kelley KA, et al. Adeno-associated virus type 2-mediated gene transfer:role of cellular FKBP52 protein in transgene expression[J]. J Virol, 2001, 75(19):8968-8976.
[67] Qing K, Li W, Zhong L, et al. Adeno-associated virus type 2-mediated gene transfer:role of cellular T-cell protein tyrosine phosphatase in transgene expression in established cell lines in vitro and transgenic mice in vivo[J]. J Virol, 2003, 77(4):2741-2746.
[68]Zhong L, Chen L, Li Y, et al. Self-complementary adeno-associated virus 2(AAV)-T cell protein tyrosine phosphatase vectors as helper viruses to improve transduction efficiency of conventionalsingle-stranded AAV vectors in vitro and in vivo[J]. Mol Ther,2004, 10(5):950-957.
[69]Zhao W, Wu J, Zhong L, et al. Adeno-associated virus 2-mediated gene transfer:role of a cellu lar serine/threonine p rotein phosphatase in augmenting transduction efficiency[J]. Gene Ther, 2007, 14(6):545-550.
[70]Jayandharan GR, Zhong L, Li B, et al. Strategies for improving the transduction efficiency of single-stranded adeno-associated virus vectors in vitro and in vivo[J]. Gene Ther, 2008, 15(18):1287-1293.
[71]Ma W, Li B, Ling C, et al. A simple method to increase the transduction efficiency of single-stranded adeno-associated virus vectors in vitro and in vivo[J]. Hum Gene Ther, 2011, 22(5):633-640.
[72]McCarty DM, Monahan PE, Samulski RJ. Self-complementary recombinant adeno-associated virus(scAAV)vectors promote efficient transduction independently of DNA synthesis[J]. Gene Ther, 2001, 8(16):1248-1254.
[73]McCarty DM, Fu H, Monahan PE, et al. Adeno-associated virus terminal repeat(TR)mutant generates self-complementary vectors to overcome the rate-limiting step to transduction in vivo[J]. Gene Ther, 2003, 10(26):2112-2118.
[74]Wang Z, Ma HI, Li J, et al. Rapid and highly efficient transduction by double-stranded adeno-associated virus vectors in vitro and in vivo[J]. Gene Ther, 2003, 10(26):2105-2111.
[75]Nathwani AC, Gray JT, Ng CY, et al. Self-complementary adenoassociated virus vectors containing a novel liver-specific human factor IX expression cassette enable highly efficient transduction of murine and nonhuman primate liver[J]. Blood, 2006, 107(7):2653-2661.
[76]Gao GP, Lu Y, Sun X, et al. High-level transgene expression in nonhuman primate liver with novel adeno-associated virus serotypes containing self-complementary genomes[J]. J Virol, 2006, 80(12):6192-6194.
[77]Liu Y, Keefe K, Tang X, et al. Use of self-complementary adenoassociated virus serotype 2 as a tracer for labeling axons:implications for axon regeneration[J]. PLoS One, 2014, 9(2):e87447.
[78]McCarty DM. Self-complementary AAV vectors;advances and applications[J]. Mol Ther, 2008, 16(10):1648-1656.
[79]Ding W, Yan Z, Zak R, et al. Second-strand genome conversion of adeno-associated virus type 2(AAV-2)and AAV-5 is not rate limiting following apical infection of polarized human airway epithelia[J]. J Virol, 2003, 77(13):7361-7366.
[80]Martino AT, Suzuki M, Markusic DM, et al. The genome of selfcomplementary adeno-associated viral vectors increases Toll-like receptor 9-dependent innate immune responses in the liver[J]. Blood, 2011, 117(24):6459-6468.
[81]Wu T, Topfer K, Lin S W, et al. Self-complementary AAVs induce more potent transgene product-specific immune responses compared to a single-stranded genome[J]. Mol Ther, 2012, 20(3):572-579.
[82]Mitchell AM, Li C, Samulski RJ. Arsenic trioxide stabilizes accumulations of adeno-associated virus virions at the perinuclear region, increasing transduction in vitro and in vivo[J]. J Virol,2013, 87(8):4571-4583.
[83]Le HT, Yu QC, Wilson JM, et al. Utility of PEGylated recombinant adeno-associated viruses for gene transfer[J]. J Control Release,2005, 108(1):161-177.
[84]Ponnazhagan S, Mahendra G, Kumar S, et al. Conjugate-based targeting of recombinant adeno-associated virus type 2 vectors by using avidin-linked ligands[J]. J Virol, 2002, 76(24):12900-12907.
[85]Nathwani AC, Tuddenham EG, Rangarajan S, et al. Adenovirusassociated virus vector-mediated gene transfer in hemophilia B[J]. N Engl J Med, 2011, 365(25):2357-2365.
(责任编辑 狄艳红)
Research Advances on Increasing the Transduction Efficiency of Recombinant Adeno-associated Viral Vectors
Yin Zifei1Wang Li’na1Wang Yuan1Ling Chen2
(1. Second Military Medical University,People’s Liberation Army,Shanghai200433;2. University of Florida,Florida32610)
The recombinant adeno-associated virus(rAAV)vector has emerged as one of the promising and commonly-used vectors in gene therapy research. The first gene therapy drug in clinic approved in Europe is based on rAAV. Due to the relatively limited transduction efficiency, the cost of the rAAV-mediated treatment is expensive. Additionally, high dose of rAAV may trigger host immune response, resulting in the curative effect reduced. Therefore, how to enhance the transduction efficiency of rAAV has been a hot issue in gene therapy. Hitherto there are five common methods to achieve this goal:selecting tissue-specific tropism serotypes and variants, using proteasome inhibitors, mutating capsid surface-exposed amino-acids, increasing second-strand DNA synthesis, and producing self-complementary vectors. In this paper we systemically review the above methods from the aspects of principle, status of application, advantages and disadvantages.
recombinant adeno-associated virus vector;gene therapy;transduction efficiency
10.13560/j.cnki.biotech.bull.1985.2015.09.007
2014-11-04
国家自然科学基金项目(81303112)
殷子斐,女,博士研究生,研究方向:中医药与基因治疗的联合应用;E-mail:yinzifei870730smmu@163.com
凌晨,男,博士,助理教授,研究方向:以腺相关病毒为载体的基因治疗;E-mail:lingchen@peds.ufl.edu

